Обоснование
Гиперпластические процессы в гортани в настоящее время остаются весьма распространенной патологией ЛОР-органов, составляя 8,4% от их общего числа. Большое значение данной проблемы обусловлено тем, что гиперпластические процессы в гортани склонны к малигнизации с дальнейшим развитием рака гортани, который составляет 69–70% среди опухолей верхних дыхательных путей [1–3].
Трудности диагностики гиперпластических процессов в гортани связаны с тем, что для ранних этапов заболевания характерно бессимптомное течение. Кроме того, гистологическая верификация затрудняется сложным анатомическим строением органа и расположением патологических процессов в местах, труднодоступных для взятия биопсии [4]. Оценка гистологической картины новообразования является субъективным методом, зачастую возникают сложности при определении грани, где дисплазия переходит в сarcinoma in situ, что приводит к различным интерпретациям одних и тех же гистологических препаратов в разных клиниках. Таким образом, необходимо применение количественных методов при постановке патологоанатомического диагноза.
Цель исследования: совершенствование диагностики заболеваний гортани путем морфометрии ядерного полиморфизма клеток эпителия истинных голосовых складок.
Методы
Проводилось проспективное диагностическое исследование, в которое были включены пациенты обоих полов в возрасте от 26 до 62 лет с предраковыми забюолеваниями гортани. Объектами исследования стали цитологические препараты биопсийного материала из визуально измененных участков слизистой оболочки гортани 30 пациентов с хроническим гиперпластическим ларингитом (ХГЛ) и папилломатозом/папилломой гортани, проходивших лечение в МЗЧР ГБУ «Республиканский онкологический диспансер» (Грозный) в период с 2019 по 2020 г.
Исследовали цитологические препараты, полученные путем аспирационной биопсии, которые окрашивали гематоксилин-эозином.
Кариометрию проводили при помощи компьютерного анализатора изображений на базе светового микроскопа Olympus BX-51 (Olympus, Россия) и цифровой камеры Olympus BX-50 (Olympus, Россия). Измеряли площадь ядра, периметр, наибольший и наименьший диаметры, фактор формы ядра, который определяется как отношение квадрата периметра к площади ядра. Для исключения субъективизма для каждого препарата измеряли подряд по 100 верифицированных клеток: большие, маленькие, в группах и изолированные.
Системный анализ морфометрических данных проводили с помощью методов вариационной статистики, для оценки достоверности различий по средним величинам применяли U-критерий (Уилкоксона–Манна–Уитни).
Результаты
С целью объективизации оценки величины ядерного полиморфизма при предраковых состояниях эпителия истинных голосовых складок проводилась морфометрия ядер (кариометрия) эпителиоцитов больных ХГЛ (простая гиперплазия, гиперплазия с дисплазией II–III степеней) и папилломатозом гортани (плоскоклеточные папилломы без дисплазии, папилломы с дисплазией III степени), плоскоклеточным неороговевающим раком (G2), возникшим на фоне папиллярной гиперплазии многослойного плоского эпителия (МПЭ) и, соответственно, на фоне папилломатоза.
Использовался набор параметров ядра эпителиоцита, который включал площадь ядра, периметр, наибольший и наименьший диаметры, фактор формы и др.
Патогистологически у пациентов с ХГЛ простая гиперплазия МПЭ была установлена в 23,33% случаев (7 пациентов), гиперплазия и дисплазия II–III степеней обнаружены у 8 (26,67%), плоскоклеточный неороговевающий рак (G2) – у 4 (13,33%).
Среди больных папилломатозом гортани плоскоклеточная папиллома без дисплазии диагностировалась у 3 (10%) человек, папиллома и дисплазия II–III степеней выявлена у 6 (26,67%) и плоскоклеточный неороговевающий рак (G2) – у 2 (6,67%) (табл. 1).
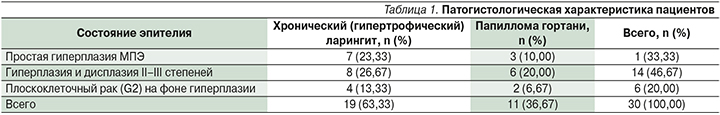
Результаты анализа полученных данных при различных состояниях эпителия истинных голосовых складок пациентов с ХГЛ приведены в табл. 2.
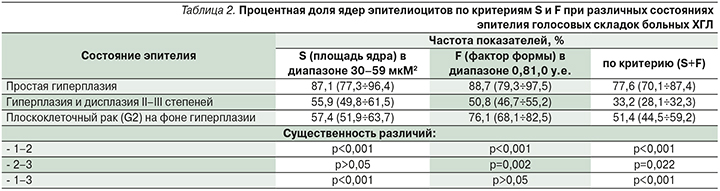
Как свидетельствуют данные табл. 2, достоверную информацию о различиях в состоянии ядер эпителиоцитов в сравниваемых группах несет комбинация применяемых критериев S и F. Учет значений величин показателя (S+F) в наибольшей степени соответствует патогистологической сущности понятия ядерного полиморфизма при оценке различных состояний эпителия.
При тяжелой дисплазии III степени более чем вдвое уменьшается число клеток с ядрами средних размеров, которые имеют правильную круглую форму, соответственно, удваивается доля клеток с неправильной формой ядра и отклонениями размеров от средних величин. Переход дисплазии в рак отражается увеличением до 51,4% частоты критерия (S+F), при этом сохраняется достоверное различие его величины от простой гиперплазии и тяжелой дисплазии.
Известно, что рак гортани может развиваться как de novo, так и на фоне хронических заболеваний, сопровождающихся гиперплазией МПЭ, а также на фоне папилломатоза. Градации патогистологических изменений эпителия при папилломатозе и папилломах такие же, как и при ХГЛ. Изменения могут касаться нарушения процессов пролиферации и дифференцировки эпителия и выражаться в развитии дисплазии разной степени или интраэпителиальной карциномы.
Такие изменения происходят гистологически без нарушения целостности базальной мембраны. При злокачественной трансформации эпителия папиллом клетки приобретают другие качественные характеристики, нарушается целостность базальной мембраны. Следует отметить, что злокачественные опухоли, которые возникли на фоне папиллярной гиперплазии или папилломатоза, не имели гистологических различий. В некоторых случаях было возможно установить связь между папилломой и раком, когда в одном гистологическом препарате оказывались гистоструктуры двух новообразований. Исходя из вышесказанного, нами была проведена кариометрия плоскоклеточных папиллом с различным состоянием эпителия по схеме, использованной для анализа состояния эпителия при ХГЛ. Полученные результаты приведены в табл. 3.
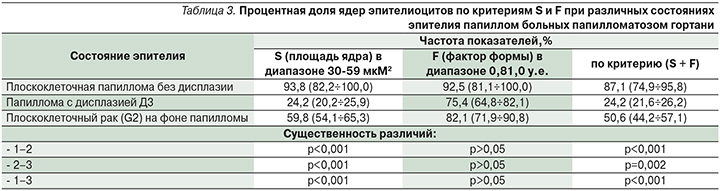
Данные табл. 3 свидетельствуют о том, что критерий F при различных состояниях эпителия папиллом не демонстрирует существенных различий. Однако его сочетание с показателем S дает возможность установить закономерность изменений при папилломатозе, близкую к таковой при гиперпластическом ларингите. Величина показателя (S+F) на уровне 50,6% у больных плоскоклеточным раком (G2) на фоне папилломы корреспондируется с уровнем для плоскоклеточного рака на фоне гиперплазии (50,7%), что свидетельствует о качестве единого гистопатологического строения опухолей, как и вероятного механизма их возникновения.
Обсуждение
В многочисленных морфологических исследованиях показано, что среди злокачественных новообразований гортани в 98% наблюдений выявляется плоскоклеточный рак, развивающийся из эпителия слизистой оболочки гортани [5–8].
Среди множества классификаций предраковых состояний гортани, наиболее распространена предложенная М.Ф. Глазуновым, которая подразделяет все предраковые заболевания на облигатный предрак – предшественник рака и факультативный – не всегда приводящий к раку [5].
Данное деление весьма условно, т.к. факультативный и облигатный предраки клинически мало различимы и от ранних стадий злокачественных новообразований гортани [9, 10].
В клинической практике своевременная полноценная диагностика предопухолевых заболеваний не менее важна, чем своевременное выявление ранних стадий рака гортани.
Однако инвазивный рост рака не всегда проходит все предшествующие ему стадии развития и может происходить непосредственно из участков дисплазии I или II степени – пролиферативных изменений в эпителии с нарушением процессов созревания клеток.
Современные научные данные о частоте перерождения предопухолевых процессов разноречивы. В первую очередь это характерно для папилломатоза гортани, озлокачествление которого наступает от 3,1 до 37,0% наблюдений [11–14]. Частота раковой трансформации дисплазии, кератоза, ХГЛ, по данным как отечественных, так и зарубежных авторов, составляет 3–8,3% [3, 5, 15].
Опасность развития злокачественной опухоли на фоне гиперпластических процессов в эпителии истинных голосовых складок увеличивается в зависимости от накопления нарушений процессов пролиферации и дифференцировки, сопровождается появлением клеточной атипии, которую следует учитывать при оценке предраковых состояний эпителия. Цитологически атипия при дисплазии измеряется величиной дискариоз – изменения ядра эпителиальных клеток (размеров ядер, нуклеол, их формы и контуров, характера распределения хроматина). Гистологически эти изменения описываются термином «ядерный полиморфизм». Критерий скорее качественный, чем количественный, который учитывает вариации размеров и формы ядер.
При гистопатологической оценке дисплазии, таким образом, на первое место выходит критерий нарушения стратификации эпителия и только после этого дается характеристика клеточного состава эпителия в зоне поражения. Учитывается также наличие нарушений базальной мембраны эпителия.
Заключение
В результате проведенного исследования установлено, что около половины больных ХГЛ и папилломатозом гортани имели плоскоклеточные интраэпителиальные поражения высокой степени, которые являются предраковыми состояниями.
С помощью морфометрического исследования показано, что объективный критерий (S+F) состояния эпителиоцитов в наибольшей степени соответствует гистопатологической сущности понятия ядерного полиморфизма как одного из основных признаков малигнизации эпителия.
Установлены существенные различия между и предраковыми состояниями эпителия, и плоскоклеточным раком, возникающим на фоне папиллярной гиперплазии или папилломатоза. Изменения параметров ядер эпителиоцитов после перехода эпителия от одного состояния к другому однотипны для гиперпластического ларингита и папилломатоза и, вероятно, отражают общую закономерность изменений при злокачественной трансформации плоского эпителия.
Дифференцировать доброкачественный патологический процесс по цитологическим препаратам не всегда представляется возможным. Использование морфометрии клеток позволяет объективизировать цитологическое исследование и выделить значимые для дифференциальной диагностики параметры. В проведенном исследовании наиболее информативными оказались показатель площади ядра (S) в диапазоне средних величин 30> 59 мкМ2 и фактора формы (F) в диапазоне 0,8>1,0 у.е. Эти показатели отражали число ядер средних размеров и близкой к круглой форме. Полученные количественные показатели могут быть использованы в качестве дополнительного, объективного дифференциально диагностического критерия при разграничении предраковых (диспластических) и раковых изменений в эпителии истинных голосовых связок.
Благодарности. Предоставляется возможность выразить слова благодарности тем, чей вклад в исследование был недостаточным для признания их соавторами (подробнее см. URL: http://www.icmje.org/recommendations/translations/russian2016.pdf), но вместе с тем считаются авторами значимыми (консультации, техническая помощь, переводы и пр.).


