Введение
В последние годы наблюдается увеличение частоты рецидивов инфекционно-воспалительных заболеваний влагалища, вызванных условно-патогенными микроорганизмами. Так, J.D. Sobel et al. в 2019 г. отмечают, что рецидивы дисбиоза влагалища выявляются в 69–80% наблюдений в течение 12 месяцев [1].
Исследователи связывают высокую частоту рецидивов с формированием биопленок, развитием резистентности микроорганизмов к наиболее часто применяемым лекарственным средствам и низкой скоростью восстановления нормальной микрофлоры [2]. Сочетанные инфекции, вызванные аэробно-анаэробно-грибковыми ассоциациями, могут быть еще одним объяснением рецидивирующего течения [3].
Парадоксальным можно считать тот факт, что взаимное влияние вирусных и бактериальных инфекций изучено недостаточно и не учитывается в клинических рекомендациях при известной высокой частоте инфицированности населения вирусами группы герпеса и папилломы. Их влияние на иммунную систему и способность «уклоняться» от ее защитных реакций нарушают «иммунологический надзор» со стороны врожденного иммунитета на локальном уровне, способствуя формированию хронических форм заболевания с частыми рецидивами [4].
Ранее проведенное нами исследование продемонстрировало, что лечение первого эпизода вульвовагинита сочетанной вирусно-бактериальной этиологии комбинированным антибактериальным средством без восстановления иммунной защиты приводит к рецидивам заболевания в 36% наблюдений в течение года [5].
В настоящее время получены сведения об участии цитокинов и хемокинов в реализации врожденного иммунного ответа слизистых оболочек женского репродуктивного тракта, особенно в отношении вирусов [4]. Цитокины – это регуляторные белки (клеточные мессенджеры), регулирующие функцию иммунных клеток. Адаптивный иммунитет – патоген-специфический иммунный ответ, также прямо или косвенно опосредуется цитокинами. Тh1-клеточный иммунитет обеспечивает воспалительную реакцию и включает уничтожение патогенов макрофагами и активированными CD8+ Т-клетками [6].
В связи с этим использование иммунодиагностики и иммуномодулирующей терапии значительно увеличивает возможности оказания полноценной медицинской помощи пациенткам с сочетанными инфекциями и профилактики рецидивов [7, 6].
Цель исследования: оценить эффективность терапии и частоту рецидивов у пациенток с хроническими рецидивирующими инфекционно-воспалительными заболеваниями нижнего отдела полового тракта сочетанной вирусно-бактериальной этиологии при использовании различных режимов локальной иммуномодулирующей терапии.
Методы
Проведено проспективное рандомизированное сравнительное клиническое исследование в параллельных группах, выполненное в 2020 г. на базе женской консультации ГБУЗ ТО «Перинатальный центр» (Тюмень) в соответствии с Хельсинкской декларацией ВМА (2008, Сеул), правилами Надлежащей клинической практики и другими применимыми в Российской Федерации нормативными документами. Все пациентки подписали информированное добровольное согласие на участие в исследовании.
Включены 58 пациенток с дисбиозом влагалища (бактериальный вагиноз, кандидозный вульвовагинит, аэробный вагинит, герпес-вирусная и папилломавирусная инфекции нижнего отдела полового тракта в различных сочетаниях) с хроническим рецидивирующим течением (более 3 эпизодов в течение одного года).
Пациентки были разделены на две группы. В обеих группах проведена этиотропная (антибактериальная) терапия с помощью комплексного препарата широкого спектра действия с антибактериальным, противогрибковым и противовоспалительным эффектами по 1 вагинальной таблетке 1 раз в сутки на ночь продолжительностью 10 дней. Кроме того, в I группе (n=30) использовали препарат Суперлимф в дозе 25 ЕД вагинально ежедневно, всего – 10 введений, во II (n=28) – Суперлимф в дозе 10 ЕД вагинально ежедневно, на курс – 20 введений.
Критерии включения: возраст 18–49 лет, рецидивирующее течение заболевания, овуляторный менструальный цикл, изокоагуляция кро-ви, информированное согласие пациентки.
Критерии исключения: инфекции, передаваемые половым путем – ИППП (кроме вирусных), гинекологические заболевания (миома матки, эндометриоз, пороки развития, воспалительные заболевания верхних отделов полового тракта), тяжелые соматические заболевания, резус-отрицательная кровь.
Третью группу составили 20 пациенток без гинекологических заболеваний для контроля лабораторных показателей цитокинов. Применялись клинические, принятые в гинекологии и лабораторные методы. Оценку проводили до и через 14 дней после лечения. Выполняли микроскопию мазков влагалищного содержимого, окрашенных по Граму; использовали метод амплификации нуклеиновых кислот (полимеразная цепная реакция) в режиме реального времени для идентификации вирусов и ИППП; метод твердофазного иммуноферментного анализа для определения содержания цитокинов (интерлейкина-1β – ИЛ-1β, -2, -4, -6, -8, -10, фактора некроза опухоли α – ФНО-α, интерферона γ – ИФН-γ) в сыворотке крови (использовали реагенты компании АО «Вектор-Бест», Новосибирск).
При оценке результатов учитывали первичные исходы – отсутствие клинических и бактериоскопических признаков инфекции, нормализацию иммунологических показателей (сравнительная оценка уровня цитокинов до и после лечения). Вторичные исходы – частота рецидивов заболевания в течение 12 месяцев после окончания лечения. Оценка безопасности, приверженности лечению и приемлемости выполнялась на основании анализа частоты побочных эффектов (осложнений), соблюдения схемы лечения и частоты отказов от него.
Статистический анализ полученных данных осуществляли при помощи пакета программ «Statistica for Windows 10.0» (StatSoft® Inc., США). Применяли методы описательной статистики и ряд непараметрических критериев для проверки достоверности различий. Количественные показатели представляли в виде М (SD), где М – среднее значение, SD – среднее квадратичное отклонение. Закон распределения признаков оценивали при помощи критерия Колмогорова–Смирнова. Для показателей, характеризующих качественные признаки, указывали абсолютное число и относительную величину в процентах
(В.М. Боровиков, 2001). Анализ различий в независимых выборках проводили с помощью U-критерия Манна–Уитни. Различия качественных признаков анализировали при помощи χ2-критерия. Анализ полученных данных проводился сотрудниками, не связанными с ведением больных, участвовавших в исследовании, для создания условий независимой оценки результатов.
Результаты исследования
Общая клиническая характеристика пациенток, принявших участие в исследовании, представлена в табл. 1.
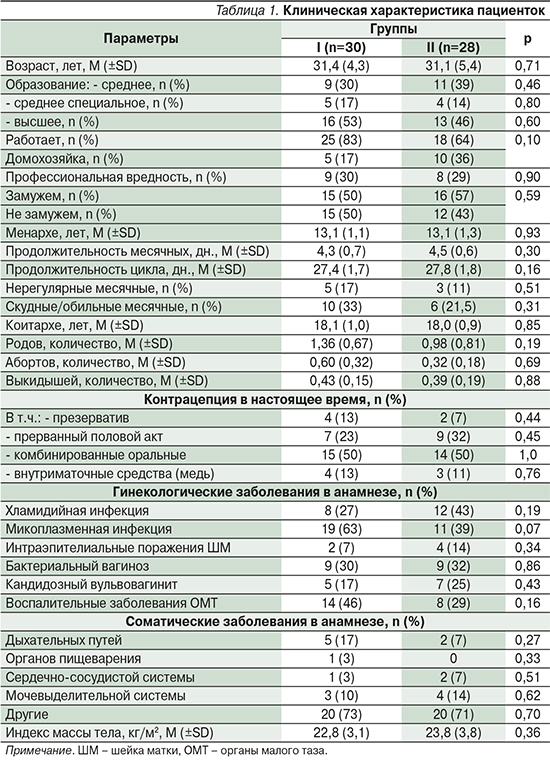
Анализ данных табл. 1 показал отсутствие статистически значимых различий клинических характеристик между группами.
Результаты клинического и лабораторного исследования пациенток до и после лечения представлены в табл. 2.
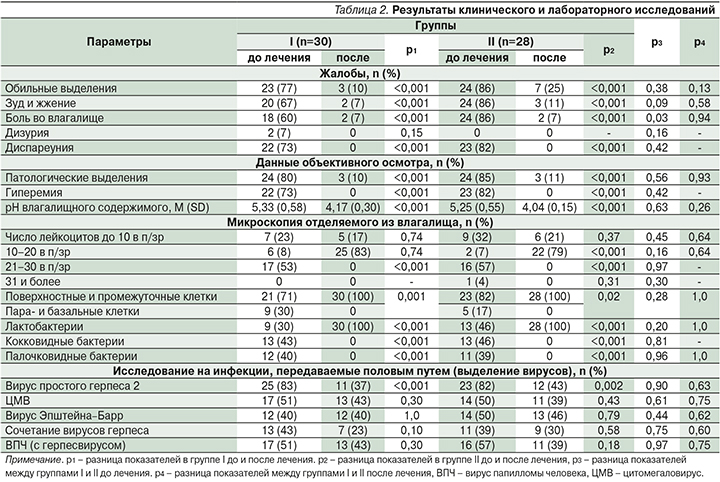
Анализ данных табл. 2 показал, что при первичном осмотре большинство пациенток предъявляли жалобы на обильные выделения, зуд и жжение, боль во влагалище и диспареунию в обеих группах без статистически значимой разницы между ними. При объективном осмотре отмечались патологические выделения из влагалища, гиперемия слизистой оболочки влагалища, рН влагалищного содержимого имело значения 5,33 (±0,58) и 5,25 (±0,55) соответственно (р=0,84).
У всех пациенток обеих групп обнаружены вирусы, преимущественно простого герпеса 2-го типа (ВПГ-2) (у 83 и 82% пациенток; р=0,77), которые встречались в сочетании с другими типами вирусов группы герпеса (у 43 и 39%; р=0,75) и ВПЧ (у 51 и 57% соответственно; р=0,97).
Проведенное лечение оказало одинаковый эффект на пациенток I и II групп. Клиническое выздоровление наступило у 90% (27/30; р<0,001) и у 89% (25/28; р<0,001) пациенток соответственно между группами (р=0,93). Средний показатель рН влагалищного содержимого был ниже 4,5 в обеих группах (р=0,26). Микробиологическое выздоровление, по данным микроскопического исследования, наблюдалось у 100% пациенток обеих групп (30/30 и 28/28; р<0,001 – внутри групп до и после лечения; р=1,0 – между группами после лечения). Лактобактерии присутствовали в мазках влагалищного содержимого после лечения у 100% (30/30 и 28/28; р<0,001 и р=1,0 соответственно), условно-патогенные морфотипы бактерий не определялись.
Применение препарата Суперлимф в комплексе лечения оказало влияние на частоту вирусовыделения ВПГ-2: в I группе снижение с 83 до 37% (р<0,001), как и во II группе – с 82 до 43% соответственно (р=0,002), р=0,63 – между группами после лечения. Уменьшение выделения других типов вирусов после лечения было статистически незначимым.
Показатели цитокинов в динамике до и после лечения представлены в табл. 3.
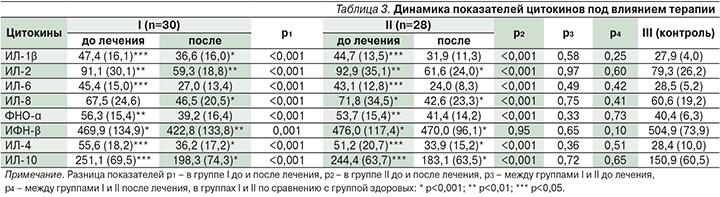
Из табл. 3 видно, что до лечения уровень всех цитокинов, кроме ИФН-γ, был выше референсных значений (р<0,001) в обеих группах. В I группе их значения снизились после лечения (р<0,001 для каждого показателя, кроме ИФН-γ) и приблизились к контрольным значениям, а уровни ИЛ-6 и ФНО-α соответствовали им (р>0,05). Статистически значимо отличались только ИЛ-2 (ниже контрольных) и ИЛ-10 (выше) (р<0,01 и <0,05 соответственно). Во II группе статистически значимые изменения уровней цитокинов по сравнению с показателями до лечения произошли аналогичным образом и статистически значимо не отличались от показателей I группы после лечения.
На протяжении 12 месяцев после лечения в I группе был выявлен рецидив дисбиоза влагалища у 2 пациенток (6,7%), во – II не наблюдалось (р=0,44 между группами).
Для дополнительной оценки риска рецидивов нами были проанализированы уровни цитокинов ИЛ-2, -6 и ФНО-α, отнесенных к предикторам рецидивирующего течения инфекционных заболеваний влагалища [5]. Число пациенток с высокими значениями указанных цитокинов (в 2 раза выше контрольных) перед проведением лечения от общего числа пациенток составило 40% (12/30) и 39,4% (11/28; р=0,83) в I и II группах соответственно. После проведенного лечения в I группе число таких пациенток было 13,3% (4/30) и у двух из них этот риск был реализован. Во II группе пациенток с двукратным повышением значений цитокинов-предикторов после лечения не было, как и не было рецидивов заболевания.
Побочных эффектов во время лечения не наблюдалось. Приверженность лечению и приемлемость составили по 100% в обеих группах.
Обсуждение
Сочетанная инфекция, характеризующаяся одновременным участием аэробов, анаэробов, грибов рода Candida со снижением доли лактобактерий, предполагает лечение с помощью комбинированных препаратов, содержащих несколько компонентов с аддитивным действием либо новейших средств широкого спектра действия на модифицированной основе однократного применения [3, 7, 8]. При этом важно, чтобы действующие антимикробные вещества оказывали влияние только на условно-патогенные микроорганизмы и не подавляли рост лактобактерий.
Доказанная высокая эффективность современных комбинированных средств (94,3%) позволяет успешно использовать их в лечении дисбиозов, вызванных сочетанными инфекциями [3, 9].
Однако присутствие вирусов и вызванные ими иммунологические сдвиги могут способствовать не только увеличению частоты дисбиозов, но и снижению эффективности лечения, сохранению высокого риска рецидивов заболевания [5]. Так, результаты систематического обзора и мета-анализа 2019 г. продемонстрировали влияние инфекции ВПГ-2 на риск развития бактериального вагиноза (БВ) с отношением шансов (ОШ), равным 1,6 (95% доверительный интервал [ДИ]: 1,32–1,94) [10]. Решающую роль в иммунном ответе хозяина на вирусную инфекцию играют цитокины ИФН-α/β, ФНО-α и ИЛ-12, стимулирующие ИФН-γ, регулируя, с одной стороны, производство оксида азота, направленного на инфицированные клетки, с другой – индуцируя противовоспалительные цитокины ИЛ-4, -10, -13, которые сдерживают этот процесс, предупреждая повреждение ДНК, белков и липидов неинфицированных клеток и тканей. Однако у пациенток с генитальным герпесом отмечается наличие иммунодефицитного состояния, сопровождающегося угнетением функциональной активности иммунокомпетентных клеток и клеток моноцитарно-макрофагального ряда [6].
Установлена положительная связь между БВ и ВПЧ-инфекцией (ОШ=1,5, 95% ДИ: 1,11–1,84), и хотя ВПЧ не является независимым фактором риска, его присутствие может потенцировать вредное воздействие других инфекций. При этом БВ служит кофактором, участвующим в приобретении или реактивации ВПЧ-инфекции, воздействуя на иммунологический баланс в ткани шейки матки в результате изменений в производстве цитокинов ИЛ-1β, -10 [11]. Имеются работы, свидетельствующие о том, что ВПЧ инициирует выработку провоспалительных цитокинов, включая интерфероны I типа (ИФН-α и -β), трансформирующий фактор роста β, ИЛ-2 и -10 [12].
Интересные результаты представлены в работе M.C. Nason et al. [13], где показано, что на фоне активации иммунитета (при проведении антиретровирусной терапии у больных ВИЧ) одновременно происходит усиление воспаления и реактивация латентных вирусных и бактериальных заболеваний. Наблюдалось увеличение числа больных с выделением ВПГ-2 и ЦМФ, и этот феномен, названный авторами воспалительным синдромом восстановления иммунитета, был связан со значительным повышением уровней ИЛ-6 (ОШ=1,4; p=0,003), ФНО-α (ОШ=1,3; p=0,01) и ИЛ-2 (ОШ=1,4; p=0,01). Роль тех же цитокинов показана в работе К.Э. Гоциридзе и соавт., продемонстрировавших повышение уровней сывороточных ИЛ-2, -6, ФНО-α и изменение иммунной толерантности матери к плоду, приводящее к повторной потере беременности, и что эти показатели могут быть использованы в качестве диагностических и прогностических критериев привычных выкидышей [14].
Исследования также свидетельствуют о роли условно-патогенных микроорганизмов в нарушении цитокинового статуса. Так, Candida albicans активно усиливают продукцию ИЛ-6 и -8 в мононуклеарных клетках человека [15]; отмечены высокие уровни ИЛ-1β, ФНО-α и ИЛ-6 у женщин с БВ [16, 17]; ИЛ-1β и -10, а также ИЛ-6 и -8 – у пациенток с аэробным вагинитом (АВ) [17, 18]; уровни ИЛ-1β значительно выше при БВ и АВ (p<0,0001) по сравнению с таковыми у женщин с нормальной флорой [19].
Результаты, полученные в настоящем исследовании, совпадают с вышеприведенными сведениями зарубежных и отечественных исследователей. Высокими значениями (в 1,5 раза выше нормы) отличались показатели всех изученных провоспалительных цитокинов – ИЛ-1β, -2, -6, -8 и ФНО-α, что свидетельствует об активации иммунитета и воспалительной реакции в ответ на инфекцию. Кроме того, нами отмечено, что уровни цитокинов ИЛ-2, -6 и ФНО-α, отнесенных к предикторам рецидивирующего течения инфекционных заболеваний влагалища [5], были в 2 раза выше по сравнению с контрольными перед проведением лечения у 40 и 39,4% (р=0,83) пациенток.
Важен тот факт, что ИЛ-1β, -6 и -8 в небольших концентрациях, обнаруженных у здоровых женщин, стимулируют рост нормальной микрофлоры (Lactobacillus spp.) и подавляют образование биопленок. Напротив, те же цитокины в высоких концентрациях, характерных для дисбиоза влагалища, подавляют нормальную микрофлору и стимулируют рост условно-патогенных микроорганизмов [20], что объясняет рецидивирующий характер течения дисбиозов, сопровождающихся выраженным увеличением продукции цитокинов.
Примечательно, что выявленные нами с помощью логит-регрессионного анализа высокие уровни цитокинов ИЛ-2, -6 и ФНО-α, связанные с риском рецидива сочетанного дисбиоза [5], оказались аналогичными в исследовании M.C. Nason et al. [13]. Таким образом, можно предположить, что указанный феномен имеет место при нарушении микробиоценоза во влагалище, вызванного условно-патогенными микроорганизмами и вирусными инфекциями, которые оказывают взаимное (возможно, синергичное) влияние на реализацию воспалительного ответа.
Суперлимф – средство, в состав которого входят природные цитокины в необходимой концентрации: ИЛ-1 и макрофагальный фактор МИФ, ИЛ-6 и ФНО-α, трансформирующий ростовой фактор и ряд минорных примесей цитокинов, хемокинов и антимикробных пептидов. Цитокины служат естественным регулятором процесса формирования иммунитета, в т.ч. противовирусного [21]. При недостаточности механизмов активации клеток, которая может быть обусловлена дисбалансом выработки цитокинов, дополнительная доза цитокинов приводит к усилению функциональной активности клеток иммунной системы и, наоборот, при гиперактивности – вызывает нормализацию их деятельности.
Правильность выбранной нами стратегии коррекции иммунного статуса пациенток, страдающих сочетанными дисбиозами бактериально-вирусной этиологии, с применением средства локальной иммуномодулирующей терапии комплексом экзогенных цитокинов подтверждается высокой эффективностью лечения. Под влиянием иммуномодулирующего препарата Суперлимф 10 ЕД после 20-дневного курса лечения и этиотропного средства произошла нормализация баланса про- и противовоспалительных цитокинов (у 100% пациенток) и элиминация инфекционных возбудителей, что привело к клиническому выздоровлению и отсутствию рецидивов заболевания у всех пациенток на протяжении периода наблюдения. Отмечено также статистически значимое снижение вирусовыделения ВПГ-2 – с 80 до 43% (р<0,001).
С другой стороны, использование препарата Суперлимф 25 ЕД после 10-дневного курса и этиотропного лечения, продемонстрировав аналогичные результаты по первичным оценкам, показало возможность возникновения рецидивов в последующем периоде наблюдения в 6,7% случаев.
Ранее нами было показано, что риск рецидива заболевания можно определить с помощью предикторов (ИЛ-2, -6 и ФНО-α в концентрациях, в 2 раза превышающих референсные значения после лечения) [5]. После проведенного лечения в I группе число таких пациенток было 13,3% и у двоих из них этот риск был реализован, во II группе у всех пациенток эти показатели были в норме. То есть при приблизительно одинаковой сумме курсовой дозы полученного препарата (250 и 200 ЕД соответственно) его экспозиция продолжительностью 20 дней (против 10 дней) оказала более выраженное действие.
Альтернативной стратегией предупреждения рецидивов может быть повторный курс терапии экзогенными цитокинами через 2–3 месяца, как указано в инструкции к препарату, однако в этом случае приверженность лечению может оказаться ниже, а стоимость лечения дороже.
Таким образом, использование препарата, модулирующего активность цитокинов, повышает резистентность организма и позволяет улучшать результаты лечения при инфекционно-воспалительных вирусно-бактериальных заболеваниях нижнего отдела полового тракта, при этом длительность курса лечения 20 дней при меньшей дозе цитокинов (10 ЕД) предпочтительна.
Заключение
Рецидивирующие сочетанные вирусно-бактериальные инфекции влагалища сопровождаются нарушением баланса про- и противовоспалительных цитокинов, что служит показанием к назначению препарата локального иммуномодулирующего средства, содержащего экзогенные цитокины (Суперлимф) одновременно с этиотропной терапией.
Лечение с использованием препарата Суперлимф в дозе 25 ЕД курсом 10 дней и 10 ЕД 20 дней в комбинации с противомикробным лекарственным препаратом широкого спектра действия обладает сопоставимой клинической (90 и 89% соответственно) и микробиологической (100%) эффективностью.
Суперлимф – эффективное средство в профилактике рецидивов сочетанных вирусно-бактериальных инфекций, при этом предпочтителен курс продолжительностью 20 дней в дозе 10 ЕД.


