Введение
Более 300 млн человек в мире страдают бронхиальной астмой (БА), при этом по крайней мере 250 тыс. человек ежегодно умирают от БА, что делает ее наиболее распространенным и социально значимым хроническим заболеванием легких [1]. Тяжелая астма составляет относительно небольшую часть (3–10%) всех случаев БА и так же, как и БА, в целом гетерогенна [2, 3].
Воспаление 2-го типа играет важную роль в патогенезе, по крайне мере половины всех случаев астмы. БА, обусловленную T2-воспалением, называют Т2-БА. Роль воспаления 2-го типа в патогенезе БА доказана и признается национальными и международными экспертами, что нашло отражение в обновленных рекомендациях Глобальной инициативы по лечению и профилактике астмы (Global Initiative for Asthma, GINA 2020) [4].
В развитии БА участвуют, с одной стороны, генетические факторы, с другой – факторы внешней среды. Взаимодействие этих факторов и приводит к формированию БА. Доминирование T2-иммунного ответа, развивающегося в нижних дыхательных путях, составляет основу иммунологических нарушений в большинстве случаев БА. Инициаторами воспалительного иммунного ответа 2-го типа (Т2-иммунного ответа) являются клетки и медиаторы воспаления, относящиеся к механизмам врожденного и адаптивного иммунитета [5]. Помимо Тh2-лимфоцитов в формировании эозинофильного воспаления при БА принимают участие недавно открытые клетки врожденного иммунитета – ILC2 (врожденные лимфоидные клетки 2-го типа), которые, как и Th2-лимфоциты, в избыточном количестве генерируют цитокины Т2-профиля: интерлейкины (ИЛ)-4, -5 и -13. Таким образом, название этого типа воспаления и эндотипа БА было изменено с Th2, что подразумевало продукцию этих цитокинов исключительно Th2-лимфоцитами, на воспаление 2-го типа (Т2-воспаление), которое, соответственно, лежит в основе Т2-БА. В основе аллергической БА, поздней эозинофильной, в т.ч. аспириновой, БА лежит преимущественно T2-эозинофильное воспаление, тогда как воспалительную основу БА, ассоциированной с ожирением, БА курильщиков и БА с очень поздним дебютом составляет не Т2-воспаление.
Как свидетельствуют исследования, большая часть больных тяжелой БА относится к T2-эндотипу БА и имеют эозинофильное воспаление в слизистой оболочке нижних дыхательных путей. Так, по данным отечественных исследователей Г.Р. Сергеевой и соавт., полученным в 2015 г., у 77% больных тяжелой БА присутствует фенотип атопической астмы, ассоциированный с эозинофильным воспалением дыхательных путей [6].
Как известно, T2-воспаление возникает в ответ на аллергены окружающей среды у лиц с атопией. CD4+-Th2-клетки характеризуются высокой экспрессией транскрипционного фактора GATA-3 и секрецией цитокинов T2-профиля (ИЛ-4, -5, -9, -13), которые активно участвуют в дифференцировке Т-лимфоцитов и переключении В-лимфоцитов на синтез аллерген-специфического IgE. Эти цитокины участвуют в запуске реакций гиперчувствительности в нижних дыхательных путях, активируя и поддерживая воспалительный процесс в слизистой оболочке и ремоделирование бронхиальной стенки. Помимо аллергенов респираторные вирусы и аэрополлютанты также вносят свой вклад в формирование и поддержание эазинофильного воспаления в слизистой оболочке нижних дыхательных путей при БА. Каскад воспалительных событий, вызванный T2-цитокинами, объясняет многое в патологии, составляющей основу ключевых клинических проявлений БА: бронхиальной гиперреактивности, обструкции бронхов и гиперсекреции слизи [7].
Т2-БА часто ассоциирована с другими заболеваниями, в основе которых также лежит Т2-воспаление. Это прежде всего аллергический ринит, атопический дерматит, хронический полипозный риносинусит. Хотя эти заболевания представляют собой группу гетерогенных иммуноопосредованных заболеваний, они объединены общими патогенетическими механизмами. Цитокинами, играющими ведущую роль в развитии данных заболеваний, являются ИЛ-4, -5 и -13 [8, 9].
Понимание патогенетических механизмов, лежащих в основе Т2-ассоциированных заболеваний, стратегически важное для принятия клинических решений при выборе дальнейшей терапии. Согласно национальным и международным клиническим рекомендациям [2, 3], в настоящее время пациентам с тяжелой БА, которые соответствуют критериям Т2-БА и не достигают контроля с помощью традиционной фармакотерапии, прежде всего высоких доз ингаляционных глюкокортикостероидов (ИГКС), длительно действующих β2-агонистов (ДДБА) и длительно действующего антихолинергического препарата, следует рассмотреть назначение биологического препарата как следующий этап лечения до назначения оральных глюкокортикостероидов (ГКС). Правильный выбор пациентов для биологической терапии основывается не только на анамнестических, клинических и функциональных критериях, но и на обязательном определении биомаркеров: эозинофилов крови, FeNO, IgE [3, 10].
Среди пяти зарегистрированных биологических препаратов лечения тяжелой БА особое место занимает препарат дупилумаб (Дупиксент®), одобренный к применению и в России, и в мире при ряде Т2-ассоциированных заболеваний, таких как БА, атопический дерматит и хронический полипозный риносинусит (ХПРС).
Препарат дупилумаб представляет собой рекомбинантное человеческое моноклональное антитело. Механизм действия дупилумаба заключается в связывании препарата с ИЛ-4Rα-субъединицей, общей для рецепторных комплексов ИЛ-4 и -13, таким образом он блокирует сигнальный путь как ИЛ-4, так и ИЛ-13, тормозя активацию JAK/STAT и тем самым приводя к уменьшению каскада воспаления, опосредованного Т2-клетками (рис. 1).
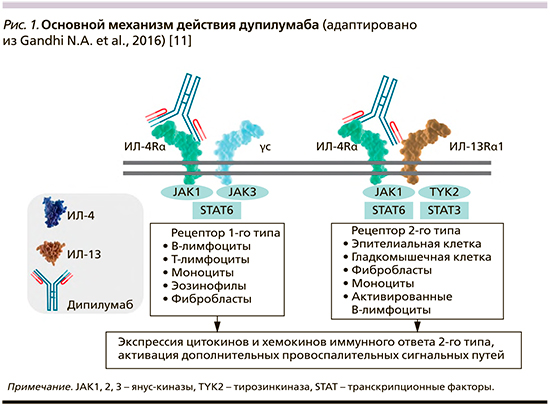
Блокирование пути передачи сигналов ИЛ-4/ИЛ-13 дупилумабом снижает у пациентов концентрацию многих медиаторов воспаления 2-го типа, включая иммуноглобулин E, периостин и множественные провоспалительные цитокины и хемокины (например, эотаксин, тимусактивирующий регуляторный хемокин), а также снижает уровень фракции оксида азота в выдыхаемом воздухе (FeNO) – маркер эозинофильного воспаления в легких.
Для оценки эффективности и безопасности дупилумаба для пациентов с БА было проведено 3 рандомизированных двойных слепых плацебо-контролируемых многоцентровых исследования в параллельных группах (DRI12544, QUEST и VENTURE) продолжительностью от 24 до 52 недель с участием 2888 пациентов (в возрасте 12 лет и старше). Во все три исследования пациенты были включены независимо от минимального исходного уровня эозинофилов или другого биомаркера Т2-воспаления (например, уровня FeNO или IgЕ).
В исследовании QUEST первичными конечными точками были годовая частота тяжелых обострений и абсолютное изменение ОФВ1 через 12 недель по сравнению с исходным значением. Вторичными конечными точками исследования были те же параметры пациентов с числом эозинофилов ≥150 и ≥300 кл/мкл. В результате терапии дупилумабом было достигнуто выраженное снижение частоты тяжелых обострений БА по сравнению с плацебо: на 48% у пациентов, получавших дозу 200 мг, и на 46% у получавших 300 мг [13]. Дупилумаб вызывал быстрое улучшение функции легких, оцениваемое по предбронходилатационному ОФВ1, различие между дупилумабом и соответствующим плацебо при первой оценке уже на 2-й неделе было статистически значимым (p<0,001) для обеих доз препарата. Улучшение функции легких было стойким, статистически значимые различия между дупилумабом и плацебо определялись при всех оценках эффективности на протяжении 52-недельного периода лечения [12]. У пациентов, получавших дупилумаб, отмечено улучшение контроля БА по ACQ-5. Дупилумаб продемонстрировал хорошую переносимость, частота нежелательных явлений была сходной в группах плацебо и дупилумаба. Реакции в месте инъекции (преимущественно гиперемия, иногда с зудом) возникали в группах дупилумаба чаще, чем в группах плацебо (15 и 5% [200 мг 1 раз в 2 недели] и 18 и 10% [300 мг 1 раз в 2 недели]), что согласовывалось с данными клинических исследований 2-й фазы дупилумаба при БА.
В исследовании 3-й фазы VENTURE, проведенном в отношении пациентов с тяжелой гормонозависимой БА, дупилумаб значимо снижал годовую частоту тяжелых обострений, улучшал функцию легких, приводил к улучшению качества жизни и контролю над астмой, выраженному снижению дозы пероральных ГКС при одновременном уменьшении частоты обострений и улучшении функции легких [13]. Во всех исследованиях показана хорошая переносимость дупилумаба подростками и взрослыми пациентами с неконтролируемой персистирующей и/или гормонозависимой БА [12, 13]. Анализ результатов клинических исследований показал, что наиболее выраженное улучшение функции легких и снижение частоты обострений в результате лечения дупилумабом наблюдается у пациентов с высоким профилем двух биомаркеров 2-го типа (исходный уровень эозинофилов в крови ≥150/мкл и исходный уровень FeNO ≥25 ppb), а при стероидозависимой БА уровень эозинофилов в крови не влиял на эффективность дупилумаба.
Есть результаты применения препарата и в условиях реальной клинической практики. Эти данные дополняют и расширяют результаты рандомизированных клинических исследований. Такое исследование с дупилумабом было проведено во Франции в рамках программы раннего доступа к препарату и разрешения на временное применение препарата (ATU), которое предоставили пациентам с тяжелой БА [14]. Результаты исследования дупилумаба в условиях реальной клинической практики подтвердили его эффективность и безопасность для пациентов с тяжелой неконтролируемой БА. Дупилумаб значимо улучшает контроль БА и функцию легких, уменьшает частоту обострений и потребность в пероральных ГКС. Эти данные полностью согласуются с результатами по эффективности и безопасности, полученными в клинических рандомизированных широкомасштабных исследованиях.
Таким образом, основываясь на результатах рандомизированных клинических исследований и реальной практики, эксперты Европейской академии аллергологии и иммунологии (EAACI) рекомендуют дупилумаб в качестве дополнительной поддерживающей терапии взрослых и детей 12–17 лет с неконтролируемой тяжелой Т2-БА, включая астму аллергического и эозинофильного фенотипов, а также сочетанную (когда присутствуют признаки того и другого фенотипа) и гормонозависимую [15].
Крайне актуальна проблема выбора пациентов с тяжелой БА, которые наиболее оптимально ответят на тот или иной биологический препарат, а также выбор биомаркеров и дополнительных критериев прогностической эффективности. Оценка эффективности терапии биологическими препаратами в отношении различных исходов БА может служить ориентиром выбора той или иной биологической молекулы. Экспертами EAACI в руководстве по биологической терапии тяжелой БА-2020 [15] предложен алгоритм выбора биологической терапии и ведения пациентов после назначения препарата. Впервые ответ на биологическую терапию оценивается через 4 месяца лечения, далее применение препарата продолжается с переоценкой каждые 3–6 месяцев. Если через 4–6 месяцев врач и пациент отмечают клинический эффект по предварительно определенным исходам (обострения, функция легких, снижение дозы оральных или ингаляционных ГКС, контроль БА и/или коморбидных заболеваний), то следует продолжить терапию и контролировать параметры безопасности [15]. Эксперты подчеркивают, что основные критерии оценки эффективности биологической терапии – это тяжелые обострения БА, контроль БА, качество жизни, безопасность (неблагоприятные события). Важные критерии для оценки эффективности биологической терапии: ОФВ1, снижение дозы оральных или ингаляционных ГКС. А FeNO, уровень эозинофилов в мокроте и крови были оценены как критерии, имеющие низкое значение [15].
Наибольшие сложности в отношении выбора биологического препарата отмечаются у пациентов с тяжелой БА с сочетанным фенотипом (аллергический и эозинофильный). Для этих пациентов препаратом выбора среди всех биологических молекул может быть дупилумаб. К этой группе пациентов относится и наш пациент, которому была назначена биологическая терапия дупилумабом, которую он получал на протяжении длительного времени.
Клиническое наблюдение
Пациент К. 1954 г.р. наблюдается по поводу БА на кафедре аллергологии и иммунологии РМАНПО с 2000 г.
Из анамнеза: с 1990 г. начал отмечать появление заложенности носа, чихания при контакте с бытовыми аллергенами, обратился к оториноларингологу, был диагностирован хронический ринит. В 1991 г. впервые появились приступы затрудненного дыхания с хрипами в груди, чувство тяжести в груди, свистящее дыхание, тогда же обратился к аллергологу, диагностирована БА тяжелого течения. Проведено аллергологическое специфическое обследование (кожные скарификационные тесты), выявлена сенсибилизация к бытовым аллергенам (клещам домашней пыли), в дальнейшем сенсибилизация также подтверждена определением наличия в крови специфических IgЕ к бытовым аллергенам. Течение БА было прогрессивным с постепенным нарастанием тяжести симптомов, снижением переносимости физической нагрузки. Было назначено лечение высокими дозами беклометазона, а с 2000 г. комбинированные ИГКС с ДДБА в фиксированной комбинации. С 2015 г. использует комбинацию беклометазон/формотерол 100/6 мкг 2 раза в день ежедневно, сальбутамол ситуационно. Выбор базисного препарата обусловлен личным предпочтением пациента устройства доставки в виде дозированного аэрозоля, а также переносимостью действующего вещества беклометазона дипропионата. При попытке назначения других фиксированных комбинаций ИГКС/ДДБА были отмечены побочные эффекты в виде осиплости голоса и тремора конечностей. Несмотря на проводимую терапию, контроля БА достигнуть не удавалось и отмечалась высокая частота обострений БА (≥2 раза в год).
В период обострения БА использовал системные ГКС коротким курсом (метипред до 16–20 мг), добавлял небулайзерную терапию (будесонид 1000 мкг). Пациент неоднократно получал стационарное лечение в связи с обострениями БА (до 2 раз в год).
Сопутствовавшие заболевания: с 1987 г. миопия, коррекция очками, сопутствующей терапии не получает. В 2005 г. диагностированы мочекаменная болезнь, хронический пиелонефрит, в 2013 г. проводилась литотрипсия, в настоящий момент ремиссия заболевания, терапии не получает.
В 2010 г. проводилась правосторонняя герниопластика по поводу паховой грыжи.
Стаж курения с 1986 г. в течение 4 лет по 1 пачке в день, окончание курения в 1990 г., индекс пачка/лет – 2.
С учетом прогрессирующего течения заболевания, отсутствия контроля БА и частых обострений в 2016 г., согласно критериям включения/исключения ,пациент был приглашен для участия в клиническом исследовании по оценке эффективности и безопасности препарата дупилумаб для пациентов с тяжелой БА.
На момент включения в исследование: астенического телосложения, при осмотре грудной клетки отмечается выбухание надключичных ямок. При перкуссии звук с коробочным оттенком. При аускультации дыхание жесткое, несколько ослаблено в нижних отделах, сухие хрипы, усиливающиеся при форсированном дыхании. Сатурация кислорода по пульсоксиметру в покое – 98%. Тоны сердца приглушены, ритм правильный, ЧСС – 105 в минуту, АД – 100/70 мм рт.ст.
Уровень эозинофилов крови – 400 кл/мкл. Уровень – FeNO 46 ppb.
Показатели спирометрии: ОФВ1 – 28% от должного, ФЖЭЛ – 56% от должного. Тест с бронхиолитиком – прирост по ОФВ1 составил 12%. Низкий ОФВ1 и невыраженный ответ на бронходилататор, вероятнее всего, обусловлены процессом ремоделирования в результате длительного персистирующего эозинофильного воспаления у пациента с неконтролируемой БА. У больного в течение длительного времени персистирующая БА с частыми обострениями, имеется постоянный контакт с круглогодичными бытовыми аллергенами (пациент владеет обширной библиотекой, в квартире проживания ковровое покрытие пола, есть собака), чем, вероятно, и обусловливается отсутствие адекватного контроля заболевания. Индекс курения крайне низкий, что позволяет исключить значимое влияние табакокурения на процесс ремоделирования бронхиального дерева. Пассивному курению пациент не подвергался, профессиональных факторов риска также не было.
Диагноз: БА, аллергическая форма тяжелого течения, неконтролируемая. ДН1. Аллергический персистирующий ринит средней степени тяжести, частично контролируемый. Сенсибилизация к клещам домашней пыли.
С ноября 2016 г. в рамках проведения клинического исследования пациенту начата терапия дупилумабом в дозе 300 мг 1 раз в 2 недели (данные по группам рандомизации были разослеплены спонсором, согласно протоколу, после окончания периода наблюдения).
На фоне проводимой терапии пациент не испытывал дополнительной потребности в приеме короткодействующих β2-агонистов (КДБА), не было зафиксировано обострений заболевания, не было эпизодов приема оральных ГКС и использования небулайзерной терапии. Достигнуто увеличение массы тела на 4 кг. Со слов пациента, повысилась переносимость физических нагрузок: расширил количество лыжных прогулок до 3 раз в неделю по 5 км (ранее максимальное расстояние составляло 1,5 км), улучшился сон; стал более контактным, появился «интерес к жизни – захотелось путешествовать».
Была отмечена положительная динамика показателей функции внешнего дыхания (ФВД), удалось достичь значений ОФВ1 35% и ФЖЕЛ 64%, что для данного пациента явилось существенным ростом. Последняя инъекция препарата была проведена в апреле 2018 г., и в июле 2018 г. было зафиксировано снижение показателей ОФВ1 до 28%, ФЖЕЛ до 56%, а к октябрю 2018 г. их значения достигли исходно низких параметров: ОФВ1 – 25%, ФЖЭЛ – 56% (рис. 2).
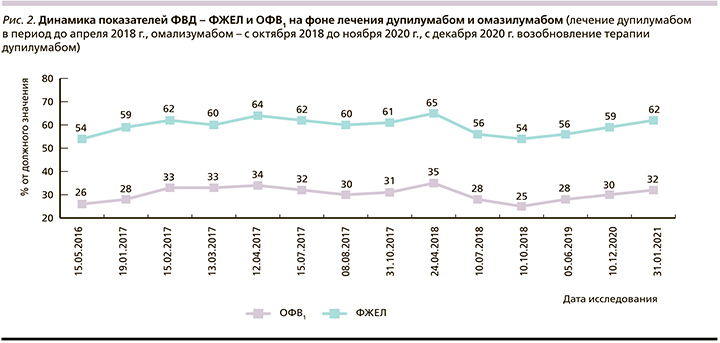
В 2018 г. пациент завершил участие в клиническом исследовании по изучению эффективности и безопасности дупилумаба, согласно протоколу. И уже через 1 месяц стал отмечать постепенное снижение переносимости физической нагрузки, усиление одышки. Первое клинически значимое обострение БА зафиксировано через 4 месяца после последнего введения дупилумаба. Данное обострение потребовало применения небулайзерной терапии (будесонид в суточной дозе 1000 мг/сут. в течение 7 дней и сальбутамол 2 мг/сут. 10 дней).
С октября 2018 г. пациенту начато лечение омализумабом по 450 мг 1 раз в 4 недели, на фоне которого не было отмечено значительного улучшения. Однако по показателям ФВД отмечена тенденция к росту показателей ОФВ1 до 29%, ФЖЕЛ до 60% (рис. 2).
Терапия омализумабом продолжалась в течение года, за тот период отмечено одно обострение БА с использованием небулайзерной терапии (будесонид 1000 мкг и сальбутамол 2 мг 2 раза в сутки, 5 дней). Со слов пациента, за указанный период он не наблюдал положительных сдвигов в течении БА.
В декабре 2020 г. пациенту возобновлено лечение дупилумабом в дозе 200 мг 1 раз в 2 недели. После этого он постепенно начал расширять физическую активность, возобновил умеренные занятия спортом и прогулки. С декабря 2020 г. по настоящий момент не было необходимости использования системных ГКС или небулайзерной терапии, не было дополнительной потребности в КДБА.
Зафиксирован рост показателей спирометрии. На рис. 2 представлен график изменения показателей ОФВ1 и ФЖЕЛ на фоне лечения дупилумабом и омализумабом.
Как следует из рис. 2, прирост показателей ОФВ1 И ФЖЭЛ отмечен при использовании таргетной терапии обоими препаратами, однако на фоне применения дупилумаба удалось достичь более высоких показателей, что с учетом исходно низких показателей ФВД критически важно для нашего пациента.
Особенностью ведения данного пациента стало изменение уровня эозинофилов крови за весь период наблюдения. На фоне начатой терапии дупилумабом (с ноября 2016 г.) у него на 8-й неделе приема препарата зафиксирован повышенный уровень эозинофилии с максимальным значением 1310 кл/мкл (январь 2017 г.), а затем с постепенным последующим снижением до 250 кл/мкл в июле 2017 г.
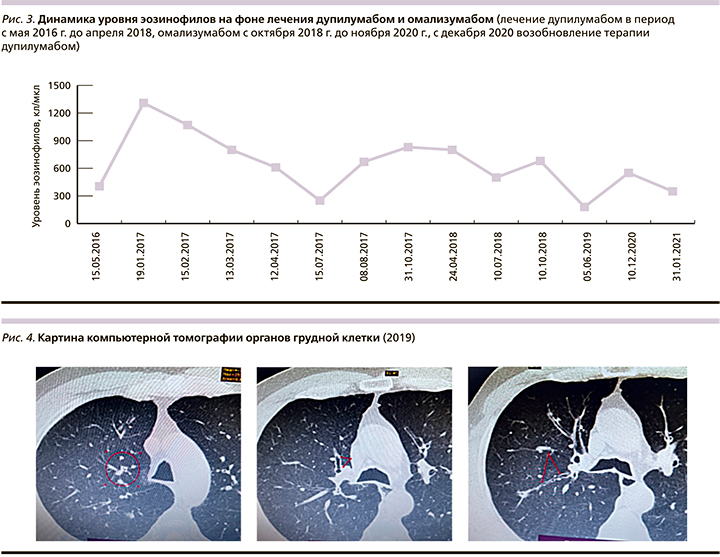
К концу периода участия в клиническом исследовании (апрель 2018 г.) уровень эозинофилов крови составлял 610 кл/мкл, после окончания лечения (через 4 недели) достиг уровня 250 кл/мкл (рис. 3). Следует отметить, что повторное назначение дупилумаба уже не давало значимого роста уровня эозинофилов, который наблюдался при первичном назначении этого препарата.
В 2019 г. пациенту проведена компьютерная томография органов грудной клетки. На рис. 4 представлено уплотнение стенок бронхов, деформация сегментарных и субсегментарных бронхов (3 и 4 порядка) по типу варикозно расширенных, сужение мелких бронхов 5–6-го порядков. Данная картина характерна для ремоделирования бронхов у пациента с длительно текущей тяжелой неконтролируемой БА. Не зафиксировано бронхоэктатических изменений.
Пациент в течение всего периода наблюдения ведет дневник пикфлуометрии. На рис. 5 представлены графики показателей пикфлоуметрии на фоне лечения омализумабом на протяжении 30 дней и дупилумабом также на протяжении 30 дней.
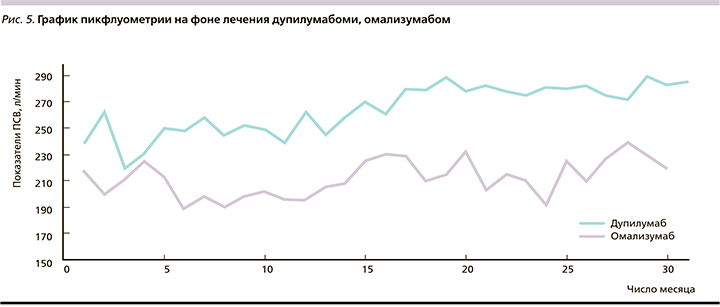
Как видно из риc. 5, на фоне лечения дупилумабом отмечается значительное улучшение показателей при домашнем измерении пиковой скорости выдоха.
Пациент продолжает базисную терапию (беклометазон/формотерол 100/6 мкг 2 раза в день ежедневно, сальбутамол ситуационно) до настоящего момента.
Обсуждение
Применение биологического препарата дупилумаб нашему пациенту позволило достичь контроля тяжелой Т2-БА. Надо отметить, что у пациента, вероятнее всего, сочетанный фенотип (аллергический и эозинофильный) Т2-БА, в пользу чего свидетельствовал исходный уровень биомаркеров эозинофильного воспаления (уровень эозинофилов крови – 400 кл/мкл и уровень FeNO – 46 ppb) и незначительный положительный эффект омализумаба в последующем. Выбор биологического препарата, влияющего на ключевые цитокины Т2-воспаления ИЛ-4 и -13 при тяжелой БА с превалирующим эозинофильным воспалением позволил снизить стероидную нагрузку. За представленный период наблюдения за пациентом у него не было потребности в использовании системных ГКС и отмечено повышение толерантности к физической нагрузке, что привело к улучшению общего состояния и возвращению к социальной активности. На фоне лечения дупилумабом удалось добиться и некоторого улучшения функции дыхания (прирост ОФВ1 до 36%), несмотря на явные проявления ремоделирования бронхов по данным компьютерной томографии органов грудной клетки (прослеживается выраженная деформация стенок бронхов). Наши данные сопряжены с данными рандомизированного клинического исследования QUEST, в котором наиболее выраженное повышение ОФВ1 наблюдалось в подгруппе пациентов с исходным числом эозинофилов ≥300 кл/мкл. Также анализ результатов клинических исследований показал, что наиболее выраженное улучшение функции легких и снижение частоты обострений в результате лечения дупилумабом наблюдается у пациентов с высоким профилем двух биомаркеров (исходный уровень эозинофилов в крови ≥150/мкл и исходный уровень FeNO ≥25 ppb), что отмечалось и у нашего пациента [12].
Зафиксированное нами увеличение числа эозинофилов крови после начала терапии встречается у пациентов, получающих лечение дупилумабом, и носит транзиторный характер, не оказывая влияния на эффективность препарата. Так, например, в исследовании VENTURE эозинофилия была зарегистрирована у каждого 7-го пациента, но носила транзиторный характер и не являлась клинически значимой [13]. Считается, что временное повышение уровня циркулирующих эозинофилов связано с тем, что дупилумаб ингибирует ИЛ-4/13-индуцированную миграцию эозинофилов из кровотока в ткани [11, 16]. Кроме того, дупилумаб не оказывает влияния на образование эозинофилов в костном мозге, что в целом может приводить к временному повышению их числа в периферической крови. Транзиторная эозинофилия крови была зарегистрирована у пациентов не только с БА, но и с атопическом дерматитом [17]. Следует подчеркнуть, что повышение числа эозинофилов в крови не влияет на эффективность дупилумаба, что было отмечено и у нашего пациента. При возобновлении терапии дупилумабом данный феномен зарегистрирован у него не был.
В доступной литературе мы не встретили описания изменения гемограммы у пациентов с повторным назначением дупилумаба.
В случае нашего пациента дупилумаб значимо улучшил контроль тяжелой БА, не было зафиксировано обострений и эпизодов приема системных ГКС. Самым значимым эффектом для пациента стало повышение псиохо-эмоционального фона, расширение физической и социальной активности и как следствиене – улучшение качества жизни.
Заключение
Появление биологических препаратов, направленных на основные цитокины или IgE, участвующие в формировании Т2-воспаления при БА, открыло новые возможности достижения контроля у пациентов с тяжелой эозинофильной БА. Дупилумаб снижает частоту тяжелых обострений БА, улучшает функцию легких, приводит к улучшению контроля астмы, выраженному снижению дозы или отмене пероральных ГКС и к повышению качества жизни пациентов. При этом дупилумаб хорошо переносится пациентами с неконтролируемой тяжелой Т2-БА.


