Актуальность
В настоящее время амиодарон рассматривается как один из наиболее эффективных и безопасных препаратов, применяемых в лечении больных различными сердечно-сосудистыми заболеваниями. Он известен и широко применяется как активный кардиотропный препарат уже около 20 лет [1–3]. Амиодарон обладает антиаритмическим и антиангинальным действиями, оказывает антиадренергический эффект, но без проаритмогенного действия [4, 5]. Препарат эффективен как в профилактике, так и в купировании различных нарушений сердечного ритма, уменьшая общую смертность на 13%, смертность вследствие аритмии – на 29% [6–8].
В то же время прием амиодарона даже в низких дозах вызывает значимые побочные эффекты, а риск их развития возрастает по мере увеличения срока приема препарата. Побочные эффекты развиваются примерно у 15% пациентов в течение первого года лечения, при постоянном приеме – более чем у 50% больных. Необходимость в отмене амиодарона возникает у 5–25% больных [9–11]. К основным побочным эффектам амиодарона относятся фотосенсибилизация, поражение щитовидной железы (с развитием как гипо-, так и гипертиреоза), повышение активности аминотрансфераз, периферические невропатии, мышечная слабость и тремор, атаксия, расстройства зрения [12, 13]. Наиболее грозным осложнением, возникающим на фоне терапии амиодароном, считается амиодарон-ассоциированный тиреотоксикоз (ААТ). Выделяют ААТ 1-го и 2-го типов, которые разнятся механизмами патологического воздействия амиодарона на щитовидную железу [14]. Частота ААТ составляет около 3–10% среди всех пациентов, получающих терапию амиодароном. Тиреотоксикоз может развиваться в любые сроки после начала лечения, а также после прекращения антиаритмической терапии [15–17]. ААТ – это опасное состояние, потенциально связанное с повышенной смертностью, особенно для больных пожилого возраста, страдающих ишемической болезнью сердца (ИБС) [18, 19]. Развивающийся у таких больных гипертиреоз негативно влияет на измененную сердечно-сосудистую систему (ССС), что значительно ухудшает прогноз заболевания [20, 21].
Цель исследования: оценить состояние внутрисердечной гемодинамики у больных ИБС и развившимся ААТ.
Методы
Проведено исследование состояния внутрисердечной гемодинамики у 48 больных ИБС в период развития ААТ, достижения эутиреоидного состояния и завершения лечения.
Первую группу составили 26 больных ИБС, заболевание у которых протекало в виде ПИКС. Во вторую группу (сравнения; 22 больных) были включены пациенты без перенесенного инфаркта миокарда.
Группы обследованных пациентов были сопоставимыми по полу, возрасту, длительности течения ИБС и периода приема амиодарона (табл. 1).
В первой группе 20 (76,9%) больных принимали амиодарон по поводу мерцательной аритмии (МА), 6 (23,1%) – по поводу других нарушений сердечного ритма. Во второй группе число больных, принимавших амиодарон по поводу МА, было несколько меньше – 15 (68,2%). Длительность приема амиодарона в каждой группе составила в среднем 6–8 месяцев.
Диагноз ИБС и ААТ устанавливали на основании жалоб, анамнеза заболевания, характерной клинической картины, лабораторных и инструментальных методов обследования. Для оценки состояния ССС оценивали жалобы больных, данные объективного осмотра, выполняли электро- (ЭКГ) и эхокардиографию (Эхо-КГ) с определением конечного диастолического размера левого желудочка (КДР ЛЖ), конечного систолического размера левого желудочка (КСР ЛЖ), конечного диастолического объема левого желудочка (КДО ЛЖ), конечного систолического объема левого желудочка (КСО ЛЖ), ударного объема (УО), минутного объема кровообращения (МОК), фракции выброса (ФВ), массы миокарда левого желудочка (ММЛЖ), размера правого желудочка (ПЖ) и левого предсердия (ЛП), а также диастолической толщины межжелудочковой перегородки (ДТ МЖП) и задней стенки левого желудочка (ДТЗС ЛЖ).
Результаты
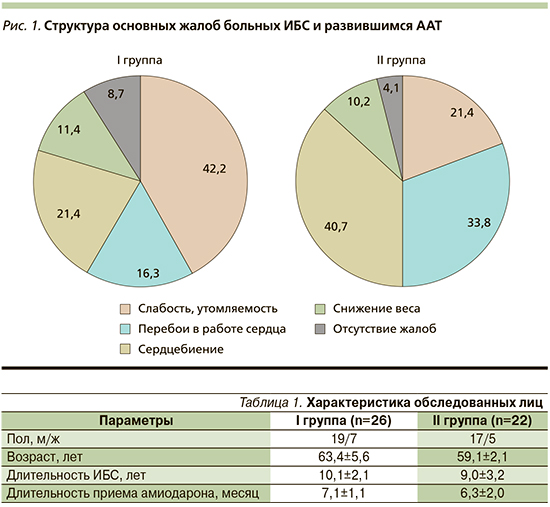
Основные жалобами больных ИБС с развившимся ААТ – это перебои в работе сердца и учащенное сердцебиение. У обследованных пациентов II группы они отмечались несколько чаще, чем у больных ПИКС. В то же время для лиц I группы наиболее характерным было появление выраженной слабости и утомляемости (рис. 1).
Небольшое число обследованных пациентов I и II групп (11,4 и 10,2% соответственно) отмечали снижение массы тела при развитии ААТ. Необходимо отметить, что ряд обследованных не высказывали каких-либо жалоб, а диагноз ААТ у них устанавливали на основании лабораторных и инструментальных исследований. Наибольшее число таких больных (8,7%) отмечено в I группе.
Результаты исследования состояния центральной гемодинамики выявили существенные различия в показателях больных ААТ с различными формами ИБС (табл. 2).
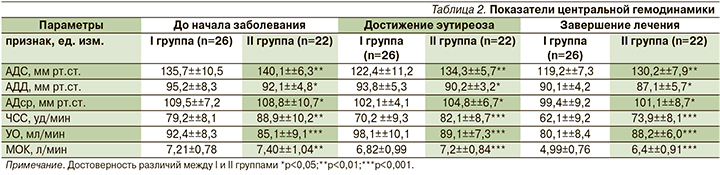
Согласно проведенному исследованию состояния, выявлено, что в большинстве случаев у больных ПИКС в дебюте развития ААТ отмечены гипо- и эукинетический типы кровообращения. Лишь у небольшого числа обследованных пациентов этой группы (11,5%) было повышение значений УО и МОК. Дальнейшее течение ААТ у больных данной категории способствовало формированию у них гипокинетического типа кровообращения, который к окончанию лечения отмечен у подавляющего большинства обследованных (89,1%) (рис. 2).
В то же время показатели центральной гемодинамики обследованных пациентов II группы существенно отличались от таковых по сравнению с больными ПИКС и ААТ. На момент появления гипертиреоза у большинства (72,3%) из них диагностировали гиперкинетический тип кровообращения. При этом число пациентов с эу- и гипокинетическим типами гемодинамики было практически одинаковым и составляло 14,6 и 13,1% соответственно. При дальнейшем течении ААТ среди обследованных пациентов II группы существенно снижалось число больных гиперкинетическим типом кровообращения, и при достижении эутиреоза их доля составила чуть более половины всех случаев (54,5%) (рис. 3).
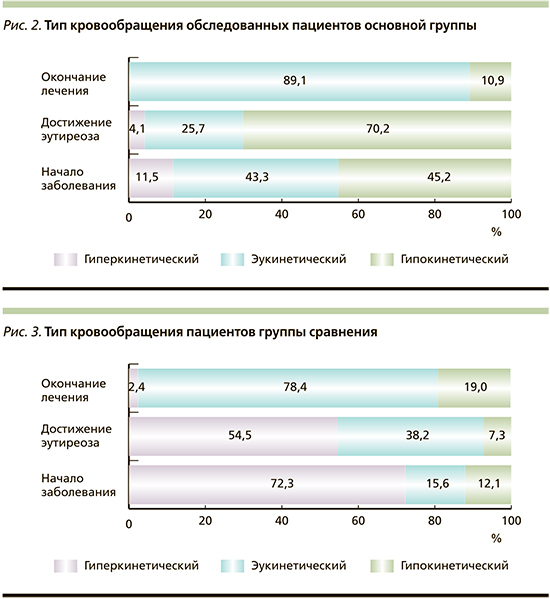
К окончанию периода лечения на большинство больных этой группы распространился эукинетический тип кровообращения, выявлен у 78,4% обследованных. В то же время увеличилось и число пациентов с гипокинетическим типом гемодинамики до 19,0%.
Изучение показателей внутрисердечной гемодинамики выявило существенные структурно-морфологические изменения миокарда у больных ИБС и ААТ (табл. 3).
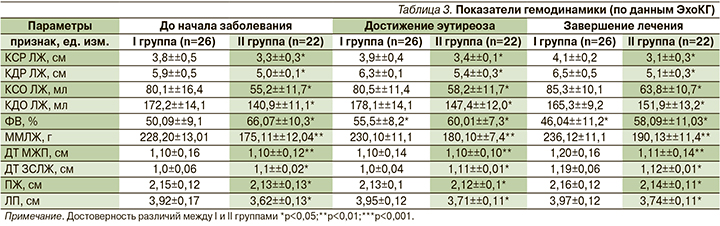
Так, при развитии ААТ у больных ПИКС достоверно увеличились показатели КСО ЛЖ и КДО ЛЖ по сравнению с больными II группы – в среднем на 28,1 (p<0,05) и 14,4% (p<0,05) соответственно. Наиболее значимыми эти изменения были в начале заболевания. Схожая динамика заметна и в показателях КСР ЛЖ и КДР ЛЖ обследованных. В то же время ФВ больных I группы на протяжении всего периода наблюдения была значительно ниже, чем у лиц группы сравнения. В период завершения лечения ее значения были на 20,6 % (p<0,05) меньше, чем у лиц II группы. Необходимо также отметить, что у больных ПИКС в сочетании с ААТ значение ММЛЖ было в среднем на 21,4 % (p<0,05) больше, чем у пациентов группы сравнения.
Нами также проведена оценка показателей внутрисердечной гемодинамики больных ИБС и ААТ за весь период наблюдения. Полученные результаты свидетельствуют о разнонаправленной динамике изменений в каждой из групп обследованных. Так, у лиц I группы к периоду достижения эутиреоза увеличение произошло на 3,3% (p<0,05) значений КДО ЛЖ, а к окончанию периода наблюдения – снижение на 4,1% (p<0,05) от исходных данных. При этом показатель КСО ЛЖ прогрессивно увеличился на 6,1% (p<0,05). Значения ФВ в этой группе обследованных также при достижении нормальных значений основного обмена увеличилось на 10,1% (p<0,05). В дальнейшем отмечалось существенное снижение насосной функции сердца – на 14,2% (p<0,05) от первоначальных значений (рис. 4).
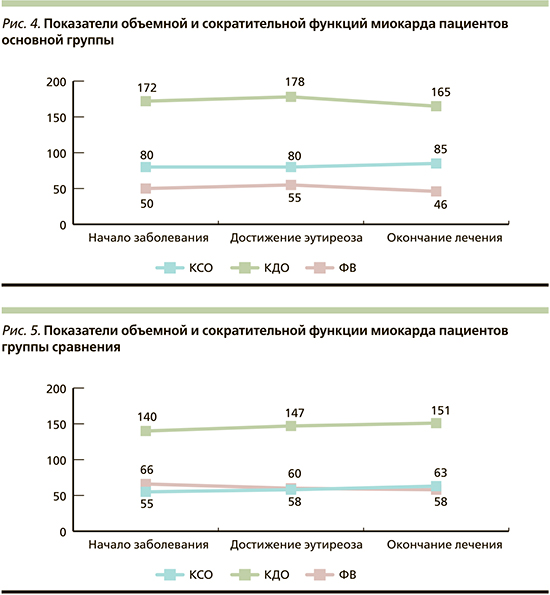
Напротив, в группе сравнения отмечено постепенное увеличение значений КДО ЛЖ и КСО ЛЖ. Максимальное повышение на 7,3 (p<0,05) и 12,7% (p<0,05) соответственно отмечено к окончанию лечения. Схожая динамика отмечена и с показателями ФВ больных II группы. К периоду эутиреоза ее значения снизились на 10% (p<0,05), к окончанию наблюдения – на 12,6% (p<0,05) (рис. 5).
Структурно-морфологические изменения миокарда за весь период наблюдения были схожими в каждой из групп и характеризовались постепенным увеличением значений ММЛЖ, ДТ ЗСЛЖ, ДТ МЖП.
Обсуждение
Для больных ПИКС уже на ранней стадии развития ААТ характерны жалобы, свидетельствующие о значимом поражении ССС. У пациентов этой категории, несмотря на достижение эутиреоидного состояния, отмечается быстрое развитие гипокинетического типа кровообращения, значительное снижение ФВ и увеличение объемных показателей миокарда. Динамика изменений центральной гемодинамики сохраняется в течение всего периода лечения ААТ.
В то же время у больных ИБС без перенесенного инфаркта миокарда при развитии ААТ клиническая картина была менее выраженной. Основные жалобы пациентов и данные объективного осмотра свидетельствовали о гиперкинетическом типе кровообращения. Дальнейшее течение заболевания характеризовалось постепенным снижением УО и МОК. К периоду достижения эутиреоидного состояния и завершения лечения у больных этой группы заметно менее значимое, чем у больных ПИКС, снижение насосной функции миокарда и увеличение размеров ЛЖ.
Заключение
Таким образом, развитие ААТ у больных ПИКС способствует раннему развитию гипокинетического типа кровообращения и выраженным структурно-функциональным изменениям миокарда даже при достижении медикаментозного эутиреоидного состояния. Изменения внутрисердечной гемодинамики больных ИБС без перенесенного инфаркта миокарда при развитии ААТ характеризовались постепенным увеличением объемных показателей ЛЖ со снижением его насосной функции.


