Актуальность
Сахарный диабет (СД) в настоящее время является настолько распространенным заболеванием, что вряд ли в мире найдется взрослый человек, который не слышал бы о нем. Всемирная организация здравоохранения (ВОЗ) называет его чумой XXI в. Врачи-эндокринологи отмечают увеличение заболеваемости СД, а темпы прироста пациентов с диабетом вызывают серьезные опасения [1, 2]. По последним данным, численность больных СД в мире за последние 10 лет увеличилась более чем в 2 раза и к концу 2019 г. превысила 463 млн человек. Согласно прогнозам Международной диабетической федерации, к 2030 г. СД будет страдать 578 млн человек, к 2045 г. – 700 млн. В Российской Федерации, как и во всех странах мира, отмечается значимый рост распространенности СД. По данным Федерального регистра СД, в РФ на окончание 2018 г. на диспансерном учете состояли 4 584 575 (3,1% населения) человек, из них 92% (4 238 503) – с СД 2 типа (СД2), 6% (256 202) – с СД 1 типа (СД1) и 2% (89 870) – с другими типами СД, в т.ч. 8006 женщин с гестационным СД. Однако эти данные недооценивают реальное число пациентов, поскольку учитывают только выявленные и зарегистрированные случаи заболевания. Так, результаты масштабного российского эпидемиологического исследования (NATION) подтверждают, что диагностируется лишь 54% случаев СД2. Таким образом, реальная численность пациентов с СД в РФ не менее 9 млн (около 6% населения), что представляет чрезвычайную угрозу в долгосрочной перспективе, поскольку значительная часть пациентов остаются недиагностированными, а следовательно, не получают лечения и имеют высокий риск развития сосудистых осложнений [3]. Не стоит забывать, что постановка диагноза СД порой откладывается во времени в связи с несвоевременным обращением пациента в медицинское учреждение. В соответствии с Алгоритмами специализированной медицинской помощи больным CД такие пациенты нуждаются в инсулинотерапии как в основном методе лечения.
В арсенале врачей в настоящее время присутствует широкий выбор различных инсулинов. Все же говорить о полной компенсации СД для всех пациентов нельзя. По данным ADA и ESD, средний уровень гликированного гемоглобина у больных СД2 в мире колеблется от 7,6 до 10,6%, что говорит о недостаточном контроле заболевания [4–7]. При подборе инсулинотерапии для пациентов с СД важно выбирать препараты с наилучшими фармакокинетическими показателями, инсулины с меньшим риском гипогликемии, увеличивающие время пребывания в целевом диапазоне (TIR – time in range), имеющие меньшую вариабельность гликемии. Для меня, практикующего эндокринолога, важно отсутствие гипогликемии у пациентов.
Инсулин Деглудек полностью отвечает этому требованию, являясь препаратом выбора в моей личной практике. Стоит помнить, что гипогликемии увеличивают риски смерти от сердечно-сосудистых осложнений в 2,5 раза! [8].
Опыт применения инсулина Деглудек в условиях непрерывного мониторинга уровня глюкозы (CGMS – Constant Glucose Monitoring System) на основании собранных данных за время участия в CGMS-проекте (2018–2020)
Я ежемесячно принимаю около 300 пациентов с СД, из них более 100 находятся на инсулинотерапии. Ежедневное назначение и коррекция инсулинотерапии – рутинная практика врача. В своей работе я столкнулась с массой декомпенсированных пациентов (ночные гипогликемии, дневные гипогликемии, вариабельность гликемии, низкий TIR, высокий гликированный гемоглобин), требующих смены терапии. Участие в проекте позволило наглядно определить проблемы компенсации углеводного обмена у пациентов, несмотря на разнообразие доступных по льготе инсулинов нового поколения. Со временем накопилось достаточное количество данных о преимуществах назначения препарата Деглудек по сравнению с Гларгином-300 и другими базальными аналогами. Поэтому возникло решение поделиться своим опытом.
Всего с момента старта использования CGMS-мониторинга проанализировано более 50 декомпенсированных пациентов на Гларгин-300, в дальнейшем переведенных на инсулин Деглудек. Причины перевода на инсулин Деглудек: ночные гипогликемии, дневные гипогликемии, вариабельность гликемии, низкий TIR, высокий гликированный гемоглобин.
Клинический случай
Анамнез заболевания
Пациентка Н. 31 года страдает СД1 с 13 лет (2003), дебют заболевания с кетоацидозом и госпитализацией в отделение реанимации Детской больницы им. К.А. Раухфуса по скорой помощи. В стационаре назначена инсулинотерапия в полном объеме: инсулин Хумулин НПХ® и инсулин Хумулин Регуляр®. Поведена беседа по питанию, ведению дневника самоконтроля, режиму введения инсулина, обучена подсчету хлебных единиц.
Смена терапии через 3 года от старта заболевания (2006) во время плановой госпитализации в эндокринологическое отделение Детской больницы им. К.А. Раухфуса в связи с декомпенсацией диабета. Во время госпитализации выявлены осложнения СД1: липодистрофии живота, бедер в месте постоянных инъекций, диабетическая полинейропатия нижних конечностей. Переведена на инсулины Лантус® и Хумалог®, на которых находилась вплоть до 2014 г.
С 2007 по 2013 г. ежегодно госпитализировалась в плановом порядке в эндокринологические отделения больниц Санкт-Петербурга для коррекции терапии и обследования по осложнениям СД1.
В 2014 г. в связи с беременностью наблюдалась в НИИ акушерства и гинекологии им. Отта. Переведена на помповую терапию инсулином НовоРапид®. Роды в 2014 г. в условиях того же стационара.
После родов терапия инсулинами Лантус® и Хумалог® с 2014 по 2016 г.
Категорический отказ от помповой инсулинотерапии. Госпитализаций за данный период не было. У врача-эндокринолога наблюдалась нерегулярно.
В 2017 г. экстренная госпитализация в отделение реанимации ГБ № 3 по скорой помощи с декомпенсацией углеводного обмена на фоне ОРЗ и повышения температуры тела. Сахар крови при поступлении – 68,0 ммоль/л, кетоны +++ в моче. Сознание спутанное. Длительность госпитализации – 1 неделя. Переведена в отделение эндокринологии в среднетяжелом состоянии для лечения и обследования. Лабораторные данные при выписке представлены в табл. 1.
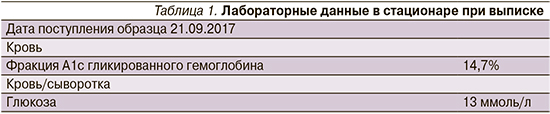
Выявлены осложнения СД1: диабетическая полинейропатия нижних конечностей, сенсомоторная форма, диабетическая непролиферативная ретинопатия, диабетическая нефропатия, ХБП С2А1. Рекомендована терапия инсулинами Туджео® и НовоРапид®.
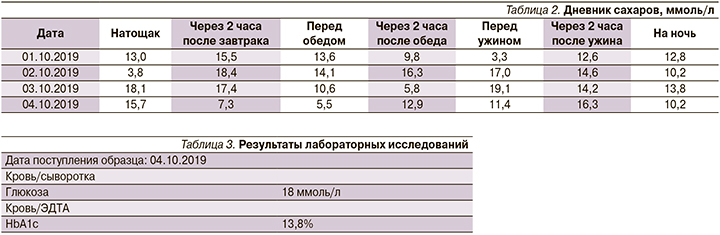
Через 2 года от последней госпитализации (в октябре 2019 г.) пациентка обратилась к лечащему врачу с жалобами на частые гипогликемии в ночное время, боли в ногах, сильную слабость, сухость во рту, повышенную утомляемость, снижение и затуманенность зрения. Ухудшение состояния отмечает последние 4 месяца. Регулировала дозы инсулинотерапии самостоятельно. Дневник уровня глюкозы и результаты лабораторных исследований представлены в табл. 2, 3.
Результаты физикального осмотра
Рост – 167 см. Вес – 54 кг. Индекс массы тела – 19,36 кг/м2. Состояние удовлетворительное. Кожные покровы сухие, бледные. В легких дыхание везикулярное, хрипов нет. Тоны сердца ясные, ритм правильный. Артериальное давление – 124/72 мм рт.ст., частота сердечных сокращений – 74 в минуту. Живот при пальпации мягкий, безболезненный. Печень у края реберной дуги. Щитовидная железа не увеличена, при пальпации безболезненна. Острой неврологической симптоматики нет.
Пациентке Н. предложена установка системы непрерывного мониторинга CGMS на текущей терапии с целью инструментальной оценки уровней гликемии в течение 7 дней и дальнейшей коррекции терапии (рис. 1–3).
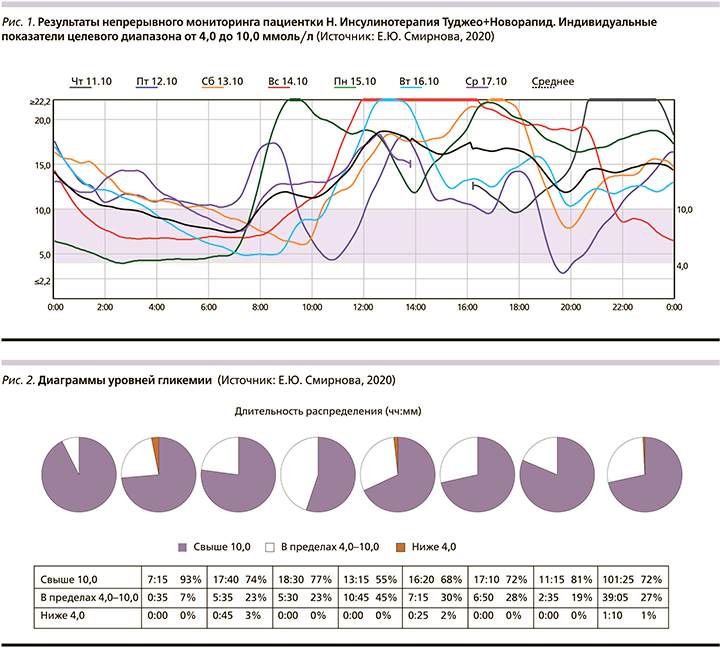
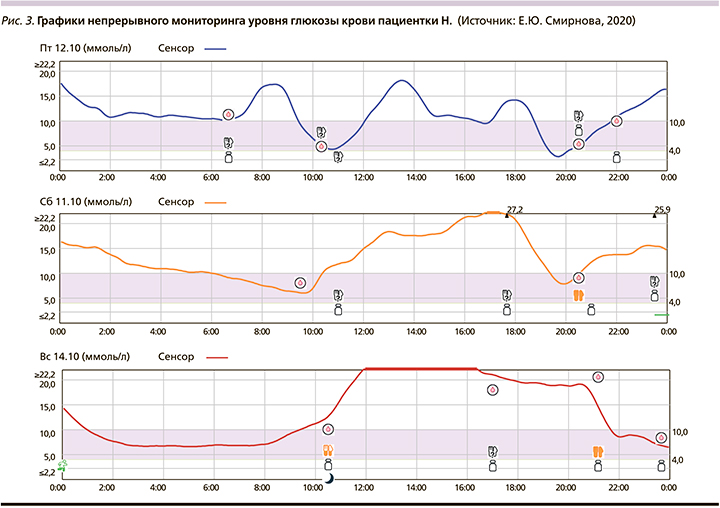
Время нахождения в целевом диапазоне (TIR) составляет всего 27% (при рекомендованном 70%), ниже отметки 4,0 ммоль/л 1% (гипогликемии), выше отметки 10,0 ммоль/л 72% времени. На представленных графиках отмечается высокая вариабельность гликемии, постпрандиальной гипергликемии, связанная с некорректным подсчетом хлебных единиц и дозирования прандиального инсулина.
ЭНМГ: признаки смешанных изменений сенсорных волокон nn. suralis. Признаки аксональных невральных изменений моторных волокон левого большеберцового, обоих малоберцовых нервов по нейропроксическому типу.
Консультация невролога: диабетическая полинейропатия нижних конечностей, сенсомоторная форма.
Консультация офтальмолога: диабетическая препролиферативная ретинопатия. Ангиопатия сетчатки. Миопия слабой степени.
После получения результатов исследования принято решение о смене терапии и переводе пациентки Н. на инсулин Тресиба®.
Пациентка Н. посетила занятия в школе «Диабет», где обновила знания о своем заболевании. Повторно обучена подсчету хлебных единиц.
Пересчитан углеводный коэффициент утром на завтрак 2,0; на обед 1,8; на ужин 2,0.
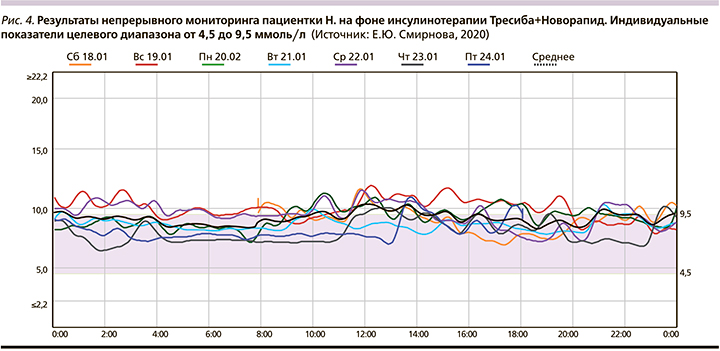
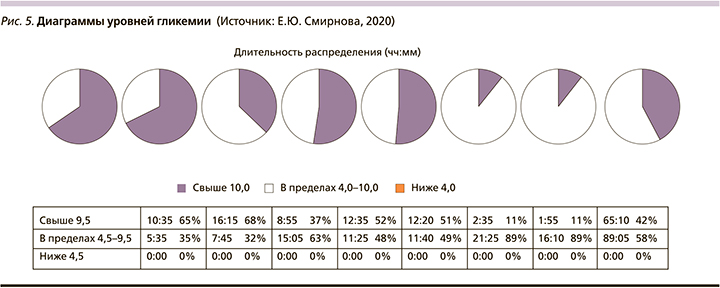
Выполнена коррекция дозы инсулина: Тресиба® 22 ЕД вечером в 21.00, инсулин НовоРапид® перед едой с учетом ХЕ и углеводного коэффициента (рис. 4–6, табл. 4).

Время нахождения в целевом диапазоне (TIR) значимо увеличилось и составляет 58%, ниже отметки 4,5 ммоль/л – 0%, выше отметки 9,5 ммоль/л – 42% времени. Отмечается уменьшение вариабельности и постпрандиальной гипергликемии.
Таким образом за 3 месяца пациентка достигла значимых результатов по улучшению контроля уровней гликемии в отсутствие эпизодов гипогликемии. Пациентка Н. отмечает улучшение самочувствия, увеличилась работоспособность, улучшилось настроение, поднялась самооценка.
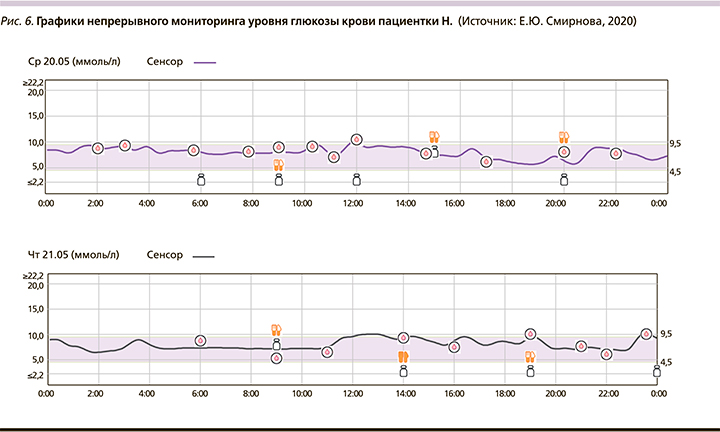
В 05.2020 при установке непрерывного мониторинга получены профили.
Заключение
От пациентки Н. получено клинически значимое улучшение компенсации СД, которое я связываю именно с переводом ее на инсулин Деглудек. Клинический эффект проявился в виде низкой частоты гипогликемий, что является одной из целей терапии, низкой вариабельности уровня глюкозы, увеличения интервала TIR, снижения времени, когда концентрация глюкозы выходила за рамки допустимых значений. При дальнейшем наблюдении за пациенткой отмечена стойкая компенсация углеводного обмена без значимого увеличения дозы инсулина.


