Введение
Болезнь Крона (БК) – хроническое рецидивирующее заболевание желудочно-кишечного тракта неясной этиологии, характеризующееся трансмуральным, сегментарным, гранулематозным воспалением с развитием местных и системных осложнений [1].
Эпидемиологические исследования свидетельствуют о значительном росте заболеваемости БК в последние десятилетия, а также о больших расходах на лечение этих больных. В странах Северной Европы, Западной Европы и США отмечаются более высокие темпы заболеваемости язвенным колитом (ЯК) и БК, чем в остальном мире. По последним данным, в США и Европе зарегистрировано более 3 млн больных воспалительными заболеваниями кишечника (ВЗК) [2—5]. Ежегодно в США регистрируется 70 тыс. новых случаев ВЗК, 50% из них приходится на ЯК, 50% — на БК.
Согласно последним данным, распространенность БК в Северной Америке составляет 201 случай на 100 тыс. населения, в Европе — 322 на 100 тыс. Заболеваемость БК в Северной Америке составляет 26 на 100 тыс., в Европе — 12,7 на 100 тыс. Заболеваемость мужчин и женщин сопоставима, причем пик заболеваемости приходится на активный возраст от 20 до 40 лет [3], что делает БК социально значимым заболеванием.
Принципы лечения БК включают назначение лекарственных препаратов, хирургическое лечение и диетотерапию [6].
Всем пациентам с БК рекомендовано определять вид консервативного или хирургического лечения на основании тяжести текущей атаки, протяженности и локализации воспаления в желудочно-кишечном тракте, наличия внекишечных проявлений и кишечных осложнений (стриктура, абсцесс, инфильтрат), длительности анамнеза, эффективности и безопасности ранее проведенной терапии, а также риска развития осложнений БК.
В настоящее время цели терапии БК соответствуют стратегии «лечения до достижения цели» («trеat to target») [7], предполагающей индукцию ремиссии и ее поддержание без глюкокортикостероидов (ГКС), профилактику осложнений и предупреждение операции. При этом актуален вопрос своевременного назначения хирургического лечения при прогрессировании процесса и развитии опасных для жизни осложнений.
Для сохранения длительной ремиссии больной БК должен оставаться на постоянной противорецидивной терапии, т.к. у 70% пациентов БК имеет прогрессирующий характер, а через 20 лет у 50% больных развиваются осложнения (стриктуры, абсцессы, фистулы, флегмоны), гормональная зависимость при этом формируется у 30% пациентов. Через 10 лет от момента постановки диагноза 55% пациентов с БК требуется хирургическое лечение, а через 5 лет от первого оперативного вмешательства у половины больных развивается рецидив заболевания [8].
Признание того, что хроническое и «нелеченое» воспаление (даже если оно протекает бессимптомно) в итоге приводит к неблагоприятным исходам заболевания, изменило подходы к терапии и мониторингу БК: в настоящее время признается, что раннее вмешательство и тщательный мониторинг могут предотвратить осложнения этого заболевания [9].
Появление генно-инженерных биологических препаратов (ГИБП) значительно влияло на длительность ремиссии, частоту рецидивов и развитие осложнений БК. Внедрение их в лечебную практику позволило эффективнее преодолевать гормонорезистентность и гормонозависимость БК, снижать риск развития рецидивов, уменьшать частоту оперативных вмешательств, а также повышать качество жизни больных [10]. Однако часть пациентов с БК не отвечают на терапию блокаторами фактора некроза опухоли α (ФНО-α), причем первичная неэффективность терапии ФНО-α достигает 10–20% [11, 12]. Кроме того, 17—22% пациентов, первоначально ответивших на терапию блокаторами ФНО-α, прекращают лечение в связи с вторичной потерей ответа на лечение или развитием нежелательных явлений [11, 12], а в 19–40% случаев больным требуется повышение дозы препарата или уменьшение интервалов между его введениями [11].
В случае неудачи терапии первым анти-ФНО-α-препаратом чаще всего осуществляется перевод пациента на другой блокатор ФНО-α. Ответ на второй блокатор ФНО-α зависит от многих факторов. Эффективность терапии вторым блокатором ФНО-α зависит от причины перевода пациента с одного лекарственного препарата этой группы на другой, включая непереносимость препарата, первичную или вторичную неэффективность ГИБП. Анализ объединенных данных свидетельствует, что в случае первичной неэффективности терапии ремиссия на втором анти-ФНО-α-препарате достигается в 30% случаев, при вторичной неэффективности терапии первым анти-ФНО-α-препаратом ремиссия на втором анти-ФНО-α-препарате достигается в 45% случаев, при развитии нежелательных явлений на приеме первого анти-ФНО-α-препарата ремиссия после перевода пациента на другой анти-ФНО-α-препарат достигается в 61% случаев [11]. Также существует проблема гормонозависимости и гормонорезистентности, которые развиваются почти у половины пациентов [13].
Таким образом, существует потребность в разработке новых видов препаратов для лечения больных БК, которые позволили бы добиваться быстрой индукции клинической ремиссии, снижать риск иммуногенности и иных побочных эффектов [14], уменьшать число побочных эффектов [15].
В 2019 г. в России для лечения больных БК, а в 2020 г. – для лечения пациентов с ЯК зарегистрирован препарат устекинумаб (УСТ). Он представляет собой полностью человеческое моноклональное антитело, обладающее высокой специфичностью к субъединице р40 интерлейкина-12 (ИЛ-12) и ИЛ-23. УСТ блокирует биологическую активность ИЛ-12 и -23, предотвращая связывание р40 с рецептором ИЛ-12R-β1, экспрессируемым на поверхности иммунных клеток.
В настоящее время опыт использования УСТ в реальной клинической практике невелик. Данная работа представляет собой опыт применения препарата в ГБУЗ «Московский клинический научно-практический центр им. А.С. Логинова» ДЗ Москвы в отношении пациентов с тяжелой и среднетяжелой БК.
Цель настоящего исследования: ретроспективная оценка эффективности и переносимости терапии УСТ пациентами с БК средней и тяжелой степеней в реальной клинической практике.
Методы
Дизайн исследования проспективный и открытый. Для оценки эффективности и безопасности УСТ мы включили в исследование пациентов с БК, получавших лечение УСТ в отделении воспалительных заболеваний кишечника (ВЗК) Московского клинического научно-практического центра им. А.С. Логинова ДЗМ в течение не менее 6 месяцев либо до момента отмены препарата. Сбор данных осуществляли с января 2020 по декабрь 2020 г. Диагноз БК устанавливали на основании клинических, эндоскопических, рентгенологических и гистологических методов исследования. У пациентов исключали активный и латентный туберкулез.
Всего наблюдали 11 пациентов с активной болезнью Крона, которые получали индукционный курс УСТ начиная с января 2020 г.
Были проанализированы следующие характеристики пациентов: пол, возраст, возраст на момент постановки диагноза, длительность заболевания, тяжесть и протяженность БК, наличие кишечных осложнений, наличие и локализация внекишечных проявлений на момент начала терапии УСТ, наличие перианальных поражений и хирургических вмешательств (табл. 1), предшествовавшее лечение: терапия препаратами 5-аминосалициловой кислоты (5-АСК), иммуносупрессорами, ГКС, ГИБП, а также их количество в анамнезе (табл. 2).
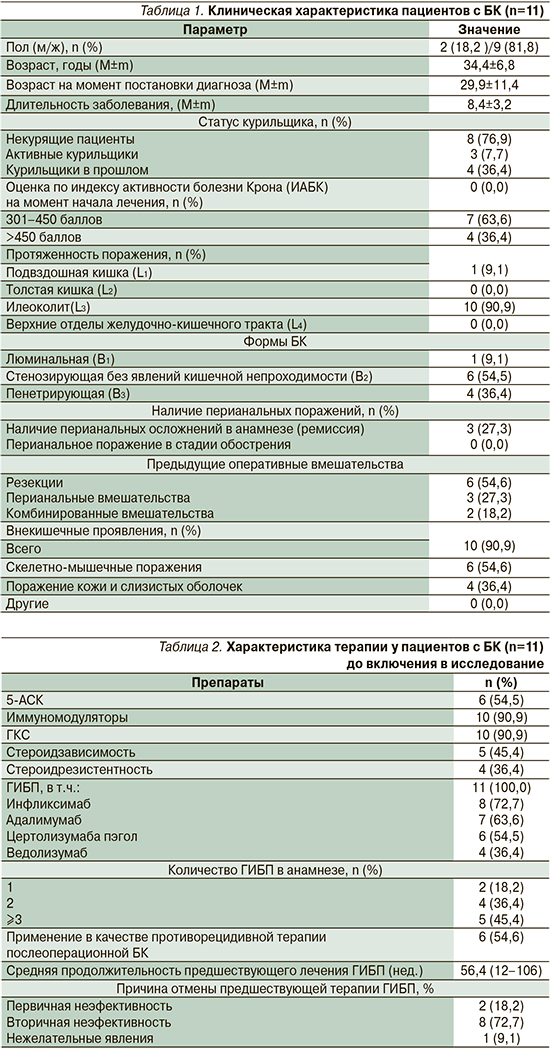
Большинство пациентов, включенных в исследование, имели длительный анамнез БК (более 6 лет), 63,6% больных имели среднетяжелое и 36,4% – тяжелое течение заболевания, у 90,9% пациентов заболевание носило форму илеоколита, у 10 (90,9%) имелись внекишечные проявления.
Показанием к назначению УСТ служила вторичная неэффективность или потеря ответа на ГИБП.
До начала исследования подавляющее большинство больных получали иммуносупрессоры (90,9%) и ГКС (90,9%), а также месалазины с высвобождением в дистальных отделах тонкой кишки с этилцеллюлозным покрытием (54,5%). В анамнезе ГИБП получали 11 (100%) пациентов. Три или более ГИБП (анти-ФНО-α, антиинтегрин) получали 5 (45,4%) пациентов, два препарата – 4 (36,4%), и только у 2 (18,2%) пациентов УСТ был препаратом 2-й линии. В качестве предшествовавшей терапии чаще назначались инфликсимаб (ИФЛ) и адалимумаб (АДА), эти препараты получали 72,7 и 63,6% пациентов. Ведолизумаб (ВДМБ) и цертолизумаба пэгол (ЦЗП) использовали 4 (36,4%) и 6 (54,5%) больных соответственно.
Эффективность оценивали по следующим параметрам: ответ на терапию к 6-й неделе, поддержание клинического ответа (6-я и 26-я недели), динамика эндоскопических показателей к 12-й и 48-й неделям терапии, длительное поддержание ремиссии, заживление свищей, ответ на лечение в зависимости от сопутствующей и предшествовавшей терапии. Полный ответ на терапию включал исчезновение клинических симптомов заболевания, снижение ИАБК до уровня менее 150 баллов и лабораторных показателей воспалительного процесса (СОЭ, СРБ). Частичный ответ характеризовался существенным уменьшением клинических симптомов и лабораторных показателей воспаления, снижением ИАБК не менее чем на 100 баллов от исходного уровня (табл. 3).
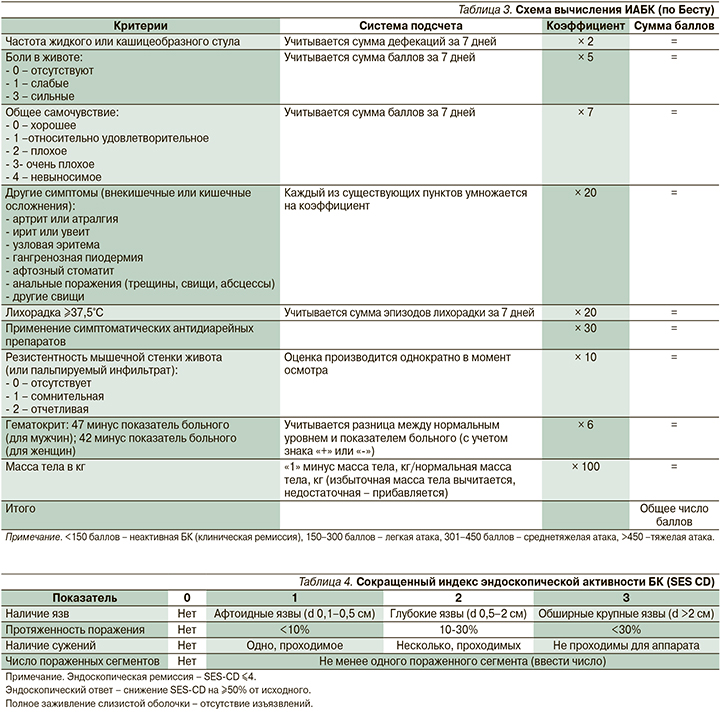
Эндоскопический ответ оценивался по простому индексу эндоскопической активности БК (ИЭАБК/SES-CD), основанному на оценке выраженности 4 эндоскопических признаков в баллах от 0 до 3 в 5 илеотолстокишечных сегментах (табл. 4) [16]. Подсчитывается сумма баллов в каждом из 5 обследованных сегментов кишечника (илеум, правая половина толстой кишки, поперечно-ободочная кишка, левые отделы и прямая кишка), и окончательный расчет производится по формуле: SES-CD=сумма всех баллов – 1,4 × (количество пораженных участков). Степень тяжести БК оценивали по критериям Российской группы по изучению ВЗК [6].
У пациентов, ранее получавших терапию ГИБП (ИФЛ, АДА, ЦЗП, ВЕДБ), прекращение терапии связывали с тремя причинами:
- первичная неэффективность – отсутствие ответа после проведения индукционного курса;
- вторичная неэффективность – потеря ответа, наступившая после первоначального положительного эффекта, несмотря на попытки оптимизации дозы путем сокращения интервала между введениями или ее увеличения в 2 раза;
- нежелательные явления: аллергическая реакция или иная непереносимость на введение ГИБП.
Пациентам с БК рекомендовано однократное инициирующее терапию внутривенное введение препарата УСТ в дозе, рассчитанной на основании массы тела (табл. 5).
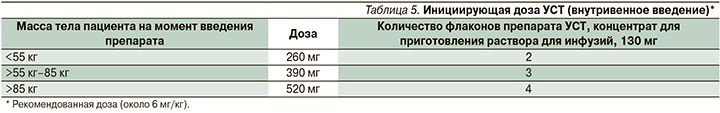
Через 8 недель после введения инициирующей дозы препарат УСТ вводился подкожно в дозе 90 мг (первое подкожное введение). Для подкожного введения используется УСТ в лекарственной форме «раствор для подкожного введения».
Согласно инструкции по медицинскому применению, пациенты, которые теряют ответ на лечение при дозировании каждые 12 недель, могут воспользоваться увеличением частоты дозирования - каждые 8 недель.
Критерии оценки лечения:
- быстрый клинический ответ (уменьшение частоты или исчезновение клинических симптомов после первой недели лечения) в течение недели;
- ранний клинический ответ (динамика клинических симптомов, эндоскопической картины и внекишечных проявлений после индукционного курса на 8 неделе лечения);
- клиническая ремиссия констатировалась при исчезновении патологических примесей в стуле и снижении частоты дефекаций до ≤3 раз в сутки;
- достижение и поддержание клинической ремиссии (стойкая ремиссия) на протяжении 12 недель после начала терапии.
Проведенное исследование было согласовано с локальным этическим комитетом МКНЦ им А.С. Логинова. Пациенты подписывали письменное информированное согласие на участие в этом исследовании.
Статистическая обработка
Статистический анализ проводили с помощью компьютерной программы IBM SPSS Statistics 24.0. Анализ качественных параметров проводился по частотам встречаемости. Для описания количественных переменных использованы методы описательной статистики: среднее (Mean), стандартное отклонения (Std. Deviation).
В качестве количественных показателей оценивали среднее и стандартное отклонения или среднее и диапазон (или интерквартильный диапазон) показателей без нормального распределения. Качественные показатели оценивались в процентах и с помощью доверительного интервала 95%. Проведены унивариантный и мультивариантный анализы предикторов ответа и при необходимости выполнялась логистическая регрессия.
Результаты и обсуждение
Всем больным был назначен УСТ в индукционной дозе 390 мг внутривенно капельно. Ранний ответ на терапию УСТ оценивался на 1-й неделе. Быстрый клинический ответ на 3-й день лечения, характеризующийся урежением частоты стула, уменьшением интенсивности абдоминального болевого синдрома и улучшением общего самочувствия, был отмечен у 10 (90,9%) из 11 пациентов, включенных исследование. Скорость достижения клинического ответа в нашем анализе коррелирует с данными, полученными при анализе опросников пациентов, включенных в исследование UNITI-1, – к концу первой недели терапии статистически значимо ниже были показатели частоты стула и улучшение общего самочувствия у пациентов, получавших УСТ, по сравнению с пациентами с БК, получавшими плацебо [17].
После индукционного введения УСТ у 10 пациентов в течение первой недели отмечено снижение ИАБК более чем на 100 баллов (улучшение общего самочувствия, уменьшение частоты стула, уменьшение интенсивности абдоминального болевого синдрома, уменьшение патологических примесей в кале), зарегистрированы нормальные или субнормальные лабораторные показатели (СОЭ, СРБ, гемоглобин, ФКП [фекальный кальпротектин]) активности воспалительного процесса. Таким образом, у 6 (54,5%) пациентов на 6-й неделе терапии была отмечена клиническая ремиссия по ИАБК, 4 (36,4%) пациента достигли показателей клинического ответа, у 1 (9,1%) – не выявлено положительной динамики.
В связи с отсутствием ответа на проводимую терапию (сохранение диареи, абдоминального болевого синдрома, анемии, лейкоцитоза, высоких уровней СРБ, СОЭ, прокальцитонина и ФКП) пациенту были назначены антибактериальная терапия и ГКС, в последующем выполнено хирургическое вмешательство.
У 2 из 6 пациентов, достигших клинической ремиссии к 15-й неделе от момента инициациия УСТ, отмечены увеличение частоты стула и консистенция стула 6-го типа по Бристольской шкале. В связи с этим было принято решение о сокращение интервалов между повторными введениями УСТ с 12-й до 8-й недели. После введения УСТ не через 12, а через 8 недель после первой подкожной инъекции в дозе 90 мг клиническая картина заболевания улучшилась: частота стула нормализовалась, консистенция стула 4–5-го типов по Бристольской шкале.
Через 12 недель клиническая ремиссия была достигнута у 8 (72,7%) больных, клинический ответ сохранялся у 2 (18,2%) пациентов с БК.
Большинство больных с клинической ремиссией на 12-й неделе также достигли заживления слизистой оболочки кишечника. На 12-й неделе эндоскопическое исследование было проведено 6 пациентам, из них у 5 (45,4%) была диагностирована эндоскопическая ремиссия – SES-CD ≤4.
Через 12 недель у всех пациентов, ответивших на терапию УСТ, ИАБК снизился в среднем с 425,0±49,3 до 128,6±110,6 балла. Динамика основных лабораторных показателей представлена в табл. 6.
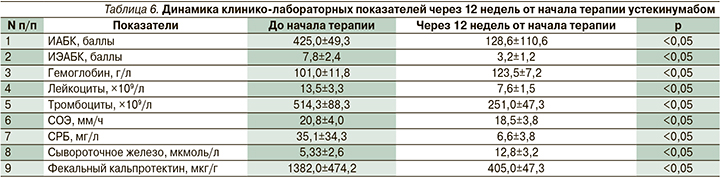
На 48-й неделе исследования было обследовано 10 пациентов, у 7 из которых зарегистрирована эндоскопическая ремиссия (SES-CD ≤4) и полное заживление слизистой оболочки кишки. У 3 пациентов, которым не удалось достичь полной клинико-эндоскопической ремиссии, большинство ранее получали более 3 ГИБП – 3 анти-ФНО-α-препарата, зарегистрированных в РФ в качестве лечения БК, и блокатор интегрина α4β7. Следует отметить, что 10 (90,9%) пациентов, достигших клинической ремиссии после индукционного курса УСТ, сохранили ее к 48-й неделе.
Полученные нами результаты в полной мере согласуются с данными, а в некоторых случаях превосходят результаты клинического исследования UNITI-1, в котором пациентов, не ответивших на предшествовавшую терапию ГИБП, переводили на лечение УСТ в дозе 390 мг с последующим переводом на поддерживающую терапию через 8 недель. Согласно исследованию UNITI-1, первичная конечная точка эффективности УСТ достоверно превосходит плацебо у пациентов с неэффективностью ингибиторов ФНО-α и стандартной терапии на 3-й, 6-й и 8-й неделях терапии [17]. Клиническая ремиссия на УСТ на 3-й, 6-й и 8-й неделях терапии достигнута 12,9, 18,5 и 20,9% пациентов с БК соответственно.
Долгосрочная эффективность клинической ремиссии терапии среди рандомизированных пациентов при двухлетнем периоде наблюдения составила около 70% [18]. Однако данный анализ нам еще только предстоит, т.к период наблюдения в настоящее время составляет не более 50 недель от проведения индукционного курса УСТ.
В клинических испытаниях UNITI для анализа эффективности применения УСТ в отношении заживления слизистой оболочки выполнялось эндоскопическое исследование (илеоколоноскопия) до рандомизации, на 8-й и 44-й неделях. Наблюдалось снижение по сравнению с исходным значением по баллам простой эндоскопической шкалы для БК (SES-CD). Эффект был значительно выше у пациентов, получавших устекинумаб, по сравнению с теми, кто получал плацебо [19]. Эти результаты были подтверждены и в некоторых нерандомизированных исследованиях: R. Battat et al. описали эндоскопический ответ 59% пациентов [20], и C. Ma et al. отметили эндоскопический ответ в половине случае [21], что также соответствует результатам нашего исследования.
Внекишечные манифестации БК до начала терапии УСТ были отмечены у 10 (90,9%) из 11 пациентов. У 6 (54,6%) больных имелись мышечно-скелетные проявления (артралгии, периферические артриты, аксиальные поражения), у 4 (36,4%) – поражения кожи и слизистых оболочек. На 6-й неделе терапии уменьшение симптомов суставных поражений было отмечено у 4 из 6 пациентов, регресс признаков поражения кожи и слизистых оболочек – у 3 из 4 больных. К 12-й неделе положительная динамика наблюдалась уже у 81,8% пациентов (9 из 11). Утяжеления симптомов внекишечных проявлений любой локализации не наблюдалось ни у одного пациента.
В целом УСТ характеризовался хорошей переносимостью. Ни в одном случае не было отмечено нежелательных явления, которые могли бы послужить причиной отмены препарата.
Данные наблюдений в условиях реальной клинической практики, опубликованные в настоящее время, не позволяют проводить полноценное сравнение с нашим анализом в связи с недостаточностью анализируемых параметров эффективности индукционного и поддерживающего курсов УСТ, малым количеством пациентов, а также отсутствием нежелательных явлений в нашем аналитическом исследовании [22].
Заключение
В лечении БК достигнут значительный прогресс, но сохраняется необходимость в новых терапевтических подходах, которые могут помочь снизить риски неблагоприятного прогноза, повысить качество жизни пациентов, понизить экономические расходы, связанные с заболеванием, и в идеальном случае изменить естественное течение болезни. УСТ, как первый зарегистрированный для терапии БК и ЯК препарат класса ингибиторов ИЛ-12 и -23, представляет собой новую перспективную альтернативу в лечении БК.
Наше клиническое наблюдение на небольшой группе больных БК, как и предшествовавшие многоцентровые исследования, проведенные в мире, продемонстрировало высокую эффективность УСТ в индукционной и поддерживающей терапии среди когорты больных тяжелыми и среднетяжелыми, резистентными к базисным препаратам и ГИБП формами БК [17–19].
В нашем исследовании была показана тенденция к необходимости уменьшения интервала введения УСТ до 8 недель для повышения эффективности проводимой терапии пациентов, получавших ранее один или несколько анти-ФНО-α-препаратов.
Согласно исследованию UNITI-2, клинический ответ, клиническая ремиссия, эндоскопическая ремиссия, эндоскопический ответ и заживление слизистой оболочки были более выражены у бионаивных пациентов по сравнению с пациентами с неэффективностью ингибиторов ФНО-α [23, 24].
В нашем исследовании бионаивных пациентов не было, поэтому необходимы дальнейшие исследования для изучения долгосрочной эффективности и безопасности УСТ в реальной клинической практике как для бионаивных пациентов, так и для пациентов с БК, получавших ранее биологическую терапию.


