Введение
Лекарственно-индуцированное (ЛИ) поражение печени с аутоиммунным механизмом развития, также называемое ЛИ аутоиммунным гепатитом (АИГ), характеризуется острым или хроническим повреждением этого органа, сопровождающимся развитием аутоантител, повышением уровня ферментов сыворотки крови и определенными нарушениями структуры гепатоцитов, сходными с идиопатическим АИГ [1]. ЛИ АИГ по своим клиническим проявлениям напоминает идиопатический АИГ, при этом симптомы ЛИ АИГ в подавляющем большинстве случаев полностью разрешаются после прекращения приема лекарственного средства (ЛС), однако выздоровление протекает медленно, требуется продолжительный курс терапии глюкокортикостероидами (ГКС).
В литературе существует множество терминов для обозначения данной патологии: лекарственное поражение печени (ЛПП) с аутоиммунными проявлениями, аутоиммунное ЛПП, аутоиммуноподобное ЛПП, иммуноопосредованный лекарственный гепатит [2–5]. По мнению А.О. Буеверова и соавт. [6], предпочтителен термин ЛИ АИГ: этот термин демонстрирует сходство ЛИ с истинным АИГ и одновременно требует проведения дифференциальной диагностики.
Распространенность
Первые описания ЛИ АИГ были сделаны еще в 1960–1970 гг.: его развитие ассоциировалось с приемом антибиотика пенициллина [6, 7] и нейролептика хлорпромазина [6, 8].
В настоящее время распространенность заболевания остается неизвестной, что во многом обусловлено индивидуальным характером реакции на то или иное ЛС. Можно предположить, что этот вариант ЛПП встречается чаще, чем диагностируется, о чем свидетельствуют работы, прицельно анализирующие подобные случаи. Так, в обзоре S.X. Zhao et al. [9] указывается, что доля ЛИ АИГ составляет до 15% от всех случаев ЛПП [6]. В другом исследовании продемонстрированы сходные цифры: из 116 пациентов с ЛПП ЛИ АИГ наблюдался у 13 (11%) [10].
В работе E. Björnsson et al. [11] среди 261 пациента с АИГ у 24 (9,2%) диагностирован ЛИ АИГ. По данным французских исследователей [12], из 65 случаев АИГ в 12% он был ассоциирован с приемом ЛС (ЛИ АИГ). Испанские авторы [13] верифицировали диагноз ЛИ АИГ у 5 из 29 (17%) наблюдаемых ими пациентов с АИГ, а А. Licata et al. [14] сообщили, что среди 10 270 госпитализированных пациентов у 136 (1,3%) диагностировано ЛПП. Среди них у 12 (8,8%) был диагностирован ЛИ АИГ (41,7% мужчин в возрасте от 17 до 73 лет); 8 (66,7%) пациентов имели желтуху при поступлении. Биопсия печени показала картину лекарственного АИГ, которая характеризовалась тяжелым портальным воспалением и лимфоплазмоцитарной инфильтрацией. В группе с лекарственным АИГ были более короткая продолжительность приема лекарств и более высокие значения трансаминаз и γ-глобулинов. Все пациенты получали иммуносупрессивную терапию с последующей клинической ремиссией, 5 из них достигли длительной ремиссии без ГКС. В работе Т.Т. Yeong et al. [15] среди 82 пациентов с АИГ 11 (13,4%) был вериафицирован ЛИ АИГ, при этом его развитие чаще всего было ассоциировано с приемом нитрофурантоина и статинов (по 4 пациента), а также диклофенака (1 пациент).
Хотя симптомы ЛИ АИГ в большинстве случаев проходят после отмены ЛС-индуктора, нередко наблюдается неблагоприятное течение заболевания. Так, в цитируемой выше работе T.T. Yeong et al. [15] у 1 (9,1%) из 11 пациентов с ЛИ АИГ имела место печеночная недостаточность с момента дебюта заболевания и еще у одного впоследствии развился цирроз печени с осложнениями, хотя в целом прогноз был хуже у пациентов с идеопатическим АИГ, а не с ЛИ АИГ. R. Cheng et al. [16] сообщили, что в ключевом исследовании III фазы частота тяжелого гепатита у пациентов, получавших ипилимумаб в дозе 3 мг/кг, составила 2%, в 0,2% случаев наблюдалась терминальная печеночная недостаточность.
Следовательно, несмотря на относительно невысокую распространенность, возможно, обусловленную недостаточной информированностью врачей первичного звена о клинических проявлениях данного заболевания, повышенный риск развития серьезных осложнений и отличная от других ЛПП тактика ведения и лечения больных ЛИ АИГ позволяют многим исследователям считать эту форму ЛПП очень важной.
Цель настоящего обзора – анализ и систематизация данных об ЛС, которые могут потенциально приводить к развитию ЛИ АИГ, о патофизиологических механизмах его развития, способах диагностики, лечения и профилактики. Вопросы гепатотоксичных эффектов ЛС растительного происхождения, биологически активных добавок к пище и продуктов питания остаются за рамками данного обзора.
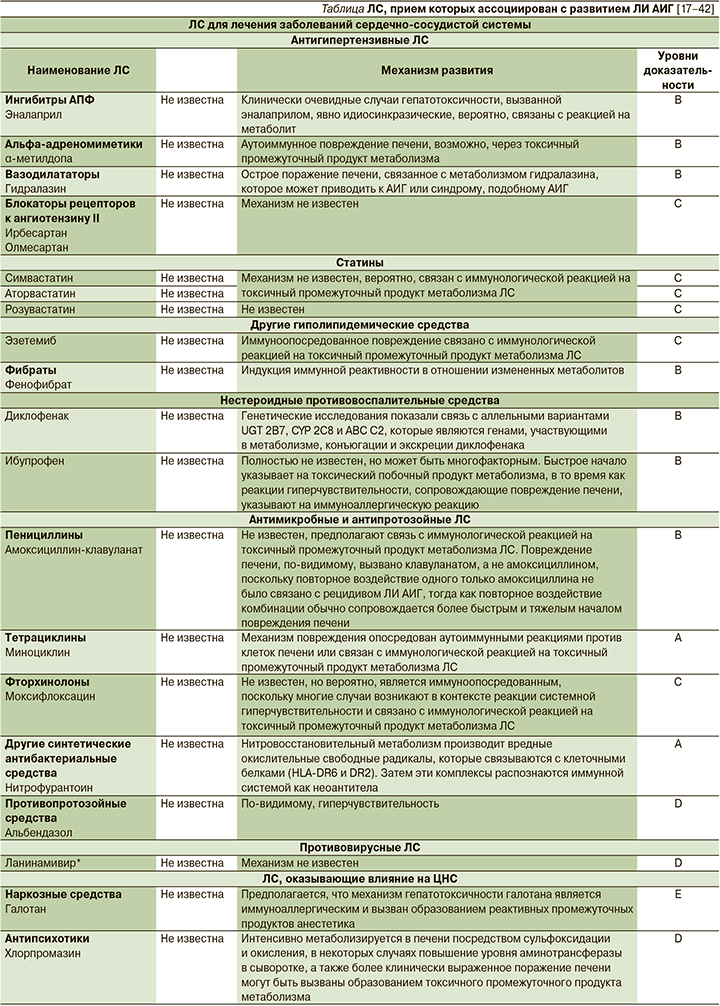
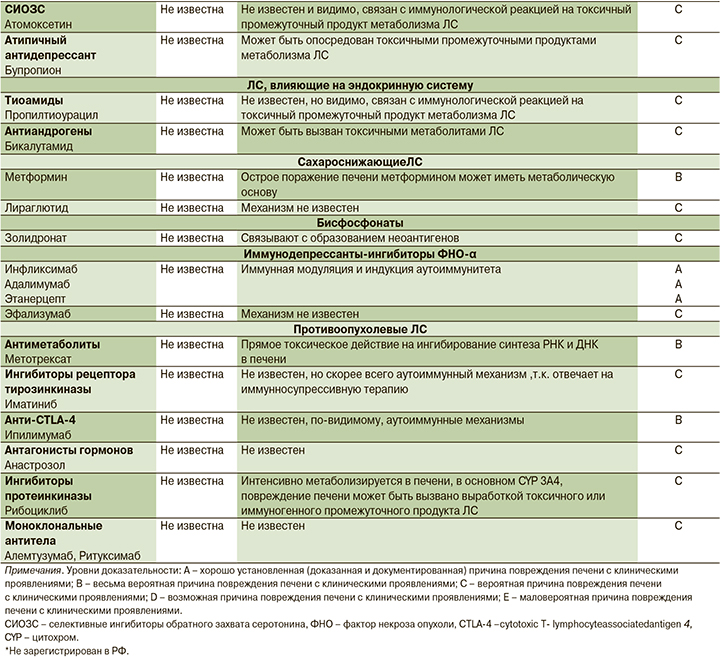
Отдельные ЛС, прием которых ассоциируется с развитием ЛИ АИГ
С развитием ЛИ АИГ ассоциируется прием около 30 ЛС разных классов (см. таблицу), причем этот список постоянно пополняется [17–42].
Гистологическая картина
Гистологическая картина при ЛИ АИГ включает апоптоз, некроз и воспалительные инфильтраты (мононуклеарные клетки, нейтрофилы, эозинофилы и лимфоциты), могут выявляться холестаз и исчезновение внутрипеченочных желчных протоков с умеренным воспалением перипортальной зоны [43]. Также могут быть обнаружены гранулемы [44]. Отличить ЛПП от АИГ гистологически не просто, многие признаки общие для обоих заболеваний, однако существуют и различия. Так, А. Suzuki et al. [45] показали, что во всех случаях ЛИ АИГ в биоптатах печени выявляются перипортальный гепатит (воспалительные инфильтраты с примесью плазматических клеток, распространяющиеся на перипортальную зону), очаговый некроз, апоптоз перипортальных гепатоцитов (т.н. межуточный гепатит), причем все эти изменения выражены в большей степени по сравнению с гепатоцеллюлярным типом ЛПП.
Е. Björnsson et al. [46] показали, что у пациентов с ЛИ АИГ при сравнении с больными идиопатическим АИГ при анализе гистологической картины печени степень и стадии патологического процесса оказались сходными. Однако ни у одного из пациентов с ЛИ АИГ не было признаков цирроза на начальных стадиях заболевания, тогда как у пациентов с АИГ он присутствовал в 20% случаев. A.J. Czaja [47] подтвердил, что цирроз печени – редкая гистологическая находка на начальных стадиях ЛИ АИГ, ассоциированного с приемом нитрофурантоина, что может помочь отличить его от классического АИГ (0 против 13%), хотя на более поздних стадиях ЛИ АИГ, ассоциированного с приемом нитрофурантоина, возникают выраженные фиброз и цирроз, в отличие, например, от миноциклин-индуцированного ЛИ АИГ [48].
Однако французские исследователи [12] при сравнении гистологической картины ЛИ АГ (8 случаев) и идиопатического АИГ отметили сходную частоту фиброза/цирроза (57 и 48% случаев). S. Appleyard et al. [49] опубликовали серию из тех случаев, в одном из которых на момент постановки диагноза присутствовали признаки фиброза/цирроза печени. Еще одна группа авторов [50] представила отчет о случае ЛИ АИГ с наличием цирроза печени при биопсии. Следовательно, отсутствие гистологической картины цирроза печени не может служить патогномоничным признаком ЛИ АИГ. По данным H.Y. Ju et al. [51], характерные гистологические особенности ЛИ АИГ, такие как перипортальный гепатит и лимфоплазмоцитарные инфильтраты, присутствовали примерно у трети пациентов с данным типом ЛПП.
Исходя из вышесказанного, следует подчеркнуть, что только по гистологическим признакам и без учета анамнеза и клинико-лабораторных симптомов дифференцировать ЛИ АИГ от истинного АИГ не представляется возможным [6].
Патогенетические механизмы
Прежде всего следует указать, что патогенетические механизмы аутоиммунного повреждения печени нуждаются в дальнейшем изучении. В общем виде на сегодняшний день они могут быть представлены следующим образом [6]. При наличии предрасполагающих факторов (например, особенностей структуры генов главного комплекса гистосовместимости) внешние триггеры, в т.ч. ЛC, могут индуцировать повреждение пептидных структур в организме человека, тем самым вызвать развитие к ним иммунного ответа. В такой ситуации в процесс могут вовлекаться и интактные ткани, в которых запускаются универсальные патофизиологические реакции в виде нарушения их целостности, воспаления, клеточной гибели и заместительного фиброза со снижением или утратой органом своей функциональной активности [6]. В развитии ЛИ АИГ могут иметь значение два типа факторов: связанные непосредственно с особенностями биотрансформации ЛС в организме и ассоциированные с индивидуальным профилем иммунологических реакций [6].
Предполагается, что механизмы развития ЛИ АИГ во многом подобны таковым при истинном АИГ [6]. На первом этапе антигенпрезентирующие клетки представлют Т-хелперам (популяция Th0) аутоантиген в сочетании с молекулой главного комплекса гистосовместимости II класса (HLA, Human Leukocyte Antigens). Th0 активируется, и происходит его дифференцировка в Th1, Th2 или Th17, что зависит от природы антигена и характера среды мироокружения. Субпопуляция Th1 продуцирует интерферон-γ и интерлейкин-2, которые активируют цитотоксические Т-лимфоциты и макрофаги, а также интенсифицируют экспрессию антигетов HLA I и II классов на гепатоцитах. Лимфоциты субпопуляции Th2 синтезируют главным образом интерлейкины-4, -10 и -13, стимулирующие в данном случае продукцию B-лимфоцитами аутоантител. В свою очередь активированные макрофаги начинают секретировать интерлейкин-1 и фактор некроза опухоли-α. Если есть нарушение функции регуляторных T-лимфоцитов (Treg), возникают и непосредственные гистопатологические реакции: разрушение клеточных элементов печени цитотоксическими Т-лимфоцитами, макрофагами, цитокинами Тh1 и натуральными киллерами при участии аутоантител, экспонированных на мембране гепатоцитов [6]. Относительно недавно описаны Т-клетки субпопуляции Th17. Они образуются под действием интерлейкина-6, трансформирующего фактора роста-β и интерлейкина-6. На данный момент считается, что их функция состоит в регуляции иммунного ответа (наравне с клетками Treg), возможно, в определенной степени их дополняет [6].
Принципиальное отличие ЛИ АИГ от идиопатического АИГ состоит в том, что в первом случае удаление из внутренней среды причинного модифицированного под действием ЛС антигена прерывает каскад иммунопатологических реакций [6]. Вместе с тем структурная модификация аутоантигенов считается триггерным фактором не во всех случаях ЛИ АИГ. Нельзя исключить прямого взаимодействия молекулы HLA с рецепторами Т-лимфоцитов. Такой механизм характерен для препаратов группы ингибиторов «контрольных иммунных точек», в частности блокатора CTLA-4 (цитотоксический белок 4, связанный с Т-лимфоцитами). Здесь имеет значение тот факт, что для активации цитотоксического лимфоцита кроме взаимодействия молекулы HLA II класса с Т-клеточным рецептором, специфическим для того или иного антигена, необходим контакт CD28 на лимфоците с CD80/86 на антиген-презентирующей клетке (АПК). Как и CD28, CTLA-4 экспонирован на мембране Т-лимфоцита и конкурирует с CD28 за связывание с CD80/86 на мембране АПК [6]. В ситуации, когда доминирует взаимодействие CD28 с CD80/86, лимфоцит активируется, если же преобладают контакты CTLA-4 с CD80/86, Т-лимфоцит остается в неактивном состоянии. Ипилимумаб является моноклональным антителом, связывающим CTLA-4 и тем самым способствующим стимуляции противоопухолевого иммунитета, но в то же время во многих случаях возникают аутоиммунные реакции, направленные против аутоантигенов. На фоне этого дебютирует широкий спектр клинических проявлений, в числе которых гепатит, колит, тиреодит, цитопении, нефрит, пневмонит, гипофизит, миокардит, перикардит, панкреатит, дерматит [6].
Существует несколько гипотез объяснения активации иммунной системы при ЛПП. Одна из главных из них – гипотеза гаптенизации [6]. Она постулирует следующее: некоторые ЛС метаболизируются в реактивные соединения, которые могут связываться с эндогенными белками и образовывать неоантигены, опознаваемые иммунной системой некоторых людей с полиморфизмами в системе HLA в качестве чужеродных антигенов, в результате чего возникает иммунная реакция.
Другая гипотеза объясняет развитие иммуноопосредованного лекарственного поражения печени фармакологическим взаимодействием [52]. Предполагается, что некоторые ЛС могут действовать непосредственно, образовывая нековалентные связи с молекулами HLA, что приводит к активации иммунной системы. Вполне вероятно, что изначально связь с молекулой HLA лабильна и служит лишь каркасом для взаимодействия молекулы ЛС с T-клеточным рецептором, с которым относительное сродство намного выше.
Третья гипотеза (модель измененного пептидного репертуара) предполагает, что определенные лекарственные молекулы могут вызывать неправильную переориентировку эндогенных пептидов на измененные антигены HLA, что приводит к развитию аутоиммунных реакций. Данная модель была в свое время предложена для объяснения развития сыпи при приеме абакавира и синдрома Стивенса–Джонсона при приеме карбамазепина [52]. Абакавир связывается в пептид-связывающей борозде локуса F молекулы HLA-B 57:01, тем самым изменяя его специфичность и структуру пептидов Т-клеток, таким образом вызывая развитие эквивалента аллореактивного Т-клеточного ответа.
Альтернативной для объяснения идиосинкразического ЛПП служит гипотеза множественных детерминант, утверждающая, что существуют различные факторы риска (такие, как полиморфизмы, возраст, пол и др.), способствующие возникновению ЛПП в случае их совместного действия [52].
Факторы риска
Факторы риска развития ЛИ АИГ окончательно не установлены и продолжают изучаться. При обследовании больного с подозрением на ЛИ АИГ следует обращать внимание на такие факторы, как женский пол, пожилой возраст, наличие в анамнезе эпизодов ЛПП любого типа как у самого пациента, так и у его родственников [43].
Женский пол
Женщины страдают идиопатическим АИГ и ЛИ АИГ чаще, чем мужчины (соотношение полов – 3,6:1) [54]. По данным цитируемого выше исследования Е. Björnsson et al. [46], при АИГ 78% (184/237) больных были женщинами, а при ЛИ АИГ – 92% (20/24), при этом в группе нитрофурантоина все пациенты с ЛИ АИГ были женщинами (11/11), а в группе миноциклина они составляли абсолютное большинство (10/11). А. Heurgué et al. [12] сообщили о 8 пациентах с ЛИ АИГ, из которых 87% были женщинами, что было сопоставимо с таковым при АИГ (82%). К. Sugimoto et al. [54] недавно опубликовали серию из 7 пациентов с АИГ, развившимися после первого эпизода ЛПП: 6 из них были женщинами. Таким образом, не только ЛИ АИГ встречается почти исключительно у женщин, но и в целом ЛПП чаще встречаются у женщин, часто имея более тяжелое течение, чем у мужчин [44, 46, 47, 55–57].
Возраст
Пожилые люди имеют повышенный риск развития любых типов ЛПП [57, 58]. Увеличение риска развития гепатотоксичных нежелательных лекарственных реакций с возрастом установлено для некоторых ЛС, прием которых ассоциирован с развитием ЛИ АИГ (например, нитрофурантоин, галотан). с возрастом увеличивается риск развития ЛПП.
Наличие в анамнезе эпизода ЛПП
При наличии в анамнезе у одного и того же пациента эпизодов ЛПП назначение ЛС сходной структуры или функции, а также любых других ЛС может приводить к развитию ЛИ АИГ [58]. Так, M.I. Lucena et al. [59] в испанском реестре ЛПП идентифицировали 9 пациентов из 742 (1,21%) с наличием в анамнезе 2 доказанных эпизодов ЛПП, относящихся к одному и тому же типу, но ассоциированных с приемом разных ЛС. В случае второго эпизода ЛПП более чем у 40% (4/9) пациентов клиническая картина напоминала ЛИ АИГ.
Генетический полиморфизм
Было идентифицировано несколько генетических полиморфизмов ферментов, метаболизирующих ЛС, в частности CYP, в результате чего могут продуцироваться токсические метаболиты лекарств [44]. Генетически обусловленные различия в метаболизме ЛС могут повышать вероятность развития ЛИ АИГ. Наличие более одного случая АИГ и ЛИ АИГ в семье подтверждает теорию о вовлечении генетических факторов [60].
Клинические проявления, диагноз и дифференциальный диагноз
Латентный период
До начала развития ЛИ АИГ в среднем проходит от 6 месяцев до нескольких лет после старта терапии препаратом-индуктором [6]. При ЛИ АИГ, ассоциированном с приемом ингибиторов ФНО-α, продолжительность латентного периода короче и составляет в среднем 13 недель, у 20% больных –
более 24 недель [61, 62].
Клиническая картина
ЛИ АИГ обычно имеет скрытое начало: пациенты жалуются на утомляемость, слабость, тошноту, плохой аппетит, дискомфорт в правом подреберье, желтуху (она может появляться позднее) или зуд [6, 63]. В некоторых случаях заболевание дебютирует остро, клинические проявления напоминают острый гепатит, аутоантитела появляются не раньше, чем через 2 месяца [6]. Иногда могут отмечаться симптомы поражения кишечника, легких, почек и других органов [6].
Характер повышения уровня ферментов преимущественно гепатоцеллюлярный с заметным повышением сывороточных аминотрансфераз (200–800 ЕД/л) и минимальным повышением уровня щелочной фосфатазы (<230 ЕД/л) [1, 63]. Однако описаны и случаи развития тяжелого холестаза с желтухой и кожным зудом [61, 64]. Уровень билирубина повышен в 2–10 раз равномерно – за счет обеих фракций или преимущественно за счет прямого. На фоне высокой активности заболевания возможно появление признаков печеночной недостаточности: гипоальбуминемии, гипокоагуляции, в отдельных случаях – энцефалопатии [65–67].
Наиболее характерны для ЛИ АИГ аутоиммунные проявления, в т.ч. повышение уровня сывороточных иммуноглобулинов более чем в 1,5–2,0 раза, особенно IgG, и появление аутоантител, наиболее типичны антинуклеарные (аntinuclear antibody; ANA), антигладкомышечные (smooth muscle antibody; SMA) и антитела к микросомам печени и почек (anti-liver kidney microsomal; анти-LKM) существенно реже встречаются антимитохондриальные (anti-mitochondria antibody; АМА) антитела. Титры антител при ЛИ АИГ, как правило, соответствуют таковым при идиопатическом АИГ.
При биопсии печени, если ее проводят, выявляют гистологическую картину, сходную с АИГ (см. раздел «Гистологическая картина» настоящего обзора).
В некоторых случаях симптомы ЛИ АИГ полностью не исчезают после отмены приема ЛС-индуктора, а некоторые пациенты даже нуждаются в длительной иммуносупрессивной терапии: после прекращения приема ГКС у них наблюдаются рецидивы (иногда тяжелые) [6]. В таких случаях неясно, действительно ли аутоиммунный гепатитоподобный синдром был вызван приемом препарата-индуктора, т.е. имеет место ЛИ АИГ, или же прием ЛС послужил триггером для появления клинических симптомов АИГ, который до того времени протекал бессимптомно?
Критерии диагностики
Хотя патогномоничных диагностических критериев ЛИ АИГ не существует, однако, исходя из его сходства с идиопатическим АИГ, к наиболее важным следует отнести [63]:
1. Время манифестации симптомов – от 2 месяцев и более;
2. Сыпь, артралгии и/или внепеченочные проявления;
3. Гепатоцеллюлярный характер повышения уровня сывороточных ферментов (R>5 в момент манифестации);
4. Наличие аутоантител в титрах 1:80 и выше (ANA, SMA, aнти-LKM);
5. Повышенный уровень иммуноглобулина (IgG >800 мг/дл) или общего глобулина (>3,0 г/дл);
6. Лечение препаратами, прием которых, согласно литературным данным, ассоциируется с развитием ЛИ АИГ (см. таблицу);
7. Биопсия печени: повышение количества плазматических клеток – характерный признак хронического гепатита;
8. Быстрый ответ на терапию ГКС (снижение уровня АЛТ примерно в 2 раза в течение 2 недель);
9. Окончательное выздоровление после прекращения приема ЛС (и терапии ГКС), однако выздоровление пациента может быть и более медленным: может потребоваться терапия ГКС в течение нескольких месяцев.
Дифференциальная диагностика
В первую очередь ЛИ АИГ необходимо дифференцировать от идиопатического АИГ, этот дифференциальный диагноз наиболее сложен. Сложность дифференциальной диагностики обусловлена еще и тем, что между ЛИ АИГ и идиопатическим АИГ существует определенная взаимосвязь.
Z. Liu и et al. первыми в 2002 г. [44] предложили выделять два типа развития данных заболеваний, а затем С. Weiler-Normann и С. Schramm в 2011 г. [68], основываясь на особенностях клинического течения симптомов, создали классификацию взаимосвязей АИГ и ЛИ АИГ. Во-первых, это пациенты с возобновлением симптомов диагностированного ранее АИГ при назначении нового ЛС, у них при гистологическом исследовании часто выявляется выраженный фиброз. Во-вторых, это пациенты с нераспознанным АИГ или с наличием факторов, предрасполагающих к его развитию, которых ЛПП приводит к манифистации симптомов АИГ: у них наблюдается хороший ответ на терапию ГКС, однако при ее отмене возникает рецидив симптомов, такие больные нуждаются в постоянной иммуносупрессии. Третий вариант (иммуноопосредованный ЛИ АИГ) – острое или хроническое ЛИ повреждение печени (в зависимости от продолжительности воздействия препарата-индуктора), симптомы которого проходят после отмены препарата. Наконец, имеются пациенты, у которых описано ЛПП с наличием аутоантител, такие случаи также должны диагностироваться, прогностическая значимость данного типа ЛПП требует дальнейшего изучения [43].
Доказать, что ЛС служит причиной аутоиммунного гепатитоподобного синдрома, иногда сложно, особенно если это препарат, для которого подобный побочный эффект не является частым. Наиболее диагностически значимо разрешение синдрома после отмены препарата. Однако улучшение часто начинается только через несколько недель, а наличие аутоиммунных проявлений зачастую диктует необходимость лечения ГКС, которые обычно используют для терапии идиопатического АИГ. Несмотря на то что контролируемые исследования эффективности и безопасности терапии ГКС при ЛИ АИГ не проводились, описания отдельных клинических случаев свидетельствуют о том, что их назначение приводит к быстрому снижению уровней билирубина и аминотрансфераз в сыворотке [1]. В этом отношении ЛИ АИГ напоминает идиопатический АИГ. Отличительным отличием между ЛИ АИГ и идиопатическим АИГ является отсутствие или наличие рецидива после отмены ГКС [1]: рецидив после отмены иммуносупрессорной терапии характерен для идиопатического АИГ и не типичен для ЛИ АИГ, если длительность курса лечения ГКС была адекватной. Кроме того, типично для ЛИ АИГ исчезновение аутоантител на фоне выздоровления [1]. Спонтанные улучшения могут происходить и при идиопатическом АИГ, но в конечном итоге произойдет рецидив, хотя иногда это может случиться спустя месяцы или годы. Рецидив после перенесенного ЛИ АИГ – редкое явление, причиной которого может быть возобновление приема провоцирующего ЛС.
А.О. Буеверов и Е.Л. Буеверова [6] предлагают ориентироваться на следующие признаки. Возраст дебюта АИГ имеет бимодальное распределение – 1–20 и 45–60 лет, тогда как в случае ЛИ АИГ медиана возраста пациентов в момент дебюта заболевания составляла 53 года; аутоантитела присутствуют в 60–70% случаев при ЛИ АИГ и в 90% – при идиопатическом АИГ; HLA DR3 и DR4 как в общей популяции при ЛИ АИГ и часто при идиопатическом АИГ; для ЛИ АИГ нехарактерно наличие эозинофилов в воспалительном инфильтрате, тогда как при идиопатическом АИГ это частая находка.
Однако, как и для всех лекарственно-индуцированных заболеваний, главным в диффренциальной диагностике остается определение взаимосвязи «прием ЛС–развитие симптомов заболевани» [57, 69]. Для ЛИ АИГ типична связь с приемом ЛС [6, 43], для оценки данной связи рекомендуется использовать алгоритм Наранжо [69–72].
Однако, как уже отмечалось выше, и в случае идиопатического АИГ такая связь возможна, ЛС может стать триггером манифистации симптомов данного заболевания. С другой стороны, доказать, что ЛС – причина аутоиммунного гепатитоподобного синдрома, иногда сложно, особенно если это препарат, для которого подобный побочный эффект не является частым. Наиболее диагностически значимо разрешение синдрома после отмены препарата. Однако улучшение часто начинается только через несколько недель, а наличие аутоиммунных проявлений нередко диктует необходимость лечения ГКС, которые обычно используют для терапии идиопатического АИГ. Несмотря на то что контролируемые исследования эффективности и безопасности терапии ГКС при ЛИ АИГ не проводились, описания отдельных клинических случаев свидетельствуют, что их назначение приводит к быстрому снижению уровней билирубина и аминотрансфераз в сыворотке [1].
В этом отношении ЛИ АИГ напоминает идиопатический АИГ.
Дифференциальный диагноз между ЛИ АИГ и другими ЛПП также необходим, но отличия достаточно очевидны: ключевым дифференциально-диагностическим признаком является повышение уровня γ-глобулинов и IgG при АИГ в отличие от других типов ЛПП [6]. Характерная клиническая картина АИГ также включает более молодой возраст дебюта заболевания, гепатоцеллюлярный тип изменения активности печеночных ферментов, достаточно длительный латентный период, характерную гистологическую картину, наличие симптомов со стороны других органов и систем, высокую эффективность преднизолона [6].
Лечение
Главное в лечении ЛИ АИГ, как и любого лекарственно-индуцированного заболевания, – отмена ЛС-индуктора. Эта мера в ряде случаев может приводить к исчезновению клинических симптомов и редукции патологических изменений печеночных ферментов в биохимическом анализе крови без дополнительного назначения ГКС-терапии [6]. Такая тактика оправданна, в частности, во многих случаях ЛИ АИГ, ассоациированного с приемом ингибиторов ФНО-α [64] и анти-CTLA-4 иммунотерапии [16]. Более того, после достижения ремиссии в ряде случаев возможен возврат к прерванному курсу лечения [6, 16, 66].
В ряде случаев ЛИ АИГ необходима терапия преднизолоном. Как уже было сказано выше, специальные рандомизированные контролируемые исследования эффективности и безопасности терапии ГКС при ЛИ АИГ не проводились, но в литературе имеются описания клинических случаев, свидетельствующих о быстром снижении уровня билирубина и аминотрансфераз в сыворотке при их назначении [6]. А. Licata et al. [72] представили серию случаев ЛИ АИГ из 12 пациентов, все они получали ГКС, и ни у одного из них не развился цирроз печени.
В обзоре Буеверова и Е.Л. Буеверо-вой [6], специально посвященном проблеме ЛИ АИГ, предложена АО-тактика лечения пациентов с этим заболеванием в зависимости от степени повышения АЛТ и билирубина. Так, при повышении активности АЛТ до 5–8 верхних границ нормы (ВГН) и уровня билирубина до 3–5 ВГН рекомендуется временно прекратить прием ЛС-индуктора, исключить другие причины поражения печени, проводить регулярный биохимический мониторинг уровня печеночных ферментов; при улучшении показателей можно возобновить терапию препаратом-индуктором, если это необходимо. При повышении уровня АЛТ более 8 и билирубина более 5 ВГН рекомендуется отменить ЛС-индуктор, назначить преднизолон в дозе 40–60 мг перорально, в случае рефрактерного течения заболевания начать внутривенное введение преднизолона в дозе 2 мг на 1 кг массы тела с повышением до 15 мг/кг. Вопросы скорости снижения доз иммуносупрессоров и сроков их отмены ввиду сохраняющегося риска рецидива ЛИ АИГ, особенно при возврате к прерванному курсу терапии препаратом-индуктором, окончательно не решен. В настоящее время рекомендуется быстрое снижение дозы при появлении признаков улучшения и полное прекращение терапии в течение 3–6 месяцев [16]. Важным аспектом применения ГКС является тщательное наблюдение за пациентами и мониторирование уровня печеночных ферментов в течение по крайней мере 6 месяцев после прекращения их применения, чтобы подтвердить полное выздоровление и отсутствие рецидива [64]. Как было отмечено в разделе «Дифференциальная диагностика», в ряде случаев ЛС являются триггерами развития клинических проявлений ранее недиагностированного идиопатического АИГ и у таких пациентов раннее прекращение ГКС-терапии может приводить к развитию тяжелых и даже смертельных рецидивов.
В отсутствие эффекта от применения ГКС в качестве препаратов резерва рассматривают мофетила микофенолат и ингибиторы кальциневрина циклоспорин и такролимус [16, 65, 66].
Также для лечения ЛИ АИГ в составе комбинированной терапии с ГКС рассматривается назначение урсодезоксихолевой кислоты [6], поскольку в ряде работ японских авторов показана ее эффективность в лечении идиопатического АИГ [73,74].
Профилактика
Специфические меры профилактики ЛИ АИГ не разработаны. Для этой цели можно рекомендовать проведение следующих мероприятий: учет наличия в анамнезе у пациента и его родственников любых ЛПП, в т.ч. избежание по возможности назначения гепатотоксичных ЛС, регулярный контроль уровня биохимических маркеров функции печени в сыворотке крови.
Заключение
Таким образом, ЛИ АИГ является хотя и нечастым, но серьезным осложнением фармакотерапии – это один из наиболее тяжелых вариантов ЛПП с потенциально неблагоприятным прогнозом при естественном течении. Тем не менее при своевременной диагностике и лечении симптомы данного заболевания полностью исчезают без рецидивирования, цирроз печени не формируется. В то же время имеют место определенные сложности в диагностике ЛИ АИГ специалистами практического здравоохранения в связи с низким уровнем информированности о данном заболевании.
Тщательный сбор анамнеза, особенно лекарственного, исключение других заболеваний печени, прежде всего идиопатического АИГ, могут помочь в постановке этого непростого диагноза.
В случае выявления у пациента ЛИ АИГ необходимо отменить подозреваемый препарат-индуктор, иногда требуется назначение курса терапии преднизолоном. Тщательный мониторинг клинических симптомов и уровня печеночных ферментов при применении гепатотоксичных препаратов служит залогом ранней диагностики, а учет факторов риска развития ЛИ АИГ – успешной профилактики его развития.
Вклад авторов. Остроумова О.Д. – сбор материалов, редактирование текста; А.В. Филиппова – сбор материалов, написание текста; А.И. Кочетков – сбор материала, редактирование теста.


