Введение
Проблема аллергического ринита (АР) продолжает сохранять свою высокую актуальность и медико-социальную значимость. Распространенность АР колеблется от 2 до 60% в различных регионах мира, и результаты исследований последних лет свидетельствуют о продолжающемся росте заболеваемости [1–3]. АР влияет на качество жизни, повседневную и физическую активность, профессиональную деятельность, когнитивные функции организма [4].
Высокая значимость АР для практического здравоохранения постоянно находит отражение в отечественных и международных согласительных документах, которые начали активно разрабатываться в начале 2000-х гг.
Основной задачей этих документов является восполнение знаний по проблеме АР и получение современных рекомендаций по основным принципам ведения пациентов с АР. На сегодняшний день основными документами принято считать руководство ARIA (Allergic Rhinitis and its Impacton Asthma, Аллергический ринит и его влияние на астму), а также РАДАР (Рекомендации и алгоритм при детском аллергическом рините), которые постоянно пересматриваются [5, 6].
В 2020 г. утверждены Федеральные клинические рекомендации Минздрава РФ, посвященные проблеме АР, которые представляют собой рекомендательный стандарт диагностики и терапии для больных АР [7]. В то же время и российские и международные согласительные документы предлагают обоснованный подход к выбору рационального алгоритма диагностики и терапии с учетом индивидуальных особенностей течения болезни и ситуаций в реальной клинической практике. В последних документах используется система GRADE (Grading of Recommendations Assessment, Development and Evaluation), метод оценки достоверности доказательств эффективности лекарственных средств, применяемых пациентами с АР [8, 9]. Это позволяет индивидуально подходить к больным и существенно улучшать и повышать эффективность терапии АР.
В предложенных документах широко обсуждаются различные аспекты АР, среди которых терапия АР является одним из важнейших приоритетных направлений. Современная концепция терапии АР заключается в проведении мероприятий, которые позволяют купировать острые проявления болезни, в последующем контролировать ее течение для поддержания длительной и устойчивой ремиссии. Они включают:
- полную элиминацию или уменьшение контакта с причинно-значимыми аллергенами и триггерами;
- проведение фармакотерапии;
- проведение аллергенспецифической иммунотерапии (АСИТ);
- образовательные программы для родителей и пациентов.
После постановки диагноза АР и определения причинно-значимого аллергена/триггера назначаются элиминационные мероприятия. Даже частичное выполнение мер, устраняющих специфические для данного пациента аллергены/триггеры, могут облегчить течение заболевания.
Для фармакотерапии АР разработана ступенчатая терапия, впервые предложенная ARIA-2008 и получившая дальнейшее развитие в документах Европейской академии аллергологии, клинической иммунологии и PRACTAL (посвященной ринитам у детей). Для определения контроля ринита и его оценки предлагаются вопросники (CARAT, RCAT, VAS и др.) [10, 11]. Предложенные вопросники основаны на оценке дневных и ночных симптомов, степени влияния фармакотерапии на физическую активность, способность к обучению и состояние сна. Отклонение от приведенных критериев указывает на потерю контроля симптомов болезни. Это требует увеличения терапии на ступень вверх (step-up), в случае же достижения ремиссии заболевания объем терапии снижается на ступень вниз (step-down). Для достижения контроля и поддержания ремиссии заболевания используются фармакологические препараты с различными механизмами действия. При этом необходимо помнить, что при оценке контроля симптомов следует учитывать связь АР с бронхиальной астмой, хроническим риносинуситом, аллергическим конъюнктивитом, которые также могут влиять на течение болезни.
Контроль симптомов АР осуществляется с помощью различных фармакологических средств, среди которых следует выделить интраназальные глюкокортикостероиды, пероральные и топические антигистаминные препараты, антагонисты лейкотриеновых рецепторов. При этом выбор фармакологических средств для терапии АР базируется на понимании патогенетических особенностей развития аллергического (иммунного) воспаления в слизистой оболочке носовых ходов. Главными участниками аллергического (иммунного) воспаления, отвечающими за развитие ранней и поздней фаз воспаления, являются иммунокомпетентные клетки (тучные клетки, базофилы, эозинофилы, лимфоциты и эндотелиальные клетки). Активация тучных клеток после контакта причинно-значимых аллергенов со специфическими иммуноглобулинами Е (IgE) – антителами, фиксирующимися на высокоаффинных рецепторах тучных клеток, которые локализуются в слизистой оболочке носа, приводит к выделению медиаторов воспаления – гистамина, лейкотриенов, простагландинов, брадикинина и др. Среди них гистамин – один из важнейших медиаторов, связанный с симптоматикой АР. Он способен оказывать влияние на верхние дыхательные пути, вызывая отек слизистой оболочки носа, гиперсекрецию слизи, повышение проницаемости сосудов.
Поэтому среди препаратов, подавляющих провоспалительное действие гистамина, широкое применение нашли антигистаминные препараты. Это класс лекарственных препаратов избирательно блокирует Н1-гистаминовые рецепторы. Первый антигистаминный препарат был внедрен в клиническую практику терапии аллергических заболеваний в 1942 г. С того времени список этих средств постоянно пополняется, синтезируются новые соединения, блокаторов Н1-гистаминовых рецепторов. Антигистаминные препараты (антагонисты Н1-гистаминовых рецепторов) представляют собой азотистые основания, содержащие алифатическую боковую цепь (как и в молекуле гистамина) замещенного этиламина, обеспечивающую противогистаминовую активность. Боковая цепь присоединена к одному или двум циклическим или гетероциклическим кольцам, в качестве которых могут выступать пиридин, пиперидин, пирролидин, пиперазин, фенотиазин, имидазол. Присоединение боковой цепи осуществляется через «соединительный» атом (Х) азота, углерода или кислорода. В отличие от гистамина атом азота в группе этиамина является двузамещенным (R1 и R2).
В клинической практике по-прежнему пользуются термином «антигистаминные препараты старого (первого) и нового (второго) поколений». В основе такого разделения лежит их способность вызывать седативный эффект. Препараты 1-го поколения хорошо проникают через гематоэнцефалический барьер и взаимодействуют с Н1-гистаминовыми рецепторами в коре головного мозге, обусловливая развитие седативного эффекта и блокируя физиологический эффект эндогенного гистамина. Седативный эффект может варьироваться от легкой сонливости до глубокого сна. Седативное действие подразумевает не только сонливость, но и влияние на тонкие функции мозга и психомоторную активность. Практически все антигистаминные препараты 1-го поколения (дифенгидрамин, хлоропирмин, клемастин, мебгидролин, прометазин) имеют седативный эффект разной степени выраженности, что ограничивает их применение у детей школьного возраста и взрослых.
Кроме того, антигистаминные препараты 1-го поколения не только блокируют Н1-рецепторы, но и проявляют конкурентный антагонизм в отношении ацетилхолина на уровне нейрональных и нейромышечных мускариновых рецепторов. Поэтому антагонисты мускариновых рецепторов могут вызывать такие побочные эффекты, как сухость во рту и слизистых оболочек носа, запор, тахикардия (табл. 1). Чаще всего эти побочные эффекты связаны с передозировкой препаратов 1-го поколения, а также в результате плохой информированности врачей об их фармакологических свойствах, противопоказаний к назначению.
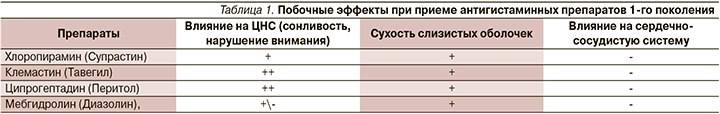
Антигистаминные препараты старого (первого) поколения являются ингибиторами печеночных ферментов CYP2D6. Поэтому они могут изменять метаболизм других лекарств, зависящих от метаболизма CYP2D6, таких как трициклические антидепрессанты, некоторые нейролептики, β-адреноблокаторы, антиаритмические средства и трамадол. Из-за этих побочных эффектов антигистаминные препараты старого поколения не рекомендуются для лечения AР, и это прописано в согласительных документах.
Следует помнить, что антигистаминные препараты старого (первого) поколения не следует назначать при глаукоме, язвенной болезни, больным сердечно-сосудистой патологией, совместно с противодиабетическими препаратами, психотропными средствами, спиртными напитками. Следует помнить о взаимопотенцирующем действии препаратов старого (первого) поколения с анальгетиками и антипиретиками, что позволяет уменьшать дозы каждого препарата. Необходимо учитывать атисеротониновый (ципрогептадин) эффект при лечении островоспалительных и токсических состояний. К недостаткам антигистаминных препаратов старого (первого) поколения относится феномен тахифилаксии (привыкание), требующий смены препарата каждые 7–10 дней. Продолжительность действия составляет 4–6 часов, поэтому препараты назначаются 3 раза в сутки.
Препараты нового поколения (например, лоратадин, дезлоратадин, фексофенадин, цетиризин, левоцетиризин) были разработаны для минимизации побочных эффектов более ранних препаратов (табл. 2). Они обладают высокой селективностью в отношении рецептора H, липофобны и имеют ограниченное проникновение через гематоэнцефалический барьер.

Препараты нового поколения назначают при первых проявлениях АР, а затем в качестве противорецидивной терапии. Могут применяться в виде монотерапии или в комбинации с другими медикаментозными средствами, такими как интраназальные глюкокортикостероиды. Для них характерно высокое сродство к Н1-рецепторам, быстрое начало действия, обладают высокой эффективностью, высоким профилем безопасности, продолжительностью действия до 24 часов, отсутствием блокады других рецепторов, седативного эффекта и тахифилаксии при длительном приеме, более широким спектром терапевтических показаний. Они не только препятствуют развитию эффектов гистамина, но и ингибируют простагландины, триптазу, лейкотриены, интерлейкины (ИЛ-4, ИЛ-6, ИЛ-8, ИЛ-13), фактор некроза опухли a, тормозят выделение провоспалительных хемокинов, подавляют адгезию и хемотаксис эозинофилов. Препараты нового поколения эффективны в ранней и поздней фазах аллергической реакции, что значительно расширяет область их клинического применения. Поэтому их можно назначать при аллергическом рините, крапивнице, атопическом дерматите, поллинозе. Вопрос об их применении при бронхиальной астме решается индивидуально с учетом реальной клинической ситуации.
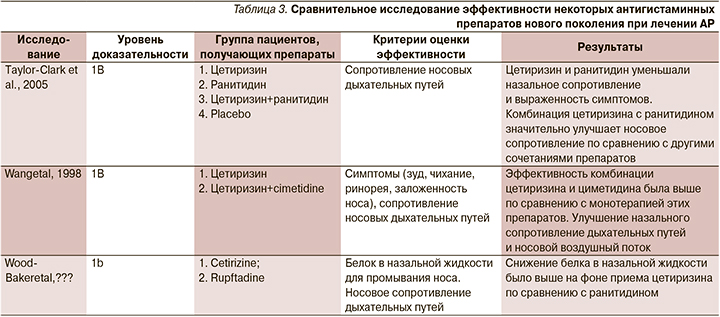
Исследование эффективности препаратов нового поколения ведутся постоянно (табл. 3). Для клинической оценки используют шкалу назальных симптомов TNSS (Total Nasal Symptom Score) и шкалу неназальных симптомов TNNSS (Total Non-Nasal Symptom Score), при этом выраженность клинических симптомов оценивается в баллах. Применяются также объективные тесты исследования проходимости носовых ходов: риноманометрия, суммарный носовой поток, носовое сопротивление, измерение назальной пиковой скорости вдоха [12].
Одним из ярких представителей Н1-антагонистов нового (второго) поколения является Зодак® (цетиризин) – производное этилендиамина, блокатор-Н1-рецепторов гистамина с периферической холиноблокирующей активностью. Цетиризин действует быстро, длительно, устраняет острые проявления аллергических симптомов и обладает возможностью «удерживать» устойчивую ремиссию АР [7]. Обладает хорошим профилем безопасности. Начало эффекта наступает уже через 20 минут и продолжается более суток [13, 14]. Применять цетиризин можно длительно, при необходимости – несколько месяцев [15]. Цетиризин нашел широкое применение в терапии АР у взрослых и детей, накоплен многолетний опыт его применения в клинической практике. Эффективность и безопасность цетиризина доказана результатами многочисленных исследований. Препарат является селективным антигистаминным средством, обладает высокой аффинностью к Н1-гистаминовым рецепторам [16–19]. За счет своего двойного действия (антигистаминного/противовоспалительного) и влияния на экспрессию ICAM-1 цетиризин у больных АР оказывает противозудное и противовоспалительное действия, уменьшает заложенность носа. Однократный суточный прием цетиризина обеспечивает контроль симптмов АР, что является важнейшей целью его фармакотерапии. Цетиризин практически не вызывает сонливости, не увеличивает вязкости бронхиального секрета, что важно для пациентов с бронхиальной астмой и сопутствующими заболеваниями дыхательных путей.
Цетиризин – активный метаболит гидроксизина. Выпускается в таблетках и в виде капель для приема внутрь. Рекомендуемая доза детям в возрасте 6–12 лет – по 1/2 таблетки (5 мг) 2 раза в сутки, детям старше 12 лет и взрослым – по 1 таблетке (10 мг) 1 раз в сутки. Капли принимают независимо от приема пищи, рекомендуемая доза для детей в возрасте от 6 до 12 месяцев составляет 2,5 мг (5 капель) 1 раз в сутки и возможно только по назначению врача под строгим медицинским контролем. Для детей от 1 года до 6 лет доза составляет 2,5 мг (5 капель) 2 раза в сутки утром и вечером, для детей старше 6 лет и взрослых – 10 мг (20 капель) 1 раз в сутки [13, 14].
Фармакокинетика
Всасывание. В дозах от 5 до 60 мг Cmax достигается примерно через 1,0±0,5 часа и составляет 300 нг/мл. Различные фармакокинетические параметры, такие как Cmax и AUC (area under the curve), имеют однородный характер. Прием пищи не влияет на полноту абсорбции цетиризина, хотя скорость ее уменьшается. Биодоступность различных лекарственных форм цетиризина (капли, капсулы, таблетки) сопоставима.
Распределение. Связывание с белками плазмы крови составляет примерно 93,0±0,3%. Vd составляет 0,5 л/кг. Цетиризин не влияет на связывание варфарина с белками. При приеме внутрь в суточной дозе 10 мг в течение 10 дней кумуляции цетиризина не наблюдалось.
Метаболизм. Цетиризин не подвергается экстенсивному первичному метаболизму.
Выведение. T1/2 составляет примерно 10 часов. Примерно 2/3 принятой дозы препарата выводится с мочой в неизмененном виде. У детей в возрасте от 6 до 12 лет T1/2 составляет 6 часов, в возрасте от 2 до 6 лет – 5 часов, в возрасте от 6 месяцев до 2 лет снижен до 3,1 часа.
Показаниями к применению препарата Зодак® являются:
- назальные и глазные симптомы круглогодичного (персистирующего) и сезонного (интермиттирующего) АР и аллергического конъюнктивита – зуда, чихания, заложенности носа, ринореи, слезотечения, гиперемии конъюнктивы;
- хроническая идиопатическая крапивница [13, 14].
Заключение
Таким образом, использование современных алгоритмов диагностики и лечения АР с помощью современных препаратов с доказанной безопасностью и эффективностью, предложенных в российских и международных согласительных документах, способствует повышению эффективности терапии, преодолению трудностей и неудач в лечении этого сложного заболевания [7–9].


