Введение
История использования ингаляций в лечении различных заболеваний насчитывает несколько тысячелетий в разных культурах. Известно, что еще до н.э. в Египте, Индии, Китае применяли вдыхание дыма от нагретых или сожженных растений (белены, дурмана, красавки). Первым примитивным устройством для ингаляций был предложенный Гиппократом глиняный сосуд с крышкой с вставленной соломинкой, через которую вдыхали пар от кипящих лекарственных трав и смол. Греческий врач Гален предлагал вдыхание порошкообразных лекарств для облегчения заболеваний носа и груди. Римские общественные бани использовали для лечения теплым влажным воздухом различных заболеваний, включая астму. Термин «ингалятор» предложил английский врач J. Mudge, создавший в 1778 г. простой прибор из оловянной кружки с клапаном и гибкой трубкой для вдыхания лекарственных паров. Это простое устройство можно считать родоначальником небулайзеров [1].
В последующие годы было создано множество устройств для доставки лечебных аэрозолей в дыхательные пути. Аэрозоли лекарственных средств широко используются в современной медицине для диагностики, лечения и профилактики заболеваний, преимущественно органов дыхания.
К неоспоримым достоинствам ингаляционной терапии аэрозолями относят доступность, безопасность, экономичность, неинвазивность, безболезненность. Высокий терапевтический эффект обусловлен большой площадью соприкосновения со слизистой оболочкой дыхательных путей, а также двойным механизмом воздействия – резорбтивным и рефлексогенным. Доставка препаратов непосредственно к месту патологического процесса позволяет минимизировать риск системного воздействия, снизить общую дозу лекарства. Ингаляционная терапия позволяет получать быстрый клинический эффект при использовании низких доз препаратов, значительно снижает риск побочных эффектов со стороны желудочно-кишечного тракта, а также уменьшает риск взаимодействия лекарств. Аэрозольные препараты отличает высокая биодоступность в связи с отсутствием биотрансформации в печени, желудке, кишечнике до начала их действия.
Ингаляционные устройства
На распределение и депонирование аэрозоля, соответственно, на эффективность ингаляции влияет множество факторов [2]:
- физико-химические свойства аэрозоля – размер частиц, респирабельная фракция;
- тип устройства для доставки медикамента;
- глубина и частота дыхания (медленное и глубокое дыхание способствует проникновению аэрозоля в нижние отделы легких);
- правильность выполнения техники ингаляции;
- проходимость дыхательных путей (наличие слизистых пробок, бронхоспазм).
Глубина проникновения аэрозоля зависит от размера его частиц. Установлено, что частицы размером более 10 мкм осаждаются и, соответственно, воздействуют в ротоглотке, от 5 до 10 мкм – в глотке, гортани и трахее, от 1 до 5 мкм – в нижних дыхательных путях, от 0,5 до 1 мкм – в альвеолах, а частицы менее 0,5 мкм остаются взвешенными в воздухе, не задерживаются в легких и свободно выходят в атмосферу при выдохе.
В соответствии с этой информацией разработаны ингаляционные устройства для образования аэрозоля с необходимыми размерами частиц и лечения заболеваний верхних или нижних дыхательных путей с минимизацией потерь лекарственных средств в окружающую среду.
Типы ингаляционных устройств представлены на рисунке.
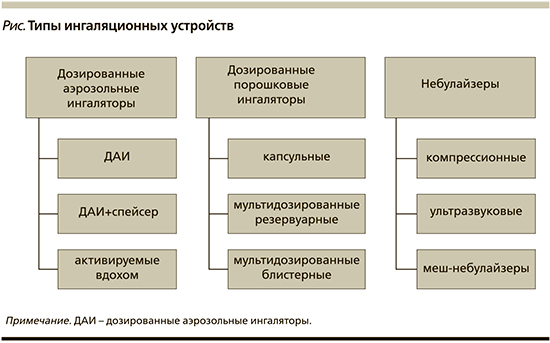
Дозированный аэрозольный ингалятор (ДАИ) – самый распространенный и доступный вид индивидуального ингаляционного устройства, разработанного еще в 1956 г. Образование аэрозоля из основного вещества с размером частиц от 0,2 до 12 мкм происходит под действием струи сжатого газа. Каждая порция аэрозоля содержит точно отмеренное количество лекарственного средства. К неоспоримым преимуществам ДАИ относятся портативность, компактность, невысокая стоимость, надежность устройства, возможность использовать его в домашних условиях самостоятельно, в т.ч. для неотложной помощи. Однако необходимость синхронизации вдоха с активированием баллончика ограничивает его применение в отношении детей раннего возраста. Необходимо тщательно инструктировать пациента и его родителей, при необходимости рекомендовать использование пространственных камер (спейсера) или лицевой маски [3].
Дозированные порошковые ингаляторы (ДПИ) не требуют синхронизации вдоха в отличие от ДАИ. Они не содержат газ-пропеллент, а основное вещество находится в виде суспензии сухого порошка с размером частиц от 1 до 8 мкм [4]. Респирабельная фракция составляет 10–30%. Для эффективного использования ингаляторов необходима высокая скорость инспираторного потока – не менее 30 л/мин, а в некоторых устройствах до 80 л/мин, что не всегда возможно в отношении детей при обострении хронических легочных заболеваний или тяжелом состоянии пациента [5].
Небулайзеры («nebula» – туман, облачко) состоят из источника энергии и распылителя жидкости – небулайзера. Термин «небулайзер» впервые был употреблен в 1874 г. для обозначения «инструмента, превращающего жидкое вещество в аэрозоль для медицинских целей». В зависимости от вида энергии, превращающей жидкость в аэрозоль, выделяют три основных типа небулайзеров, отличающихся скоростью и качеством образования респирабельных частиц: компрессорные (струйные), мембранные (вибрационно-сетчатые) – меш-небулайзеры и ультразвуковые.
Основным требованием к небулайзерам является непрерывная продукция аэрозоля с высокой долей (>50%) респирабельных (менее 5 мкм) частиц, что позволяет доставлять терапевтическую дозу требуемого препарата в бронхи и альвеолы за короткий период времени, обычно за 10–15 минут.
К неоспоримым преимуществам небулайзеров относятся простота использования, возможность ингаляционной терапии во время спокойного дыхания пациента, возможность прерывать ингаляцию при беспокойстве, кашле ребенка и продолжить ее после паузы. Небулайзерную терапию можно проводить пациентам с периода новорожденности, тяжелым больным и пациентам, испытывающим трудности с ингаляционной техникой.
Таким образом, небулайзерная терапия отвечает следующим требованиям:
- генерация лекарства не должна зависеть от больного;
- продолжительное образование лекарства сочетается с возможностью медленного, плавного дыхания;
- аэрозоль должен содержать большое число частиц менее 5 мкм. С учетом распространенного характера воспаления лекарство должно доставляться как можно в более глубокие отделы дыхательных путей;
- скорость ингаляции должна быть низкой, чтобы уменьшить оседание лекарства в ротоглотке и увеличить седиминтацию в легких.
С помощью небулайзеров можно обеспечить доставку препаратов в участки легких с нарушенной вентиляцией. Отсутствие газа-пропеллента, возможность непрерывной подачи лекарств, в т.ч. в высоких дозах, также являются важным аргументом в пользу этих устройств. Существенным аспектом использования небулайзеров является возможность контаминации и необходимость ухода за устройством и его дезинфекции [6].
Для ингаляций с помощью небулайзеров должны использоваться строго определенные формы лекарственных препаратов, специально предназначенных для этого вида терапии. Небулайзеры не предназначены для ингаляций минеральной воды, отваров и настоев трав, содержащих взвешенные частицы, маслосодержащих растворов, а также медикаментов, не имеющих точек приложения на слизистой оболочке респираторного тракта (эуфиллин, димедрол, папаверин и др.).
Компрессорные (струйные) небулайзеры создают аэрозоль, смешивая в распылительной камере поток сжатого газа (воздуха или кислорода), подаваемого компрессором, с лекарственным средством. Размер образуемых частиц обратно пропорционален скорости воздушной струи. Существуют более простые модели с непрерывным образованием аэрозоля и усовершенствованные, снабженные клапаном выдоха или сенсором воздушного потока, снижающим потери лекарства. Этот тип небулайзеров имеет ряд преимуществ: надежность, универсальность, широкий ряд используемых препаратов, экономичность, низкие потери лекарств, малый остаточный объем. Есть модели небулайзеров с регулируемым размером аэрозольных частиц, что позволяет использовать одно устройство для лечения заболеваний разных отделов дыхательной системы, в т.ч. ЛОР-органов [7].
Меш-небулайзеры используют вибрирующую пластину или мембрану (сетку) с множественными микроскопическими коническими отверстиями, через которую пропускается (проталкивается) лекарственный раствор, генерируя аэрозоль [8]. Размер частиц равен таковому отверстий в сите, что позволяет производить аэрозоль с заданными параметрами. Принципиальная особенность меш-небулайзеров: энергия колебаний пьезокристалла направлена не на лекарственный раствор, а на вибрирующую пластину, поэтому основное вещество не подвергается структурному разрушению или согреванию. В данных устройствах время ингаляции короче, а остаточный объем невысок, что позволяет экономно расходовать лекарства. По сравнению с другими видами небулайзеров меш-небулайзеры обеспечивают самую высокую легочную депозицию (до 70%). Меш-небулайзеры компактны, их удобно брать с собой в путешествие и поездку. Прибор можно использовать под любым углом, в т.ч. лежачим пациентам.
В ультразвуковых небулайзерах образование аэрозоля происходит за счет высокочастотных колебаний пьезокристалла, передающихся лекарственному раствору. К достоинствам ультразвуковых небулайзеров можно отнести бесшумность, высокую скорость продукции аэрозоля, возможность распыления больших объемов жидкости. Однако использование ультразвуковых небулайзеров ограничено невозможностью распыления суспензий, крупномолекулярных веществ, вязких растворов. Некоторые препараты могут разрушаться ультразвуком (кортикостероиды, сурфактант) или в результате нагревания раствора (антибиотики, пептиды).
Небулайзерная терапия
Основные заболевания органов дыхания у детей, при которых широко используется небулайзерная терапия [2, 9]:
- бронхиальная астма;
- муковисцидоз;
- острые вирусные и бактериальные заболевания респираторного тракта, в т.ч. ЛОР-органов;
- туберкулез легких;
- грибковые поражения верхних и нижних дыхательных путей;
- острый респираторный дистресс-синдром у новорожденных;
- бронхоэктазии.
Основные направления небулайзерной терапии [10]:
- уменьшение отека;
- уменьшение активности аллергического воспалительного процесса;
- купирование бронхоспазма;
- санация дыхательных путей;
- улучшение мукоцилиарного клиренса;
- увлажнение слизистой оболочки верхних дыхательных путей и бронхов;
- улучшение микроциркуляции.
В отношении детей до 6-летнего возраста следует отдавать приоритет небулайзерной терапии в связи с невозможностью или трудностями соблюдения техники ингаляций с помощью других устройств, а также отсутствием выбора ингаляционных глюкокортикостероидов (ИГКС), за исключением небулизированной суспензии будесонида с первых месяцев жизни. Небулайзерная терапия при купировании обострений бронхиальной астмы является преимущественным методом доставки препаратов, особенно у детей раннего возраста [11].
В качестве эффективной противовоспалительной и противоотечной терапии рекомендуют широкое использование ИГКС (будесонид, беклометазон) [12, 13]. Ингаляционное применение ГКС позволяет обеспечивать выраженный терапевтический эффект при минимальных системных проявлениях. Кратность приема, длительность терапии, дозировки подбираются индивидуально в зависимости от диагноза, степени тяжести заболевания.
При наличии бронхоспазма ингаляции бронхолитиков должны предшествовать ИГКС. Бронхолитики могут быть использованы как самостоятельно, так и одновременно с ИГКС, в т.ч. и в отношении детей до 1 года [14].
β2-адреномиметики немедленного действия – сальбутамол, фенотерол. Высокоселективные стимуляторы β2-адренорецепторов начинают действовать через 5–10 минут после ингаляции, терапевтический эффект сохраняется до 4–6 часов. Воздействуют преимущественно на средние и мелкие бронхи.
М-холиноблокаторы – ипратропия бромид. Антихолинергические средства блокируют мускариновые М3-рецепторы гладкой мускулатуры трахеобронхиального дерева для ацетилхолина. Бронхолитический эффект наступает медленнее, чем у β2-агонистов, но длится до 8 часов, при этом расширяются крупные и средние бронхи, снижается секреция бронхиальной слизи.
Комбинация β2-агонистов и М-холиноблокаторов – фенотерол/ипратропия бромид, сальбутамол/ипратропий. Сочетание этих фармакологических групп позволяет оказывать влияние на различные мишени, воздействовать на различные отделы бронхиального дерева, а также использовать меняющуюся активность адрено- и холинорецепторов в отношении детей в различные возрастные периоды.
Муколитики и секретолитики. Среди мукоактивных средств выделяют группу препаратов, которые можно использовать через небулайзер. Амброксол является активным метаболитом бромгексина нового поколения с высокой биодоступностью. Он оказывает многокомпонентное действие, влияя на различные звенья патологического процесса в бронхах. Муколитические и секретолитические свойства амброксола обеспечивают уменьшение количества и вязкости бронхиального секрета за счет ингибиции экспрессии гена MUC5AC в респираторном эпителии, снижении уровня глюкозаминогликанов [15]. Амброксол дозозависимо повышает частоту биения ресничек мерцательного эпителия и скорость мукоцилиарного клиренса, способствует восстановлению функции слизистой дыхательных путей [16]. Препарат оказывает противовоспалительное и антиоксидантное действия, увеличивает активность макрофагов, проникновение антибактериальных препаратов в альвеолярную ткань, а также оказывает местноанестезирующее действие [17].
Амброксол является стимулятором синтеза эндогенного сурфактанта – липопротеидного комплекса, синтезируемого альвеолоцитами второго типа. Сурфактант образует каркас, препятствующий ателектазированию альвеол на выдохе, создает защитный барьер для внедрения патогенных микроорганизмов; обеспечивает элиминацию макрофагами вирусов, бактерий и инородных частиц из альвеол в бронхи; улучшает скольжение бронхолегочного секрета в альвеолах [18]. Активизация синтеза фосфолипидов под действием амброксола, а также участие в гомеостазе ионов водорода и кальция повышает количество сурфактанта и облегчает его высвобождение из пневмоцитов, приводит к усилению мукоцилиарного транспорта, улучшению вентиляционной функции дыхательных путей [19, 20]. Это особенно актуально для применения амброксола в отношении младенцев с респираторным дистресс-синдромом (РДС) [21]. Установлено антиоксидантное, а также потенцирующее действие амброксола на антибиотики за счет увеличения их диффузии в ткани легких и усиления бактерицидного эффекта [22, 23]. Амброксол обладает противовоспалительной активностью, ингибируя синтез интерлейкинов и фактора некроза опухоли α (ФНО-α). Препарат показал эффективность в лечении неонатальной пневмонии, достоверно улучшая функцию легких, снижая экспрессию воспалительных факторов, ингибируя апоптоз клеток и активацию сигнального пути фактора транскрипции NF-kB [24].
В ряде исследований выявили способность амброксола влиять на бактериальные биопленки, разрушая их структуру [25]. Амброксол рекомендуется в комплексном лечении бронхиальной обструкции для улучшения дренажной функции бронхов [26].
В исследованиях также показано, что амброксол обладает опосредованной противовирусной активностью за счет повышения уровня эндогенных ингибиторов протеаз, иммуноглобулина А (IgA) и IgG. Препарат усиливает местный иммунитет, активируя тканевые макрофаги и повышая продукцию секреторного IgА [27].
В недавних исследованиях по новой коронавирусной инфекции сообщается о выявленных свойствах амброксола как эффективного ингибитора взаимодействия между рецептор-связывающим доменом (RBD) спайкового белка SARS-CoV-2 и человеческого ангиотензинпревращающего фермента 2.
Блокада амброксолом цитопатического действия SARS-CoV-2 делает его перспективным кандидатом в качестве возможного варианта профилактики и/или лечения данной инфекции [28, 29]. Амброксол можно применять с периода новорожденности, раствор для ингаляций назначают детям до 6 лет по 2 мл, старше 6 лет – по 2–3 мл 1–2 раза в сутки, смешивая с равным количеством физиологического раствора [30].
Дорназа альфа (рекомбинантная человеческая ДН-аза) является искусственно созданной копией фермента человека. Обладает мощным муколитическим, а также противовоспалительным и антибактериальным действиями. Дорназа альфа способна разрушать внеклеточную ДНК, содержащуюся в вязком густом секрете бронхиальных желез, существенно уменьшая вязкость мокроты. Используется преимущественно для восстановления дренажной функции бронхов у больных муковисцидозом [31].
Физиологические и гипертонические 3-, 5-, 7%-ные растворы. Изотонический раствор натрия хлорида является оптимальным растворителем, а также может использоваться самостоятельно для увлажнения слизистой оболочки дыхательных путей. Группой ученых из Сингапура разработана инновационная методика изучения in vitro влияния физиологического раствора хлорида натрия на изменение поверхностной архитектуры частиц амброксола гидрохлорида [32]. Показано, что угловые элементы на поверхностях способствовали созданию гофрированных частиц с повышенной аэродинамикой, что повышает биодоступность (респирабельная фракция увеличилась в 10 раз), обеспечивает хорошую текучесть и устойчивость к влажной среде.
Гипертонические растворы используют для индукции мокроты, однако следует применять их с осторожностью вследствие возможного бронхоспазма из-за гиперреактивности бронхов.
Дистиллированная вода не рекомендуется в качестве растворителя, т.к. гипотонический раствор может вызывать бронхоконстрикцию у пациентов с повышенной чувствительностью рецепторов бронхиального дерева.
Небулайзерная терапия и COVID-19
В домашних условиях при соблюдении рекомендуемых мер гигиены небулайзеров нет противопоказаний к их использованию пациентами с COVID-19. В условиях стационара небулайзерную терапию используют с соблюдением мер эпидемиологической безопасности [33]. Больным хроническими респираторными заболеваниями рекомендуется продолжать ранее назначенную ингаляционную терапию. Отмена ИГКС может приводить пациентов с бронхиальной астмой к потенциально опасному ухудшению ее течения [12].
Заключение
Возможность доставки лекарственных веществ непосредственно в зону патологического процесса при минимальном системном воздействии – самое главное преимущество небулайзерной терапии в педиатрической практике, включая неонатологию. Ингаляционный путь введения детям предпочтителен для лечения большей части острых, хронических и рецидивирующих заболеваний респираторного тракта. Выбор конкретного устройства доставки зависит от возраста пациента, состояния дыхательной системы, вида необходимого лекарственного средства, приверженности лечению и других факторов. Эффективность и безопасность небулайзеров научно обоснованы, а в ряде случаев их использование – единственно возможный способ введения. Лечение через небулайзер дает возможность индивидуального подбора дозы и кратности введения препарата под контролем клинического состояния больного.


