Введение
Данная публикация анализирует результаты использования биологической терапии и позиции международных клинических рекомендаций при тяжелых формах псориаза, информация о которых весьма ограничена для практического использования, что особенно актуально в условиях роста числа тяжелых форм псориаза, с которым встречаются не только дерматологи.
Псориатическая эритродермия (ПЭ)
ПЭ – это редкий и тяжелый вариант вульгарного псориаза с частотой развития от 1 до 2,25% среди пациентов с псориазом [1].
ПЭ обычно представлена такими проявлениями, как эритема, отек, зуд, плохо определяемые псориатические бляшки, поверхностное шелушение, выпадение волос, поражение ладоней и подошв по типу кератодермии [2–7].
Кроме того, при ПЭ очень часто встречаются изменения ногтей, при этом тяжесть заболевания может варьироваться от легких изменений до тяжелой ониходистрофии, чаще поражая ногти на руках, а не на ногах [3, 5, 6].
Некоторые авторы отмечают, что при ПЭ характерна генерализованная воспалительная эритема с/без эксфолиации с вовлечением не менее 75% площади поверхности тела. Другие авторы утверждают, что должно быть поражено как минимум 90% площади поверхности тела [2, 3, 7].
Кроме того, у пациентов с ПЭ могут иметь место системные симптомы: лихорадка, тахикардия, усталость, недомогание, озноб, обезвоживание, лимфаденопатия, артралгии, миалгия, бессонница, потливость, диарея, запоры, снижение веса, редко тяжелая сердечная недостаточность на выходе (из-за чрезмерной потери воды и отеков) и кахексия [3, 7, 8]. Лабораторные результаты могут обнаруживать массивную потерю белка и жидкости, лейкоцитоз, анемию, повышенные уровни С-реактивного белка и скорости оседания эритроцитов, отклонения электролитного состава крови, температурные отклонения (гипо- или гипертермия), в редких случаях – патологию печени с функциональными изменениями тестов [5, 9, 10].
Диагноз ПЖ может быть подтвержден гистологически характерной картиной периваскулярных инфильтратов, преимущественно состоящих из лимфоцитов и гистиоцитов, с расширением капилляров и гиперкератозом. Дополнительные гистологические подтверждения ПЭ включают некоторые особенности классического псориаза, включая паракератоз, акантоз, спонгиоз, микроабсцессы Мунро и иногда апоптоз кератиноцитов [9, 11, 12]. Однако из-за отслаивания и потери эпидермального рогового слоя микроабсцессы Мунро и паракератоз могут быть незаметными при гистологическом исследовании [11]. Кроме того, чтобы подтвердить диагноз ПЭ, особенно если она развилась без предшествоввшего вульгарного псориаза (ВП), врач должен исключить другие вероятные причины, такие как атопический дерматит, красный волосяной лишай, сыпь при приеме лекарственных препаратов, заболевания соединительной ткани, синдром Сезари и другие злокачественные новообразования [3, 9, 13].
ПЭ можно разделить на два основных клинических подтипа. Первый характеризуется наличием псориатических бляшек с постепенным развитием генерализованной эритродермии, при которой псориатические бляшки остаются дифференцируемыми от эритродермии. Эта форма имеет относительно стабильный и благоприятный прогноз. Второй подтип, который чаще наблюдается у пациентов с наличием псориатического артрита, часто характеризуется быстро развивающейся эритемой всего тела и отсутствием четких границ псориатических бляшек. Течение заболевания у данного типа пациентов относительно нестабильно и может быть связано с аномальными жизненными и лабораторными показателями. При втором подтипе прогноз неблагоприятный, возможны смертельные исходы. Первый клинический подтип часто связан с хроническим и длительным течением, в то время как второй подтип скорее всего бывает острым, быстропрогрессирующим и рецидивирующим [7, 14].
Важный аспект, который необходимо учитывать в отношении пациентов с псориазом, заключается в следующем: использование некоторых препаратов, таких как пероральные глюкокортикостероиды и метотрексат, также может приводить к развитию эритродермии [15, 16]. Наконец, имеются литературные данные о развитии ПЭ при использовании ацитретина, этретината, инфликсимаба, лития, противомалярийных препаратов. Развитие ПЭ было описано при некоторых системных заболеваниях, таких как вирус иммунодефицита человека, лейкемия, Т-клеточная лимфома и подагра [7, 17, 18].
Патогенез ПЭ
Патогенез развития ВП достаточно хорошо изучен в последнее время. Показано, что антигены класса I HLA-Cw6, HLA-B57, HLA-B13 и HLA-B17 связаны с развитием ВП, а мутации в IL36RN – с развитием пустулезного псориаза, при этом очень мало известно о генетической основе развития ПЭ [19, 20].
Недостаток данных о ПЭ заставляет нас полагаться на информацию, полученную из небольших исследований, отчетов о клинических случаях, серий случаев и небольшого числа сравнительных исследований с участием больных ПЭ, пациентов с ВП и здорового контроля. В 2005 г. ученые продемонстрировали статистически значимое увеличение сывороточного иммуноглобулина Е при ПЭ по сравнению с больными ВП. Это несоответствие было объяснено дисбалансом Th1/Th2 в пользу дифференциации Th2 [21].
Недавнее исследование с участием 16 пациентов далее развило идею вовлечения Th2. В нем были сделаны 3 важных открытия, касающихся патогенеза ПЭ: во-первых, соотношение Th1/Th2 было значительно ниже у пациентов с ПЭ, чем у больных ВП; во-вторых, уровни интерлейкинов IL-4 и -10 были значительно выше у пациентов с ПЭ, чем у здоровых лиц и больных ВП; в-третьих, соотношение интерферона ИНФ-γ/IL-4 у пациентов с ПЭ было <1,0 и представляло полную противоположность по сравнению с двумя другими группами [22].
С учетом важного вклада Th17 в патогенез ВП недавно исследована роль Th17 в патогенезе ПЭ. Клетки Th17 секретируют IL-17, -22 и IFN-γ, усиливая выработку Т-клетками воспалительных хемокинов, дендритных клеток и нейтрофилов [23].
При использовании иммуногистохимического анализа Moy et al. обнаружили, что при ПЭ Th17 являются наиболее преобладающим пулом Т-клеток после Th2. Авторы также отметили схожесть увеличения содержания клеток Th17 как при ПЭ, так и при эритродермическом варианте атопического дерматита [24].
На молекулярном уровне было также показано чрезмерное содержание фактора некроза опухоли (TNF-α) в содержимом псориатической бляшки, на основании чего высказано предположение, согласно которому быстрое системное высвобождение TNF-α при ПЭ может обеспечивать быстрое начало и тяжесть заболевания [25].
Лечение ПЭ
Прежде всего лечение ПЭ должно включать компенсацию гемостаза: воды, белков и электролитов; профилактику переохлаждения, а также терапию любых вторичных инфекций для профилактики септических осложнений. По данным некоторых авторов, сепсис, чаще всего вызванный золотистым стафилококком, особенно тяжелое и потенциально смертельное осложнение, которое наиболее часто развивается у этих пациентов [26].
В 2010 г. Американская медицинская комиссия National Psoriasis Foundation опубликовала согласительные рекомендации по использованию циклоспорина или инфликсимаба в качестве первой линии терапии пациентов с эритродермией и нестабильным течением. При этом ацитретин и метотрексат были рекомендованы пациентам с более стабильной клиникой [3].
Поскольку число клинических исследований по лечению генерализованных форм псориаза ограниченно, эффективность той или иной терапии достоверно оценить достаточно сложно.
С момента разработки рекомендаций 2010 г. прошло много лет. За это время были созданы и хорошо изучены новые классы биологических агентов, таких как ингибиторы IL-12/23, -17. Обновленные данные по использованию новых лекарственных групп весьма полезны для лечения таких пациентов ввиду роста заболеваемости псориазом, а также формирования тяжелых генерализованных форм. На основании проведенного анализа практических и научных данных в 2019 г. опубликованы обновленные клинические рекомендации AAD-NPF, в которых проанализирован уровень доказанности данных одобренных и широко используемых генно-инженерных биологических препаратов (см. таблицу) [27].
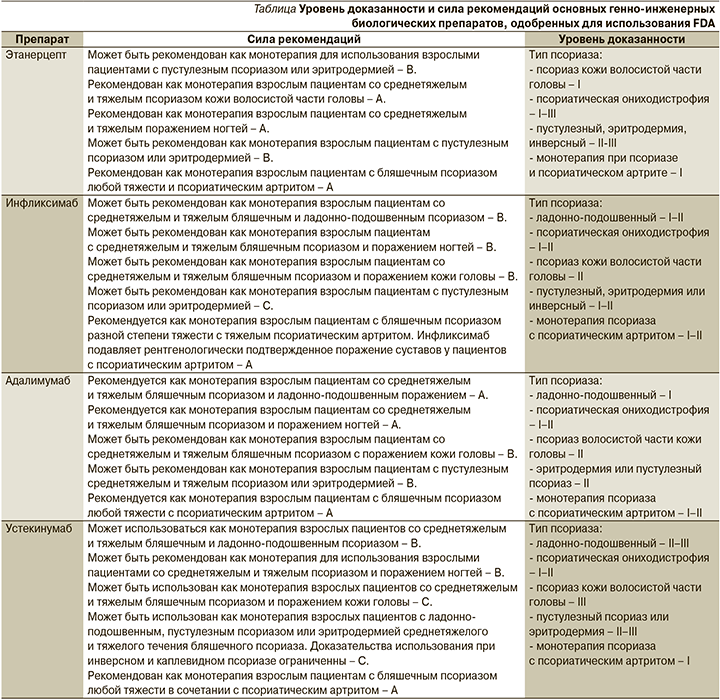

Заключение
Хотя доказательства эффективности генно-инженерных биологических препаратов при ПЭ безусловно ограниченны, биологическую терапию, по-видимому, можно считать эффективным подходом к лечению данной формы псориаза. Есть данные о благоприятном использовании биологических препаратов при таких серьезных состояниях.
Личный положительный опыт использования ингибиторов IL-17 при различных формах псориаза, а также при ПЭ, очевидно, еще раз подтверждает единую гипотезу патогенеза ПЭ, где важную роль играют Th17 типа и IL-17. Наличие хорошо изученного универсального средства позволяет получать предсказуемые результаты терапии и экономить драгоценное время, особенно актуальное для пациентов с генерализованными формами псориаза. Однако для оценки сравнительной эффективности и безопасности различных биологических препаратов для пациентов с ПЭ необходимы более масштабные контролируемые клинические исследования.


