Введение
В настоящее время инсульты являются значимой медицинской проблемой, что обусловлено их местом в структуре летальности, а также социальной проблемой, т.к. это влечет за собой потерю трудоспособности. Развитие инсультов у молодых людей еще больше увеличивает значимость данной проблемы. С клинической точки зрения важно, что причины развития инсультов у молодых пациентов и людей старшего возраста различны. Обследование пациентов с целью уточнения механизма развития инсульта позволяет осуществлять профилактику повторных событий, имеет первостепенное значение для каждого конкретного пациента и большую медикосоциальную значимость. Согласно исследованиям, основной причиной криптогенных инсультов, составляющих от 30 до 40% от всех ишемических инсультов в молодом возрасте, считается тромбофилия, врожденная или приобретенная [1]. С другой стороны, наличие тромбофилии повышает риск развития не только инсультов, но и других тромботических событий [2]. Самые распространенные причины наследственных тромбофилий – это мутация фактора V Лейдена, мутация FII G20210A (протромбина), дефицит факторов С и S, дефицит антитромбина. Среди приобретенных тромбофилий наиболее часто встречается антифосфолипидный синдром.
Частота мутации FII G20210A в европеоидной популяции составляет от 1 до 2% [3, 4], у пациентов с диагностированными эпизодами тромбоза – от 4 до 7% [3, 5]. Полагают что у гетерозиготных носителей мутации риск первого эпизода венозного тромбоза в 2–5 раз выше, чем у людей без этой мутации [4].
Тромбофилии – не единственная причина инсультов у молодых. В ряде случаев инсульты в молодом возрасте могут быть связаны с врожденными пороками развития сердечно-сосудистой системы, благодаря которым реализуется механизм «парадоксальной эмболии». К одним из таких пороков относятся артериовенозные мальформации [6, 7].
В настоящей статье представлена история болезни молодой пациентки с рецидивами тромботических событий (повторные острые нарушения мозгового кровообращения, транзиторная ишемическая атака, венозный тромбоз) на фоне врожденной тромбофилии (гетерозиготная мутация в гене FII G20210A протромбина) в сочетании с артериовенозной мальформацией в легких.
Клинический случай
Пациентка А. 40 лет поступила в отделение кардиологии ГМПБ № 2 Санкт-Петербурга в плановом порядке для выполнения эндоваскулярного закрытия легочной артериовенозной фистулы.
Анамнез заболевания. Пациентка считает себя больной с ноября 2016 г., когда во время пятой беременности на сроке 11 недель на фоне относительного благополучия (через 7 дней после полета на самолете) возникло двоение в глазах, нарушение речи, шаткость походки. При проведении магнитно-резонансной томографии (МРТ) головного мозга выявлены признаки лакунарного острого нарушения мозгового кровообращения (ОНМК) по ишемическому типу в вертебро-базилярном бассейне. Пациентка обследована с целью уточнения генеза ОНМК. При дуплексном сканировании брахиоцефальных сосудов данных за атеросклеротическое поражение артерий не получено. Ультразвуковое исследование сосудов нижних конечностей не выявило патологических изменений артерий и вен. По результатам коагулограммы определено незначительное увеличение уровня фибриногена – до 4,25 г/л (норма – 2–4 г/л). Уровень гомоцистеина крови – 6,12 мкмоль/мл
(норма – 4,44–13,56 мкмоль/мл). Пациентка выписана в удовлетворительном состоянии и направлена на консультацию к гематологу.
По рекомендации гематолога выполнен ряд исследований с целью уточнения генеза инсульта. Уровень антифосфолипидных антител в пределах референсных значений 1,79 МЕ/мл (норма – 0–10 МЕ/мл). Коагулогическое исследование: фактор VIII и фактор Виллебранда (антиген) – в пределах референсных значений. Иммуноферментный анализ на CBA-I (коллаген-I – связывающая способность фактора Виллебранда), CBA-III (коллаген- III – связывающая способность фактора Виллебранда) – в пределах референсных значений. Исследование функциональной активности тромбоцитов показало, что агрегация тромбоцитов с ристомицином без отклонений, с АДФ и коллагеном снижена, с коллагеном – дезагрегация.
Генетическое исследование выявило гетерозиготность гена протромбина (FII G2021OA) и гетерозиготность гена метилентетрагидрофолатредуктазы (MTGFR). С учетом полученных данных назначена антитромботическая терапия: эноксапарин натрия 0,6 мл/сут подкожно до родов и в послеродовом периоде. Однако пациентка не выполняла рекомендаций и на фоне отсутствия антикоагулянтной терапии 01.04.2017 развился тромбоз двух сегментов большой подкожной вены справа (проксимальная треть голени справа, средняя и проксимальная треть бедра справа). С 12.04.2017 начата антикоагулянтная терапия: эноксапарин натрия 0,6 мл 2 раза в сутки подкожно. Пациентка повторно консультирована гематологом, подтвержден диагноз генетической тромбофилии (гетерозиготы F2 [протромбин], MTHFR).
С учетом крайне высокого риска тромботических осложнений, превышающего риск кровотечений, рекомендовано продолжить терапию низкомолекулярным гепарином до конца беременности (отмена в I периоде родов или за 8–12 часов до планового оперативного родоразрешения) и 6–8 недель после родов. В июне 2017 г. пациентка госпитализирована в ПСПбГМУ им. И.П. Павлова в отделение акушерства и гинекологии. На фоне отмены эноксапарина натрия 15.06.2017 выполнено плановое родоразрешение, операция кесарево сечения. 16.06.2017 возникли эпизод онемения в левой руке, нарушение речи, длившиеся около 30 минут. При мультиспиральной компьютерной томографии головы от 17.06.2017 патологических изменений в зоне сканирования не выявлено. Пациентка выписана 20.06.2017 в связи с отказом от дальнейшей госпитализации. В течение 3 недель получала эноксапарин натрия, затем самостоятельно отменила препарат. В течение двух лет чувствовала себя удовлетворительно, в дальнейшем не обследовалась, у гематолога не наблюдалась.
Девятого октября 2019 г. на фоне благополучия внезапно появилось онемение левой половины тела и лица, выпадение левых полей зрения. В экстренном порядке госпитализирована в неврологическое отделение ГМПБ № 2.
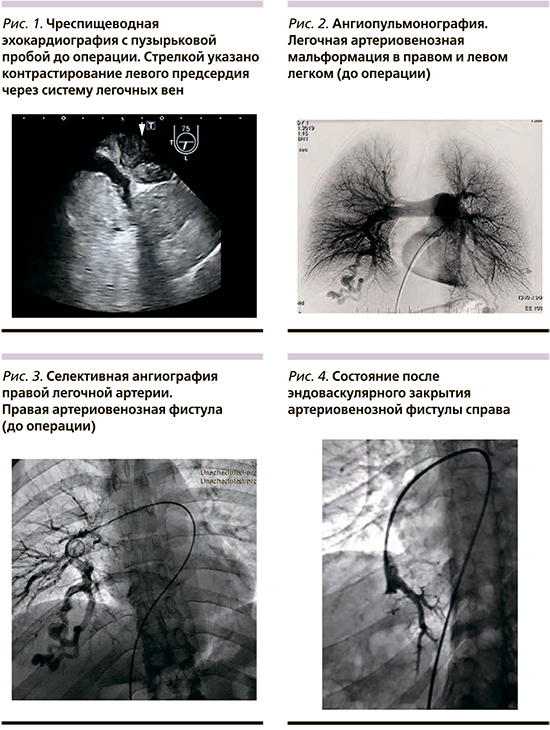
По данным МРТ головного мозга, подтвержден диагноз ОНМК по ишемическому типу в бассейне правой задней мозговой артерии. С целью верификации кардиоэмболического генеза инсульта 22.10.2019 выполнена чреспищеводная эхокардиография с пузырьковой пробой. При контрастировании правых камер зафиксировано попадание массы контраста в левое предсердие через легочные вены как при пробе Вальсальвы, так и в покое (рис. 1). Убедительных данных за функционирующее открытое овальное окно не получено. Пациентка выписана с рекомендацией приема комбинации антикоагулянта (дабигатран этексилат 150 мг 2 раза в сутки) и антиагреганта (ацетилсалциловая кислота 100 мг/сут), проведения ангиопульмонографии. Ангиопульмонография выполнена 25.11.2019, выявлена артериовенозная мальформация. В нижних долях обоих легких контрастированы легочные артериовенозные фистулы (более крупная артериовенозная мальформация в нижней доле правого легкого) со сбросом в левое предсердие (рис. 2, 3). С учетом полученных данных рекомендовано эндоваскулярное закрытие фистул. В январе 2020 г. пациентка консультирована гематологом, рекомендована отмена антиагрегантов, продолжение приема дабигатрана этексилата до хирургического лечения и 6–12 месяцев после. В марте 2020 г. больная госпитализирована в плановом порядке для выполнения эндоваскулярного закрытия легочной артериовенозной фистулы.
Из анамнеза жизни: пациентка А. росла и развивалась в соответствии с возрастом. Привычных интоксикаций нет. Гинекологический анамнез: менархе в 13 лет, цикл регулярный 28 дней, менструации 5 дней. Беременностей 5, родов 4, выкидыш 1 (на сроке 6 недель, гистология не проводилась). Беременности протекали с частыми носовыми кровотечениями, в остальном без особенностей. Все роды срочные, самостоятельные, четвертая беременность – оперативное родоразрешение путем кесарева сечения. Контрацептивы не принимала. Препаратов, содержащих эстроген, не принимала. Наследственность отягощена по тромботическим событиям: у отца – тромбофлебит глубоких вен нижних конечностей, эпизоды тромбозов неизвестной давности в сосудах нижней конечности, тромбэктомия из сосудов верхней конечности в 2017 г. Сестра перенесла транзиторную ишемическую атаку в 36 лет. Аллергологический анамнез: спокойный.
Объективный осмотр: состояние удовлетворительное, сознание ясное, кожные покровы обычного цвета, нормальной влажности, периферических отеков нет. Пульс – 75 ударов в минуту ритмичный, симметричный, удовлетворительного наполнения и напряжения. Артериальное давление – 110/80 мм рт.ст. Верхушечный толчок не пальпируется. Границы абсолютной и относительной сердечной тупости в норме. Тоны сердца ясные, звучные, ритмичные. Грудная клетка не деформирована, при пальпации безболезненная. Частота дыхания – 16 в минуту. При сравнительной перкуссии легких: над всеми полями ясный легочный звук. При аускультации дыхание везикулярное, хрипов нет. Язык влажный, зев чистый. Живот при пальпации мягкий, безболезненный. Печень при пальпации безболезненная, не выступает из-под края реберной дуги. Селезенка не увеличена. Поколачивание по поясничной области безболезненное. Физиологические отправления в норме.
В марте 2020 г. выполнено эндоваскулярное закрытие правой артериовенозной фистулы (окклюдер Amplatzer Vascular Plug II) с удовлетворительным гемодинамическим результатом (рис. 4). По данным контрольной эхокардиографии сохраняется сброс в левое предсердие, планируется закрытие артериовенозной фистулы слева. Рекомендовано продолжение антикоагулянтой терапии до завершения хирургического лечения и в течение года после.
Обсуждение
Данный клинический случай демонстрирует сочетание двух редких причин инсульта у молодой пациентки: наследственной тромбофилии (мутация в гене протромбина) и легочной артериовенозной мальформации.
В настоящее время под тромбофилией понимается состояние, характеризующееся повышенной склонностью к тромбообразованию, в основе которого лежат приобретенные и генетически обусловленные нарушения гемостаза и гемореологии [8]. Не все генетические нарушения строго ассоциированы с развитием тромбозов. Наследственные дефекты подразделяются на устойчивые изменения генотипа (мутации) и т.н. полиморфизмы генов, широко распространенные в популяции и не всегда проявляющиеся фенотипически. Мутация в гене протромбина (G20210A) относится к установленным генетическим факторам и является второй по частоте встречаемости среди наследственных тромбофилий [2, 5]. Частота мутации FII G20210A в европеоидной популяции составляет от 1 до 2% [3, 4], у пациентов с диагностированными эпизодами тромбоза – от 4 до 7% [3, 5]. Появление мутации FII гена протромбина ассоциируется с такими заболеваниями, как тромбоз, тромбоэмболия, ишемический инсульт [9]. При наличии мутации G20210A повышается экспрессия гена и в дальнейшем увеличивается количество химически нормального протромбина. Уровень протромбина может повышаться в 1,5–2,5 раза [10]. Протромбин присутствует в неактивной форме в плазме крови, он же является предшественником тромбина. Тромбин способствует преобразованию фибриногена в фибрин и дальнейшему образованию фибринового тромба. Генетический дефект может предполагаться при развитии тромботических событий у пациентов молодого возраста и отсутствии дополнительных предрасполагающих факторов, таких как оперативное вмешательство, иммобилизация, прием эстрогенсодержащих контрацептивов [8].
В анамнезе у пациентки данные факторы не были выявлены. Одним из провоцирующих факторов для фенотипического проявления генетических дефектов является беременность. Принято считать, что к первоочередным процессам, стимулирующим образование тромбов, относятся стаз, изменение качественных и количественных характеристик плазменных факторов свертываемости, повреждение эндотелия сосудов [11]. Все эти факторы, способствующие тромбообразованию, проявляются во время беременности. На стадии оплодотворения в процессе имплантации эмбриона происходит нарушение эндотелия маточных сосудов, также массивное повреждение наблюдается при самих родах. В процессе беременности отмечается нарастание концентрации прокоагулянтных факторов (II, VII, VIII, X, фактора Виллебранда) и снижение активности естественных антикоагулянтов – протеина C, протеина S и антитромбина III [10]. Поэтому при беременности повышается риск тромбозов, который еще выше у женщин с наследственными тромбофилиями. У нашей пациентки первые тромботические события (ОНМК, тромбоз вен нижней конечности, транзиторная ишемическая атака – ТИА) произошли во время беременности. Сочетание наследственного дефекта, наличие рецидивирующих тромботических событий (тромбоз вен нижней конечности, повторные ОНМК, ТИА), а также семейный анамнез (ТИА у сестры, тромбофлебит и артериальный тромбоз у отца) обосновывают диагноз наследственной тромбофилии [12].
Одной из возможных причин тромбофилии может быть мутация гена С677T метилентетрагидрофолатредуктазы, приводящая к нарушениям фолатного цикла и последующей гипергомоцистеинемии [9, 13]. При уровне гомоцистеина в плазме выше 15 ммоль/л следует заподозрить генетический дефект [14].
У пациентки уровень гомоцистеина был в пределах референсных значений.
Таким образом, обнаруженная мутация гена С677T метилентетрагидрофолатредуктазы может быть отнесена к полиморфизмам и не имеет значения в патогенезе заболевания.
Наиболее частыми фенотипическими проявлениями наследственных дефектов являются венозные тромбозы, однако не исключено, что источником тромба может быть и артериальное русло. В анамнезе нашей пациентки повторные инсульты и ТИА. Несбалансированная активация тромбина у лиц с наследственной тромбофилией может способствовать формированию и прогрессированию атеросклеротических поражений по различным механизмам, включая активацию тромбоцитов, дисрегуляцию эндотелиальных и сосудистых гладкомышечных клеток, а также привлечение моноцитов и макрофагов [15]. При рассмотрении вопроса этиологии ишемического инсульта мы считали, что источником тромба могут быть сосуды венозного русла. В случае образования тромбов в венах для осуществления механизма парадоксальной эмболии необходимо наличие шунта между венозной и артериальной системами. Таким шунтом может служить дефект межпредсердной перегородки или артериовенозная мальформация [6]. Данные ангиопульмонографии подтвердили наличие двусторонней артериовенозной легочной мальформации. Легочные артериовенозные мальформации могут протекать бессимптомно, а также проявляться в виде одышки, легочных кровотечений различной выраженности и неврологическими нарушениями вследствие парадоксальной тромбоэмболии [7]. Кроме того, артериовенозные шунты сами по себе могут служить источником турбулентных токов и провоцировать тромбогенез. С учетом вышесказанного было принято решение о поэтапном эндоваскулярном закрытии артериовенозных фистул, а также рекомендована антикоагулянтная терапия до проведения хирургического лечения и в течение года после. Рекомендовано генетическое обследование детей по достижении ими подросткового возраста.
Заключение
Таким образом, проведение дифференциальной диагностики причин множественных тромботических событий у молодой женщины позволило определить индивидуальные факторы риска и тактику лечения. Выполненное хирургическое лечение позволило кардинально снизить риски повторных нарушений мозгового кровообращения. Выявление наследственных нарушений не только определило возможности вторичной профилактики заболевания у пациентки, но и динамическое наблюдение за детьми и проведение у них первичной профилактики.
Дополнительная информация. Информированное согласие пациента отсутствует.


