Введение
Подагра является наиболее часто встречающимся воспалительным артритом у взрослых [1], распространенность которого продолжает увеличиваться в течение последних десятилетий [2, 3].
Основная цель лечения подагры – это достижение и длительное поддержание целевого уровня мочевой кислоты (МК) путем применения как медикаментозных, так и немедикаментозных методов терапии. И хотя основополагающие принципы терапии подагры остаются незыблемыми на протяжении последних десятилетий, развитие медицины и накопленный клинический опыт предполагают необходимость постоянной коррекции существующих рекомендаций.
В статье освещаются некоторый спорные вопросы терапии подагры, обсуждаемые в последние годы.
Применение уратснижающей терапии во время острого приступа артрита
Вопрос, когда следует назначать терапию, никогда в литературе широко не обсуждался, тем не менее по устоявшемуся мнению считается, что инициировать прием уратснижающих препаратов следует только после полного купирования артрита, а лучше спустя 2 недели [4]. Схожий принцип представлен в Португальских рекомендациях по лечению и диагностике подагры [5]. Однако подобная тактика зачастую приводит к неудовлетворительному результату. Во-первых, после стихания обострения пациенты, обученные самостоятельно принимать противовоспалительные препараты для купирования последующих приступов артрита, зачастую пренебрегают необходимостью повторных визитов к врачу и уратснижающая терапия просто не будет назначена; а во-вторых, получив информацию о eе негативном влиянии на течение текущего артрита, пациенты в будущем склонны отменять уратснижающие препараты во время возникновения подобных приступов либо вовсе избегать их приема [6, 7].
Обновленные рекомендации Европейской антиревматической лиги, упоминая о проблеме, указывают, что данных для принятия конкретного решения о сроках начала уратснижающей терапии пока недостаточно [8]. Это не совсем верно. Так, последние исследования позволяют относиться к необходимости выдерживать паузу при назначении уратснижающих препаратов скептически. В рандомизированное двойное слепое плацебо-контролируемое одноцентровое исследование T.H. Taylor et al. были включены 57 пациентов с острым приступом подагрического артрита, рандомизированных в 2 группы: принимавших аллопуринол в стартовой дозе 300 мг/сут или плацебо. Всем пациентам с целью купирования артрита назначался индометацин 50 мг 3 раза в сутки в течение 10 дней с последующим назначением колхицина 0,6 мг 2 раза в сутки на 90 дней для профилактики приступов.
С 11-го дня наблюдения все пациенты из 2-й групп также получали аллопуринол; с того момента исследование было открытым. При анализе среднесуточной интенсивности боли по визуальной аналоговой шкале (ВАШ) по 10-балльной шкале в первые 10 дней наблюдения даже минимальных различий в группах получено не было, более того, к концу наблюдения средние значения интенсивности боли в группе аллопуринола были даже чуть меньше (0,18 мм в группе аллопуринола против 0,27 мм в группе плацебо; p=0,54). Дальнейшее 3-месячное наблюдение не зафиксировало и различий в частоте острых приступов, зарегистрированных у 2 пациентов, принимавших аллопуринол, и у 3 пациентов, принимавших плацебо (p=0,6). Таким образом, применение аллопуринола во время острого приступа подагры не отождествлялось ни с усилением интенсивности боли во время текущего приступа, ни с увеличением частоты рецидивов вспышек по сравнению с пациентами, которым аллопуринол был назначен после купирования артрита [9]. В схожем плацебо-контролируемом исследовании показано, что применение аллопуринола во время острого приступа не влияло не только на интенсивности боли, но и на длительность текущего обострения [10]. Данный факт особенно важен с учетом того, что время, потраченное на купирование артрита, может существенно отодвигать сроки начала уратснижающей терапии. Интересно, что не было различий в средних значениях сывороточного уровня МК между группами аллопуринола и плацебо ни через 14 дней (в течение этого времени доза аллопуринола составляла 100 мг/сут), ни через 28 дней (доза аллопуринола – 200 мг/сут). Вероятно, медленное титрование дозы препарата не приводит к резким колебаниям уровня МК сыворотки, тем самым снижая риск обострений артрита.
Подобного мнения о необходимости приема уратснижающих препаратов, не дожидаясь купирования острого приступа артрита, поддерживают и сами пациенты, аргументируя это возможностью скорейшего контроля подагры путем максимально быстрого достижения уровня МК сыворотки [11]. Тем не менее при наличии у пациента опасений, связанных с применением препаратов во время приступа, рационально отложить инициацию уратснижающей терапии до его разрешения.
Применение сопутствующей профилактической противовоспалительной терапии
Известно, что прием любых средств, снижающих сывороточный уровень МК, независимо от их механизма действия (аллопуринол, фебуксостат, пегуриказа, бензобромарон) связан с нарастанием частоты приступов артрита в первые месяцы такой терапии [12]. В то же время применение симптоматической противовоспалительной терапии путем длительного применения нестероидных противовоспалительных средств (НВПС), колхицина или глюкокортикостероидов (ГКС) позволяет снижать риск развития обострения во время инициации и подбора дозы уратснижающих препаратов [13, 14]. Основной обсуждаемый вопрос – какие конкретно препараты лучше использовать для этой цели.
Наиболее популярны рекомендации Европейской антиревматической лиги, где выбор конкретного препарата для профилактики приступов артрита остается на усмотрение врача и включает назначение колхицина в низких дозах или НВПС (также в минимально эффективной противовоспалительной дозе, при необходимости – с гастропротективной терапией) [8].
Более широкий перечень препаратов предложен в последних рекомендациях Американской коллегии ревматологов, где в случае наличия противопоказаний к применению НВПС и колхицина стоит рассмотреть возможность назначения и низких доз ГКС [11].
Контрастируют с ними рекомендации французских ревматологов, которые ограничиваются применением для профилактики приступов артрита только низких доз колхицина [15].
С одной стороны, колхицин действительно наиболее полно изучен в отношении способности снижать вероятность приступов артрита при инициации уратснижающей терапии и даже при высокой стоимости экономически целесообразен, по данным исследования P.C. Robinson et al. [16].
Тем не менее назначать оптимальную дозу колхицина возможно далеко не всегда, особенно пациентам с наличием хронической болезни почек (ХБП), препарат не всегда хорошо переносится с учетом возникновения тошноты и диареи, а при совместном приеме с ингибиторами ГМГ-КоА редуктазы, фибратами, верапамилом, дилтиаземом, кларитромиционом и др. может увеличивать риск развития острой миопатии и апластической анемии, особенно в пожилом возрасте [17–19].
В любом случае выбор конкретного препарата должен быть осознанным и обоснованным. В ФГБНУ НИИР им. В.А. Насоновой проводится проспективное исследование, цель которого – сравненить эффективность и безопасность различных противовоспалительных препаратов, используемых в качестве профилактики приступов артрита. Осуществляется динамическое обследование 97 пациентов с подагрой на протяжении 24 недель, включившее непрерывное применение комбинированной уратснижающей и профилактической противовоспалительной терапии.
При инициации уратснижающей терапии назначен аллопуринол по 100 мг/сут с последующим титрованием дозы до достижения целевого уровня МК, который определялся как <360 мкмоль/л для всех пациентов либо <300 мкмоль/л для больных тяжелой тофусной подагрой. Особенностью исследования было применение аллопуринола и фебуксостата в максимально допустимых дозах, строго исходя из существующих национальных клинических рекомендаций.
Назначение противовоспалительной терапии проводилось согласно алгоритму, представленному на рисунке.
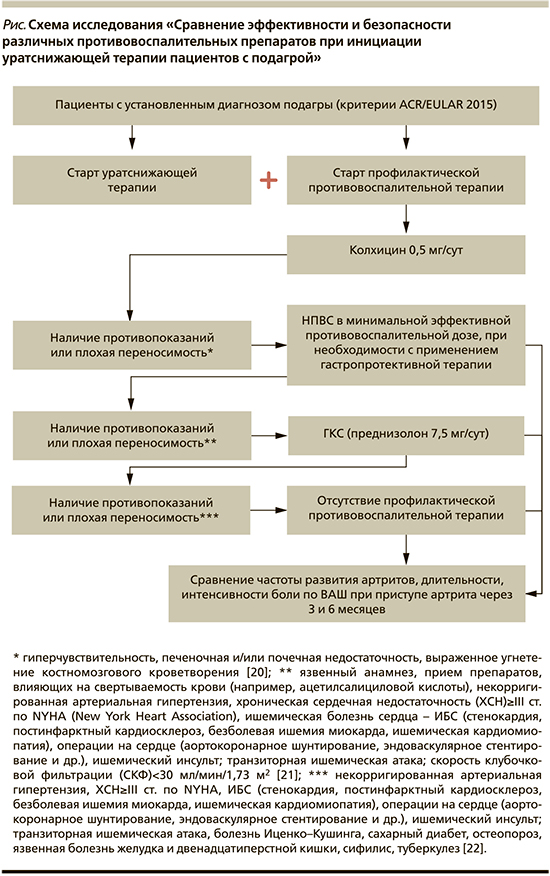
Противовоспалительная терапия проводилась исходя из предложенного авторами алгоритма, включившего последовательное применение колхицина 0,5 мг/сут, в случае наличия противопоказаний и/или плохой переносимости – НВПС в минимально эффективной противовоспалительной дозе, при их непереносимости или наличии противопоказаний – ГКС (преднизолон 7,5 мг/сут).
В результате лишь 12% пациентов не могли получать профилактическую противовоспалительную терапию, при этом среди них вероятность развития острого приступа артрита была в 2,5 раза выше, чем у тех, кто принимал вышеперечисленные препараты (75 против 35% соответственно; р=0,008).
При сравнении отдельных групп противовоспалительных препаратов НВПС оказались достоверно более эффективными, чем колхицин и ГКС в отношении частоты развития приступов артрита и их длительности (р<0,05 в обоих случаях), а интенсивность боли по ВАШ через 6 месяцев наблюдения достоверно не различалась между группами (НВПС, ГКС, колхицин).
Не было существенных различий между разными группами противовоспалительных препаратов в частоте развития побочных эффектов, что согласуется с результатами схожих исследований [19, 23].
Выбор уратснижающей терапии
В Российской Федерации (РФ) на настоящий момент зарегистрировано всего два препарата для лечения подагры, оба относятся к ингибиторам ксантиноксидазы, но даже при столь малом выборе принципы назначения этих двух препаратов в различных международных и национальных рекомендациях разнятся.
Первыми рекомендациями, в которых обсуждена возможность назначения фебуксостата, были рекомендации Американской коллегии ревматологов, опубликованные в 2012 г., где решение о выборе конкретного препарата – аллопуринола или фебуксостата – полагалось принимать индивидуально [24]. В 2018 г. в рандомизированном проспективном многоцентровом исследовании CARES (Gout and Cardiovascular Morbidities) выявлены более высокие показатели сердечно-сосудистой и общей смертности среди пациентов с подагрой, принимавших фебуксостат, по сравнению с аллопуринолом [25]. Однако ряд обсуждаемых проблем наряду с результатами методологических ограничений работы не позволяют сделать однозначного вывода о преимуществах аллопуринола [26–28], а в нескольких других исследованиях не нашли каких-либо отличий в отношении сердечно-сосудистой безопасности препаратов [29, 30]. Например, в исследовании J. Foody et al. была проанализирована частота сердечно-сосудистых исходов у больных подагрой с наличием сердечно-сосудистых заболеваний и ХБП, принимавших аллопуринол и фебуксостат [31]. Так, частота неблагоприятных сердечно-сосудистых исходов у пациентов с подагрой и ХБП или сердечно-сосудистыми заболеваниями, включая ИБС, цереброваскулярную болезнь, заболевания периферических сосудов и ХСН, при приеме фебуксостата была почти в 1,5 раза меньше, чем у пациентов, принимавших аллопуринол, и различия были достоверными.
Если исходно предполагалось максимально лимитировать применение фебуксостата вплоть до запрета его использования [32], то на сегодняшний день отношение к препарату стало меняться в обратную сторону. Так, в соответствии с последними рекомендациями Американской коллегии ревматологов (ACR – American College of Rheumatology) аллопуринол следует назначать всем пациентам, включая больных ХБП средней и тяжелой степеней тяжести (стадия ≥3), тем не менее даже при наличии сердечно-сосудистой патологии назначение фебуксостата не рекомендуется лишь «условно» [11].
Еще более широкая ниша применения фебуксостата пациентами с подагрой определяется в рекомендациях Французского ревматологического общества, где его применение оправданно в случае снижения рСКФ <60 мл/мин/1,73 м2 при условии отсутствия у пациента тяжелой сердечно-сосудистой патологии, а при рСКФ<30 мл/мин/1,73 м2 его назначение по отношению к аллопуринолу приоритетно [15].
X. Liu et al. было проведено проспективное исследование, включившее пациентов с гиперурикемией и ХБП 3–5-й стадий, в котором оценивалась возможность достижения целевого уровня МК и функции почек [33]. Терапия фебуксостатом проводилась 112 пациентам и 96 – аллопуринолом. Через 6 месяцев терапии целевого уровня МК удалось достичь 96,4% пациентов, получавших фебуксостат, и 37,5% – аллопуринол, при этом рСКФ в группе фебуксостата увеличилась с 28,45 до 30,65 мл/мин/1,73 м2 и снизилась с 28,06 до 24,39 мл/мин/1,73 м2 у пациентов, принимавших аллопуринол.
Фебуксостат может применяться пациентами с подагрой и ХБП в дозах 80 и 120 мг/сут без необходимости их коррекции по уровню СКФ, а также с осторожностью при рСКФ<30 мл/мин/1,73 м2. Так, в исследовании S.H. Kim et al. показано, что фебуксостат имеет хороший профиль безопасности и эффективности у пациентов с подагрой 4–5-й стадий ХБП, которые еще не находятся на диализе [34].
В целом с учетом низкой стоимости, достаточной эффективности и хорошей переносимости аллопуринола, в т.ч. высоких доз препарата, не вызывает сомнений целесообразность его использования как препарата первой линии терапии. Тем не менее в отношении пациентов с наличием тяжелой ХБП применение фебуксостата представляется более предпочтительным. Подобный подход предполагается применять на практике, исходя из отечественных рекомендаций [35].
Применение ингибиторов интерлейкина-1 (ИЛ-1)
С одной стороны, применение ингибиторов ИЛ-1 уже на протяжении почти 10 лет рассматривается в качестве одного из компонентов терапии острого приступа артрита, тем не менее до сих пор возможность их реального применения достаточно скромна, т.к. во многих странах они или не зарегистрированы, или подагра не упоминается в качестве показаний к их применению. Рекомендации ACR и EULAR (European League Against Rheumatism) предполагают использование ингибиторов ИЛ-1 исключительно с целью купирования острого приступа артрита [8,11], однако отечественный вариант клинических рекомендаций рассматривает возможность их назначения пациентам с хронической тяжелой подагрой и в качестве метода профилактики обострений артрита [35].
В исследовании N. Schlesinger et al. проведено сравнение эффективности различных доз канакинумаба (25 мг, 50, 100, 200 или 300 мг) и колхицина 0,5 мг/сут [36]. Через 16 недель наблюдалось снижение частоты развития приступов артрита в среднем на 67% у пациентов, принимавших канакинумаб ≥50 мг, по сравнению с колхицином на основе отрицательной биномиальной модели (соотношение частот: 0,28–0,38; р≤0,0083), а риск возникновения хотя бы одного приступа артрита был ниже на 64–72%.
D. Solomon et al. сравнивали частоту развития приступов артрита при применении уратснижающих препаратов пациентами с различной исходной концентрацией МК в сыворотке крови (≤404,5 мкмоль/л, 404,6–535,3 и ≥535,4 мкмоль/л) [37]. В качестве терапии назначался канакинумаб (50 мг или 150 или 300 мг в виде подкожных инъекций), который вводился каждые 3 месяца, длительность наблюдения составила почти 4 года. Ежеквартальное введение канакинумаба ассоциировалось со значительным снижением риска развития приступов подагры, причем независимо от изменений уровня МК в сыворотке крови.
Крупное постмаркетинговое исследование было проведено и в нашей стране [38]. Двадцати пациентам с острым артритом и неэффективностью ранее проведенной противовоспалительной терапии был назначен канакинумаб подкожно в дозе 150 мг. В течение последующих 4 месяцев проводилось титрование дозы аллопуринола, при этом целевой уровень МК был достигнут 85% пациентов, приступы артрита были крайне редкими и дополнительная симптоматическая терапия потребовалась только 15% пациентов. Более того, ретроспективный анализ через 5 лет показал, что вероятность поддержания целевого уровня МК при приеме уратснижающих препаратов пациентами, ранее получавшими канакинумаб, была выше, чем у тех, кто получал стандартную противовоспалительную терапию (75 против 20% соответственно; р=0,005) [39].
Хотя данную группу препаратов продолжают рассматривать в качестве «терапии отчаяния» со стороны пациентов с наиболее тяжелым течением подагры и наличием противопоказаний к иной симптоматической терапии заболевания, как наличие высокой эффективности, так и профилактическое действие в отношении сердечно-сосудистых исходов [40] предполагает большой потенциал их практического использования.
Диетотерапия
Роль диетотерапии в лечении подагры пересматривается. Если раньше, например, в рекомендациях Европейской антиревматической лиги образ жизни и диета были под первым пунктом и преподносились как основополагающая составляющая успешного лечения подагры [41], то сейчас в обновленных рекомендациях ACR или Междисциплинарного консенсуса по лечению подагры и гиперурикемии Тайваня, ограничение потребления тех или иных продуктов либо рекомендуется «условно» [11], либо просто признается факт низкой эффективности изменения диеты и приоритета лекарственной терапии [42].
В исследовании T.J. Major et al. показано, что генетические изменения имеют гораздо большее значение в развитии гиперурикемии, чем воздействие диеты, например одна единица пива повысила концентрацию сывороточного уровня МК всего на 0,16 мг/дл [43]. Хотя в другом исследовании показано, что потребление алкоголя, даже в умеренных количествах, увеличивает риск развития приступов артрита после употребления, причем независимо от вида алкогольного напитка [44].
Нерациональным признано и использование для снижения уровня МК сыворотки и витамина С. В исследовании L.K. Stamp et al. показано что применение пациентами с подагрой витамина С 500 мг/сут в течение 8 недель не оказывало значимого уратснижающего эффекта, несмотря на то что уровень аскорбата в плазме крови повышался [45].
Многие исследования, посвященные изменению сывороточного уровня МК в зависимости от снижения индекса массы тела (ИМТ), также не выявили значимых изменений [46, 47]. В то же время показано, что увеличение ИМТ более чем на 5% связано с более высоким риском рецидива острого артрита на 60%, а снижение ИМТ>5% с более низким – на 40% по сравнению с теми, у кого ИМТ не менялся [48]. По результатам длительного ретроспективного анализа клинических проявлений у пациентов с подагрой изолированное соблюдение диеты вне приема уратснижающих препаратов не приводило к достижению целевого уровня МК сыворотки ни в одном из 18 случаев, хотя среднее значение массы тела снизилось [6].
В рекомендациях ACR среди прочих постулатов сформулировали и условно «неофициальные» рекомендации, одна из которых призывает избегать формирования у пациентов чувства вины из-за неоптимального образа жизни и связанной с ним стигматизации. Необходимо быть предельно внимательными при опросе пациента о его пищевых привычках: пациент не должен чувствовать даже минимального «обвинения» и осуждения со стороны врача. В то же время необходимо донести до пациента, что, хотя коррекция диеты и приводит лишь к минимальному снижению уровня МК, ее нарушение может служить фактором риска приступов артрита [11].
Таким образом, можно говорить о смещении данного вектора лечения подагры: диетотерапия может приводить лишь к незначительному снижению сывороточного уровня МК, ее основная цель – снижение частоты обострений артрита.
Заключение
Таким образом, согласно современным представлениям, обобщенно можно сформулировать несколько предлагаемых позиций в лечении подагры, отличных от канонических.
Всем пациентам с установленным диагнозом подагры необходимо назначать уратснижающие препараты с целью достижения целевого уровня МК, что стоит инициировать, не дожидаясь 14-дневного периода после стихания обострения.
Аллопуринол по-прежнему следует рассматривать как препарат первой линии уратснижающей терапии, но в случае наличия у пациента ХБП предпочтительнее назначать фебуксостат.
Профилактику приступов артрита стоит проводить путем применения колхицина, НПВС или ГКС, рассматривая возможность применения каждого в указанной последовательности, и, возможно, в случае наличия противопоказаний и неэффективности этих препаратов стоит рассматривать применение ингибиторов ИЛ-1 по крайней мере пациентами с тяжелым течением подагры.
Диетотерапия является исключительно вспомогательным методом, помогающим снижать вероятность обострения артрита, но не должна рассматриваться как действенное средство борьбы с гиперурикемией.
Конфликт интересов. Работа выполнена в рамках прикладного научного исследования «Технология применения различных противовоспалительных для профилактики приступов артрита при назначении уратснижающей терапии у больных подагрой» (№ 2020-397-007). Авторы не получали гонорар за статью. М.С. Елисеев подтверждает, что получает гонорары за чтение лекций.


