Введение
Последнее двадцатилетие в диабетологии внесло революционные изменения как в понимание патогенетических механизмов сахарного диабета 2 типа (СД2), так и в развитие новых направлений в его лечении. В рутинную клиническую практику эндокринологов всех стран мира пришла целая группа инновационных лекарственных средств – беспиковых аналогов инсулинов длительного действия, а также антидиабетических препаратов инкретиннаправленного действия – агонистов рецептора глюкагоноподобного пептида-1 (арГПП-1). Последние обладают рядом плейотропных эффектов, прежде всего улучшением глюкозозависимой секреции инсулина β-клетками, а также подавлением секреторной активности α-клеток с нивелированием гиперглюкагонемии. Доказано, что дисфункция α-клеток островков Лангерганса сопровождается неоправданно высокой секрецией глюкагона при СД2, что вносит значимый вклад в формирование хронической гипергликемии [1–4].
Прогрессирование снижения секреции инсулина β-клетками при СД2, к сожалению, идет неуклонно, что в значительной степени формирует увеличение гипергликемии натощак. Так, результаты Британского проспективного исследования по изучению СД (UKPDS) показывают, что спустя 10–12 лет от момента диагностики заболевания уже 80% пациентов нуждаются в лечении инсулином в первую очередь длительного действия [5].
В настоящее время предполагается, что именно ГПП-1 может способствовать снижению процессов апоптоза и увеличению массы β-клеток, стимулируя их регенеративный потенциал [6].
Одним из перспективных и эффективных терапевтических подходов является комбинация с фиксированным соотношением арГПП-1 и базального инсулина. Фиксированная комбинация используется в клинической практике с 2016 г. В консенсусе ADA/EASD (Американской диабетической ассоциации/Европейской ассоциации по изучению диабета) от 2018 г. по управлению СД2 указана позиция в лечебной тактике комбинации базального инсулина и арГПП-1, а также потенциальные преимущества фиксированной комбинации по сравнению с раздельным применением базального инсулина и арГПП-1, включая уменьшение числа суточных инъекций [7].
Клинический опыт ведения пациентов показывает, что сочетание препаратов с фиксированным соотношением имеет несколько преимуществ по сравнению с раздельным введением компонентов, прежде всего с удобной схемой дозирования для пациента и врача, уменьшением числа инъекций, более легким титрованием и более низкими дозами арГПП-1. Кроме того, показано, что титрование фиксированной комбинации улучшает желудочно-кишечную переносимость вследствие более медленной титрации по сравнению с введением арГПП-1 отдельно [8].
Возможность старта инсулинотерапии с фиксированной комбинацией базального инсулина и арГПП-1 прописана и в российских клинических рекомендациях [9]. В 2018 г. в Российской Федерации была зарегистрирована фиксированная комбинация инсулина гларгин 100 ЕД/мл и ликсисенатида* [10]. Данный препарат представлен в лекарственной форме раствора для подкожного введения. Имеет две формы выпуска: шприц-ручка с концентрацией инсулина гларгин 100 Ед/мл и 50 мкг/мл ликсисенатида в 1 мл для подкожного введения и шприц-ручка с концентрацией инсулина гларгин 100 ЕД/мл и 33 мкг/мл ликсисенатида в 1 мл для подкожного введения [10].
Как показало рандомизированное многоцентровое клиническое исследование LixiLan-O, оценивавшее параметры эффективности и безопасности применения фиксированной комбинации гларгина и ликсисенатида для пациентов, которые ранее не достигали целей терапии на пероральных сахароснижающих препаратах, применение комбинации позволяет достигать более выраженного (p<0,0001) снижения уровня гликированного гемоглобина (HbA1c), чем при применении только гларгина или только ликсисенатида [11]. Немаловажно отметить, что указанная бóльшая эффективность не сопровождалась увеличением риска гипогликемий по сравнению с базальным инсулином: частота возникновения подтвержденных симптоматических гипогликемий (≤3,9 ммоль/л) была одинаковой в группах фиксированной комбинации и гларгина (1,4 и 1,2 случая/пациенто-год соответственно) [11].
Особый интерес (особенно в контексте представленных ниже двух клинических случаев) вызывают результаты субанализа исследования LixiLan-O, оценивавшего параметры эффективности и безопасности применения фиксированной комбинации гларгина и ликсисенатида для пациентов, имевших исходный уровень HbA1c≥9%. Данный анализ показал более выраженное (p<0,05) снижение средних значений HbA1c к 30-й неделе в группе пациентов, получавших фиксированную комбинацию (-2,9%), чем в группах лечения инсулином гларгин (-2,5%) и ликсисенатидом (-1,7%) [12].
Исследование LixiLan-O и его субанализ у пациентов с исходным уровнем HbA1c≥9% показало, что фиксированная комбинация инсулина гларгин и арГПП-1 ликсисенатида позволяет 74% пациентов, ранее не достигших целей терапии при применении таблетированных сахароснижающих препаратов, достигать уровня HbA1c менее 7% вне зависимости от исходного уровня HbA1c [11, 12].
Представляем собственные клинические наблюдения.
Клинический случай 1
Пациент М. 53 лет работает инженером по технике безопасности. В возрасте 45 лет при прохождении медицинского осмотра (8 лет назад) диагностирован СД2. Имеет избыточную массу тела. Вредные привычки: курит (10–12 сигарет в день), алкоголь употребляет умеренно. Семейный анамнез: СД2 у матери. Артериальная гипертензия в течение 8 лет, получает антигипертензивную и гиполипидемическую терапию.
В течение 3 лет от начала СД получал терапию метформином 2000 мг/сут, затем был назначен гликлазид модифицированного высвобождения (МВ) 60 мг/сут с постепенной титрацией дозы до 120 мг/сут. Тем не менее уровень HbA1c, несмотря на коррекцию дозы комбинированной сахароснижающей терапии, возрастал. Так, в марте 2016 г. он составил 8,2%, в декабре того же года – 8,8%, в июле 2017 г. – 9,2%, в декабре 2018 г. – 9,5%. Пациент был направлен на стационарное лечение.
В течение 6 месяцев, предшествовавших поступлению в стационар, у пациента отмечались сухость во рту, нарастание общей слабости, постепенное снижение массы тела на 3 кг при неизмененном характере питания, при самоконтроле глюкоза натощак от 9 до 13 ммоль/л, чувство ползания «мурашек» в стопах. При поступлении рост – 178 см, масса тела – 89 кг, индекс массы тела (ИМТ) – 28 кг/м2. Гликемия натощак от 10,2 до 13,8 ммоль/л, постпрандиально от 14,5 до 15,6 ммоль/л; HbA1c – 9,5%; С-пептид базальный – 0,7 нмоль/л (норма – 0,16–1,2 нмоль/л), через 120 минут после изокалорийного завтрака (660 ккал) – 0,7 нмоль/л.
В общем анализе крови – без изменений. Креатинин плазмы – 0,08 ммоль/л, скорость клубочковой фильтрации (СКФ) по CKD-EPI – 72,53 мл/мин/1,73 м2. В связи с наличием лабораторных признаков мочевой инфекции у пациента на момент обследования принято решение о проведении исследования альбуминурии после проведения соответствующего лечения.
Клинический диагноз: основной – СД2, индивидуальный целевой уровень HbA1c<7,0%. Осложнения: диабетическая сенсомоторная полиневропатия, дистальный тип. Диабетическая непролиферативная ретинопатия обоих глаз. Сопутствовавшие заболевания: Избыточная масса тела (ИМТ – –28 кг/м2). Гипертоническая болезнь 3-й степени, 4 группы риска (мужской пол, наследственность, СД2, дислипидемия), хроническая сердечная недостаточность (ХСН) – 1, функциональный класс (ФК) – 1. Дислипидемия. Гипертонический артериолосклероз, неполная осложненная катаракта, гиперметропия 1-й степени, сложный гиперметропический астигматизм обоих глаз. Хроническая мочевая инфекция, стадия обострения, хроническая болезнь почек С2.
Таким образом, у пациента отмечен длительный неудовлетворительный гликемический контроль на фоне комбинированной терапии метформином и гликлазидом МВ. Показатели гликемии в течение суток свидетельствовали о необходимости контроля гликемии как натощак, так и постпрандиально, высокий уровень HbA1c (9,5%) подтверждал необходимость инсулинотерапии. Пациент был готов обсуждать старт инсулинотерапии, но настаивал на использовании максимально простой схемы лечения с учетом характера его работы. Было принято решение начать терапию фиксированной комбинацией инсулина гларгин 100 ЕД/мл и ликсисенатида в виде инъекции 1 раз в сутки, продолжить терапию метформином 2500 мг/сут. Комбинация была назначена в соответствии с инструкцией в стартовой дозе 10 ЕД подкожно в течение часа перед ужином с последующей титрацией дозы препарата раз в 2–3 дня с шагом 2 ЕД. В индивидуальном порядке с пациентом проведены дополнительные обучающие мероприятия по оптимизации питания с соблюдением времени и кратности приема пищи, а также физической нагрузки не менее 3 раз в неделю продолжительностью 30–60 минут. Пациент был обучен технике инъекций инсулина, информирован о возможности гипогликемий. Результаты гликемии на фоне титрации препарата представлены ниже (табл. 1).
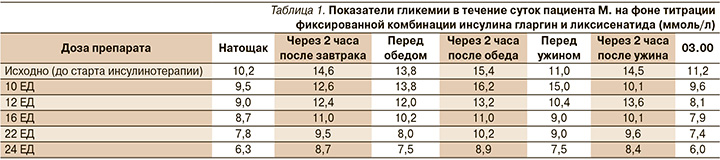
Диспепсических проявлений, гипогликемических состояний на фоне титрации препарата не отмечалось, обращала на себя внимание низкая вариабельность гликемии в течение суток. Пациент был выписан с дозой фиксированной комбинации инсулина и ликсисенатида 24 ЕД и метформина 2500 мг/сут на амбулаторный этап. С учетом показателей гликемии доза препарата была увеличена врачом-эндокринологом до 28 ЕД. Результаты самоконтроля с периодом наблюдения 11 месяцев (доза – 28 ЕД): гликемия натощак не превышала 7,2 ммоль/л, чаще находилась в диапазоне 6,0–6,5 ммоль/л, уровень глюкозы через 2 часа после приемов пищи не превышал 8 ммоль/л. В течение первого месяца после выписки из стационара пациент дважды отмечал в дневное время легкие гипогликемии (купировал приемом пищи). При анализе причин он отметил, что в одном случае гипогликемия была связана с недостатком приема углеводов на завтрак, в другом – с пропуском приема пищи в обед. Показатели HbA1c через 3 месяца после старта терапии фиксированной комбинацией инсулина гларгин и ликсисенатида – 7,5%, через 10 месяцев от старта терапии – 6,8%. Пациент придерживается рекомендованного питания, физическая активность увеличилась, за 11 месяцев наблюдения масса тела не значимо увеличилась на 1 кг. Пациент удовлетворен терапией, считает ее очень удобной и эффективной.
Клинический случай 2
Пациент И. 72 лет работает руководителем предприятия. В 2000 г. перенес острое нарушение мозгового крово-обращения (ОНМК) по ишемическому типу с положительной динамикой в ходе реабилитационных мероприятий. Вредные привычки: курит (10–12 сигарет в день), алкоголь употребляет умеренно. Семейный анамнез: СД2 у матери.
Болеет СД2 в течение 16 лет (с 56 лет). В 2004 г. были назначены диетические предписания, дозированные физические нагрузки, метформин 1000 мг 2 раза в сутки. Данную терапию принимал до 2014 г., регулярно не наблюдался. В том же году в связи с недостижением целевых показателей гликемического контроля назначен гликлазид МВ 30 мг с постепенной титрацией до 120 мг. В 2016 г. назначена тройная комбинированная терапия – метформин 2000 мг/сут, гликлазид МВ 120 мг/сут, вилдаглиптин 50 мг 2 раза в сутки. Постепенное ухудшение контроля гликемии с апреля 2019 г., но только в августе того же года обратился на амбулаторный прием к врачу-эндокринологу с жалобами на слабость, усиление сухости во рту, жажду. Рост – 176 см, масса тела – 94 кг, ИМТ – 30,3 кг/м2. Гликемия натощак от 12 до 14 ммоль/л, постпрандиальная от 16 до 18 ммоль/л; HbA1c – 10,2%; креатинин в плазме – 94 мкмоль/л, СКФ по CKD-EPI – 69,5 мл/мин/1,73 м2, альбуминурия в референсных значениях.
Клинический диагноз: основной – СД2, целевой уровень HbA1c<7,5%. Осложнения: диабетическая сенсомоторная полиневропатия, дистальный тип. Сопутствующие заболевания: гипертоническая болезнь 3-й стадии, 4 группы риска (мужской пол, возраст, дислипидемия, СД2, ОНМК в 2000 г.), ХСН-1 ФК-1. Избыточная масса тела, ИМТ – 28,09 кг/м2. Дислипидемия. Кисты обеих почек. Возрастная макулярная дегенерация, «влажная» форма, артифакия правого глаза. Неполная осложненная катаракта левого глаза.
С учетом высоких показателей гликемии в течение суток уровень HbA1c назначена фиксированная комбинация инсулина гларгин и ликсисенатида в дозе 10 ЕД подкожно в течение часа перед завтраком. Были отменены гликлазид и вилдаглиптин, продолжен прием метформина в суточной дозе 2000 мг. Титрация фиксированной комбинации осуществлялась по 2 ЕД через 3 дня, если средний уровень глюкозы натощак превышал уровень 5,0 ммоль/л. Пациент был обучен технике инъекций препарата, принципам питания на инсулинотерапии и вел дневник самоконтроля. В течение 1,5 месяцев пациенту проведена титрация дозы до 28 ЕД с достижением гликемии натощак от 6,4 до 7,0 ммоль/л, постпрандиально от 8 до 10 ммоль/л, клинически значимые гипогликемии отсутствовали. В ноябре 2019 г. масса тела – 88 кг, ИМТ – 28,4 кг/м2, HbA1c – 6,8%; гликемия натощак от 6,5 до 7,2 ммоль/л, постпрандиально от 9 до 10 ммоль/л. Клинически значимые гипогликемии отсутствовали. Пациент удовлетворен проведенной терапией, жалобы на тошноту, рвоту отсутствовали.
В марте 2020 г. проведено обследование: рост – 176 см, масса тела – 87 кг, ИМТ – 28,09 кг/м2. В общем анализе крови и в общем анализе мочи без изменений, глюкозурия отсутствует, HbА1c – 6,9%. Была зарегистрирована единичная гипогликемия, связанная с диетическими нарушениями (длительный промежуток между приемами пищи или недостаточно съеденных хлебных единиц). Проведены дополнительные обучающие мероприятия. Обобщенный анализ состояния углеводного обмена и массы тела за период наблюдения приведен ниже (табл. 2).
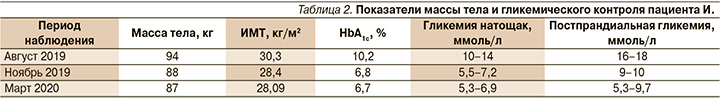
Пациенту рекомендовано снизить дозу фиксированной комбинации инсулина гларгин и ликсисенатида до 26 ЕД, вести дневник самоконтроля гликемии с последующей коррекцией дозы препарата, соблюдать временные параметры и кратность приема пищи, выполнять аэробные физические нагрузки не менее 3 раз в неделю продолжительностью 30–60 минут, продолжить антигипертензивную и гиполипидемическую терапию.
Обсуждение
Достаточно большая длительность СД и высокая гипергликемия натощак у представленных пациентов, несомненно, указывали на необходимость назначения базального инсулина. В то же время данные исследований свидетельствуют о том, что в 40–50% случаев пациенты не могут достигать оптимального гликемического контроля, получая только базальный инсулин [13–15]: требуются препараты, снижающие постпрандиальную гипергликемию. В описанных клинических случаях фиксированная комбинация инсулина гларгин и ликсисенатида в сочетании с метформином оказалась эффективным терапевтическим подходом к лечению пациентов, приведшим к целевому гликемическому контролю, снижению или незначительному увеличению массы тела.
У пациентов отсутствовали жалобы на диспепсические явления, что объясняется постепенным увеличением дозы ликсисенатида при проведении титрации, что помогает организму лучше адаптироваться к данному компоненту. Приверженность терапии служит еще одним важным положительным моментом при лечении с комбинированными препаратами: как известно, приверженность снижается с увеличением числа ежедневных инъекций [16, 17]. Однократная ежедневная инъекция помогает избегать проблем, связанных с нарушением режима лечения.
На наш взгляд, сопоставление и анализ опубликованных данных рандомизированных исследований и наблюдений конкретных пациентов в реальной клинической практике имеют большое значение в деятельности практикующего врача. Следует отметить, что полученные результаты лечения обсуждаемых пациентов коррелируют с данными рандомизированного исследования LixiLan-O, которое показало, что на терапии фиксированной комбинацией инсулина гларгин и ликсисенатида достигалось более значимое снижение уровня HbA1c по сравнению с инсулином гларгин без увеличения числа гипогликемии или массы тела и наблюдалась более низкая частота побочных эффектов со стороны желудочно-кишечного тракта по сравнению с ликсисенатидом [11].
Заключение
Таким образом, представленные клинические наблюдения показывают возможность эффективного контроля углеводного обмена с помощью современных инновационных препаратов, действующих в рамках нескольких патогенетических звеньев. Появление фиксированных комбинаций инсулина и агониста рецепторов ГПП-1 значительно расширило возможности практикующих врачей для подбора гибкой и эффективной сахароснижающей терапии, что значительно повышает приверженность пациента лечению и позволяет достигать оптимального гликемического контроля.


