Введение
Акромегалия представляет собой синдром, включающий различные наследственные и спорадические морфо-функциональные формы ГР (гормон роста)-секретирующих опухолей гипофиза (соматотропин), отличающиеся по степени клеточной специализации, агрессивности интракраниального роста и чувствительности к предъявляемому лечению [1, 2]. Длительная экспозиция патологической гиперсекреции ГР и его гормо-нального посредника – инсулиноподобного ростового фактора-1 (ИРФ-1) способствует активной клеточной пролиферации, подавлению апоптоза и развитию характерных для данной патологии множественных системных и обменных нарушений, негативно влияющих на продолжительность и качество жизни [3, 4]. Согласно современным международным рекомендациям, лечебная стратегия должна быть направлена на скорейшее достижение биохимической ремиссии, уменьшение тяжести системных и обменных осложнений, предотвращение (или снижение выраженности) интракраниальной компрессии [5].
Как правило, лечение акромегалии является комплексным и в большинстве случаев требует пошагового мультидисциплинарного участия для достижения контроля заболевания. С 1980-х гг. произошли кардинальные изменения в лечебной парадигме акромегалии, проявляющиеся в существенном сокращении вклада лучевого пособия и поступательном увеличении числа больных, получающих хирургическое пособие и медикаментозную терапию. Существенное увеличение вклада фармакотерапии акромегалии произошло благодаря внедрению в клиническую практику аналогов соматостатина, доля которых среди используемых при акромегалии лекарственных препаратов (в качестве моно- и комбинированной терапии) в настоящее время составляет около 81% [6, 7].
Раздел 1
Современная методология лечения включает в приоритетной последовательности три различные модальности: транссфеноидальную хирургию, фармакотерапию и лучевое воздействие, причем, как правило, доминируют комбинированные схемы лечения (см. рисунок).
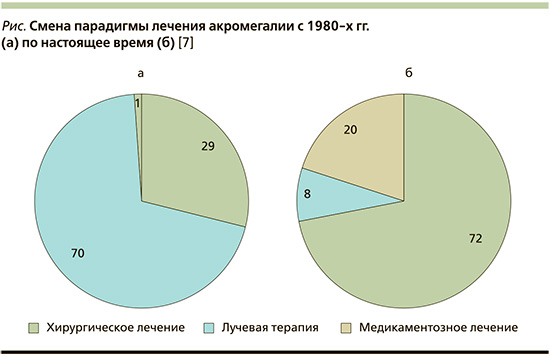
Согласно современным международным рекомендациям, приоритетным методом лечения акромегалии является эндоскопическая транссфеноидальная аденомэктомия, позволяющая быстро и с наименьшими затратами достигать контроля заболевания. Как следует из клинической практики, эффективность хирургического пособия зависит от размеров и степени инвазивности гипофизарных опухолей в кавернозный синус, квалификации нейрохирурга и оснащенности лечебного учреждения. Радикальная аденом-
эктомия, способствующая полной ремиссии акромегалии, наблюдается в 75–90% случаев при микроаденомах и в 45–70% случаев при макроаденомах гипофиза [8]. К негативным прогностическим факторам нейрохирургического вмешательства относятся молодой возраст при постановке диагноза, высокое исходное содержание ГР и ИРФ-1, большие размеры опу-холи и ускоренный ее рост, инвазию в твердую мозговую оболочку и кавернозный синус, эрозию дна турецкого седла, выявление при гистологическом исследовании слабогранулированной опухоли. Около половины прооперированных пациентов с эндоэкстраселлярными опухолями гипофиза нуждаются во вторичной медикаментозной или лучевой терапии в связи с наличием остаточной опухолевой ткани и сохраняющейся активностью заболевания [9].
Следует отметить, что даже в случае нерадикальной аденомэктомии хирургическое вмешательство представляется полезным, поскольку помимо снижения масс-эффекта и риска интракраниальной компрессии обеспечивает возможность электронно-микроскопического и иммуногистохимического исследования опухолевого материала для получения дополнительной информации относительно морфологического строения, митотической активности и рецепторного фенотипа опухоли, что является определяющим при выборе персонализированной программы вторичного лечебного пособия. Кроме того, резекция аденомы повышает эффективность последующей фармакотерапии АС1 [6, 10].
Медикаментозная терапия
На сегодняшний день известно три класса фармакологических препаратов, использующихся при лечении акромегалии (аналоги соматостатина – АС, селективные агонисты дофамина – АД, и антагонисты рецепторов ГР).
АС занимают особое место в лечении ГР-секретирующих опухолей, поскольку отличаются выраженным антисекреторным и антипролиферативным действиями. Взаимодействуя со специфическими рецепторами соматостатина в различных тканях (в т.ч. в центральной нервной системе и желудочно-кишечном тракте), АС подавляют секрецию ГР, тиреотропного гормона, а также серотонина и пептидов, продуцируемых в гастроэнтеропанкреатической эндокринной системе. Помимо антисекреторного действия АС ингибируют пролиферацию клеток путем приостановки клеточного цикла, индукции апоптоза, снижения продукции ростовых факторов и блокирования ангиогенеза, что оказывает положительное действие при ГР-продуцирующих опухолях гипофиза и различных нейроэндокринных опухолях [11, 12].
К настоящему времени накоплен достаточный опыт эффективного клинического применения АС при гипофизарной патологии, нейроэндокринных опухолях и иных нарушениях. Список нозологий, при которых успешно используются АС, включает соматотропиномы, тиротропиномы, кортикотропиномы, гонадотропиномы, пролактиномы, резистентные к АД, гастроэнтеропанкреатические нейроэндокринные опухоли (инсулиномы, глюкагономы, гастриномы, випомы, соматостатиномы); карциноидный синдром, врожденный гипе-ринсулинизм, орбитопатию при болезни Грейвса; ретинопатию и макулярный отек при сахарном диабете; гормональнонеактивные опухоли молочных желез, кишечника, простаты, легких, печени; патологию желудочно-кишечного тракта (хроническая рефрактерная диарея, гепаторенальный поликистоз, острая гастроинтестинальная геморрагия, демпинг синдром, интестинальные или лимфатические фистулы) [13].
В отличие от нативного соматостатина, обладающего малой продолжительностью жизни (Т1/2 – несколько минут), его синтетические аналоги (октреотид, ланреотид) обладают сходными с ним фармакологическими эффектами при значительно большей продолжительности действия. К очевидным преимуществам пролонгированных форм относятся поддержание оптимальной терапевтической концентрации препарата в крови в течение длительного времени за счет двухфазного высвобождения активного вещества из его носителей (микросфер, геля); меньшая кратность введения, большая степень свободы и повышение качества жизни пациентов.
К пролонгированным октреотид-содержащим препаратам, зарегистрированным в настоящее время в РФ, относятся оригинальный препарат Сандостатин ЛАР и генерики Октреотид-депо и Октреотид-лонг. Увеличение продолжительности супрессивного действия на секрецию ГР достигается путем включения октреотида в микросферы, состоящие из особого поли-DL-лактид-когликолид-глюкозного полимера, обеспечивающего постепенное высвобождение препарата из внутримышечного депо. Препарат назначается в дозировках 10, 20 и 30 мг/28 дней.
В 2001 г. появилась оригинальная лекарственная форма пролонгированного ланреотида – ланреотид Аутожель (Соматулин Аутожель) 120 мг, представляющая перенасыщенный водный раствор ланреотида и молекул воды с образованием геля. После однократной инъекции фармакологически эффективная концентрация ланреотида сохраняется более 28 дней. Популяционное исследование фармакокинетики продленного ланреотида подтвердило возможность использования препарата в дозе 120 мг с увеличенными интервалами до 56 дней. Для сравнения следует отметить, что введение Соматулин Аутожеля в дозе 120 мг с интервалами 28, 42 и 56 дней соответствует введению октреотида ЛАР в дозах 30, 20 и 10 мг соответственно. Продленные формы октреотида и ланреотида относятся к аналогам соматостатина 1-й генерации (АС1).
Первичная фармакотерапия рекомендуется пациентам с плохой хирургической перспективой и высоким периоперационным риском. В последнем случае нередко используется предоперационное медикаментозное лечение для улучшения соматического статуса пациента и снижения рисков анестезиологических осложнений (отек гортани, сердечная недостаточность, неконтролируемая гипертензия и т.д.). Однако, как правило, используется вторичная медикаментозная терапия, схема и длительность которой определяются эффективностью, переносимостью и доступностью лекарственных препаратов [14].
Раздел 2
Следует особо подчеркнуть, что в отличие от радикальных методов лечения успешность медикаментозной терапии непосредственно зависит от приверженности пациента дли-тельной, подчас пожизненной, парентеральной фармакотерапии. При этом степень приверженности определяется такими факторами, как эффективность, безопасность и переносимость используемого лекарственного препарата.
Эффективность
К настоящему времени убедительно доказано, что использование АС1 в качестве первичной или вторичной медикаментозной терапии в избирательной выборке способствует ско-рому достижению биохимической ремиссии и уменьшению объема опухолевой ткани. Так, в многоцентровом международном клиническом исследовании PRIMARYS оценивалась клиническая эффективность 12-месячного приема ланреотида Аутожеля (120 мг каждые 4 недели) у 90 пациентов в качестве первичной медикаментозной терапии. Помимо биохимических параметров использовались опросники для пациентов по выраженности клинических симптомов и качеству жизни.
В ходе исследования было продемонстрировано уменьшение объема опухоли на 20% и более у 75% пациентов при применении Соматулин Аутожеля, а также быстрое и устойчивое снижение уровней ГР и ИРФ-I – на 71 и 57% соответственно. Авторы подчеркивают, что первичное лечение препаратом Соматулин Аутожель в максимально допустимой дозе (120 мг/28 дней) пациентам с ГР-секретирующими макроаденомами гипофиза обеспечивает скорое и устойчивое снижение опухолевого объема, уровней ГР и ИРФ-I, а также клинических проявлений с повышением качества жизни [15, 16]. Аналогичные результаты были получены в работе S. Khairi et al., из которой следует, что продолжительное 8-летнее лечение больных акромегалией препаратом Соматулин Аутожель обеспечивало стойкое поддержание биохимической ремиссии, уменьшение объема опухоли, снижение выраженности осложнений и повышение качества жизни [17].
В 2017 г. был опубликован отчет американских ученых о результатах 2-летнего использования ланреотида-депо у 241 пациента, включенного в SODA (Somatuline® Depot for Acromegaly)-регистр. В итоге многоцентрового наблюдательного исследования было показано, что на фоне лечения ланреотидом-депо нормализация уровня ИРФ-I через 12 месяцев лечения была достигнута у 71%, а через 24 месяца – у 74% больных. Снижение уровня ГР менее чем на 2,5 нг/мл наблюдалось у 83 и 80% через 12 и 24 месяцев лечения соответственно. Нормализация обоих биохимических показателей зарегистрирована у 51,7 и 42,9% больных соответственно. Авторы отметили клиническую эффективность, хорошую толерантность и переносимость препарата [18].
Клиническая эффективность первичной или вторичной медикаментозной терапии зависит от полноты опухоль-ориентированной диагностики, позволяющей судить о рецепторном фенотипе опухолевой ткани и скорости ее пролиферативной активности. Как уже отмечалось, это связано с наличием множественных вариантов ГР-секретирующих аденом, раз-личающихся по патоморфологическому строению, клиническому течению и чувствительности к предъявляемому лечению. Проведенные клинико-патологоанатомические исследования показали, что каждый тип опухоли имеет характерную патофизиологию, отлича-ющуюся клиническими сценариями опухолевого развития, радиологическими проявлениями и особенностями ведения. Наиболее рельефно это проявляется на примере чувствительности к АС1, преимущественно влияющим на 2-й подтип соматостатиновых рецепто-ров (ССР), который неодинаково представлен во всех морфологических вариантах соматотропином. Низкая экспрессия или отсутствие данных рецепторов на мембране опухолевых клеток проявляется феноменом частичной или полной резистентности к АС1, встре-чающимся примерно в 40–50% случаев. Как правило, это наблюдается при наличии слабогранулированных или смешанных аденом, экспрессирующих 5-й подтип ССР, отличающихся ранним дебютом и агрессивным течением [19, 20].
При использовании АС1 в качестве первичной или вторичной фармакотерапии биохимический контроль достигается в среднем в 30–60% случаев. Значимое уменьшение объема опухоли (≥20%) наблюдается у 63–79% больных, в большей степени – при первичной медикаментозной терапии. Описана прямая корреляция между биохимической чувствительностью к АС1 и уменьшением объема опухолевой ткани. Исходное высокое содержание ГР и ИРФ-1, а также большие размеры опухоли указывают на низкую чувствительность к АС1. В связи с этим предварительная субтотальная хирургическая резекция может считаться дополнительной мерой для повышения чувствительности к препаратам [21].
В связи с неоднозначным действием АС1 в последние годы стали появляться работы, посвященные поиску клинических, лабораторных и инструментальных предикторов, позволяющих оперативно определять клинико-патологический вариант опухоли и назначать адекватное лечение с учетом рецепторного фенотипа. Среди предикторов хорошей чувствительности к АС1 рассматриваются различные варианты оценочных проб с октреотидом, отличия интенсивности МР-сигнала на Т2-взвешенных изображениях, характер экспрессии 2-го и 5-го подтипов ССР при иммуногистохимическом исследовании оперативно удаленного материала [22, 23].
Безопасность и качество жизни
Переносимость АС зависит от лекарственной формулы и характера рецепторного воздействия. К достоинствам препарата Соматулин Аутожель относятся отсутствие фармакологического носителя, большая длительность действия (до 56 дней) за счет медленной диффузии кристаллов из подкожного депо, равномерность фармакокинетического профиля с отсутствием первоначальных пиков гиперконцентрации, наличие готовой к применению лекарственной формы, малый объем вводимого вещества и подкожный способ введения. Все это обеспечивает не только стабильный лечебный эффект, но и комфорт для пациентов. При этом простота инъекций исключает необходимость привлечения квалифицированного персонала и позволяет вводить препарат в домашних условиях самостоя-ельно или с помощью близких. Положительным отличием Соматулина Аутожель также является возможность (по показаниям) увеличения интервала между инъекциями до 8 недель, что безусловно повышает степень свободы и качество жизни больных. Помимо акромегалии убедительно доказана эффективность использования препарата при метастатических гастроэнтеропанкреатических нейроэндокринных опухолях [24, 25].
Потенциальная возможность препарата сокращать частоту проводимых инъекций была изучена в клиническом исследовании «LEAD», в ходе которого была предпринята попытка оценить возможность перевода больных акромегалией с препарата октреотид ЛАР (в дозе 10–20 мг/28 дней) на ланреотид Аутожель 120 мг с увеличенными межинъекционными интервалами. Как показали результаты, из 107 включенных в исследование пациентов, ранее получавших октреотид ЛАР в ежемесячной дозе 10–20 мг/28 дней и переведенных на ланреотид Аутожель, у 88,7% сохранялся нормальный уровень ИРФ-I через 24 недели лечения с 6- и 8-недельными интервалами.
У 90% больных уровень ГР через 24 и 48 недель был менее 2,5 нг/мл. По итогам исследования большинство пациентов предпочли в дальнейшем использовать ланреотид Аутожель 120 мг каждые 6 или 8 недель вместо приема октреотида ЛАР каждые 4 недели [26]. Таким образом, несмотря на сходную клиническую эффективность пролонгированных октреотид- и ланреотидсодержащих препаратов, сама процедура введения Соматулина Аутожель является более комфортной для пациентов. Данный вывод согласуется с результатами проведенного в Польше открытого проспективного многоцентрового исследования, посвященного оценке предпочтительности для пациентов использования препарата ланреотид Аутожель по сравнению с другими АС. Было отмечено, что клиническое использование ланреотид Аутожеля имело «полную или частичную» предпочтительность со стороны 95,1% больных по критериям клинической эффективности, простоты и безопасности введения [27].
Соматулин Аутожель отличается хорошей переносимостью. Из побочных эффектов наблюдались диарея (37%), боли в животе (19%), патологический насморк (11%). Обычно эти симптомы сохраняются в течение короткого времени и уменьшаются по мере продолжения терапии. В 8% случаев были зарегистрированы камни в желчном пузыре в отсутствие клинической симптоматики, застой желчи, расширение желчного протока, что обусловлено снижением моторики желчевыводящих путей. В незначительном числе случаев наблюдались боли и высыпания в месте инъекции. Значимых нарушений со стороны жирового и углеводного обменов у большинства пациентов на фоне лечения ланреотидом Аутожелем не обнаружено, за исключением относительно малой группы пациентов с небольшим нарушением гликемического контроля [28].
Раздел 3
Следует подчеркнуть, что в настоящее время мировое здравоохранение находится в процессе перехода от моделей, организованных вокруг медицинских учреждений и отдельных врачей, к пациентоцентричным интегрированным моделям, построенным вокруг потребностей пациента и предполагающим комплексное управление здоровьем человека на всех стадиях болезни. Роль пациента в современном здравоохранении становится значи-тельнее с каждым годом: пациент XXI в. не только осознанно подходит к процессу лечения, но и занимает в нем центральное положение.
Не секрет, что многолетние ежемесячные инъекции АС обременительны для пациентов из-за негативного опыта неудачного внутримышечного введения препарата (особенно у женщин и пациентов с высоким индексом массы тела), боязни болезненных ощущений в месте инъекции, сложности самой процедуры введения препарата и необходимости регулярного посещения лечебного учреждения для привлечения помощи опытной медицинской сестры. Многочисленные опросы больных свидетельствуют, что, несмотря на эффективность медикаментозного лечения АС, сложные режимы введения препарата оказывают негативное влияние на качество жизни и степень свободы пациентов и, соответственно, снижают приверженность терапии. Наиболее предпочтительными являются упрощенные и менее болезненные схемы введения препаратов, предполагающие использование предзаполненных форм препаратов, позволяющих упростить и обезопасить технику инъекции и проводить ее подкожно в домашних условиях, что безусловно экономит личное время и является более комфортным для пациентов. Положительным фак-тором также является потенциальная возможность увеличения межинъекционных интервалов до 56 дней при наличии хорошей чувствительности к препарату.
Дополнительным аргументом в пользу повышения приверженности больных лечению препаратом Соматулин Аутожель 120 мг является уникальная конструкция нового шприца для инъекций, при разработке которой было проведено многоцентровое международное исследование с участием пациентов с акромегалией, мнение которых стало решающим при утверждении окончательного варианта. В итоге новый шприц ланреотида оказался лучше по всем параметрам, как по сравнению с предыдущей версией, так и с октреотидом. Согласно результатам международного многоцентрового неинтер-венционного исследования PRESTO (PREference STudy of lanreOtide autogel), 98% медицинских сестер оказали предпочтение в выборе между новым шприцем ланреотида и шприцем октреотида длительного действия. Аргументами в пользу нового шприца ланреотида явились простота использования во время подготовки и проведения инъекции, уверенность в том, что не «забьется» игла, нет потерь препарата при приготовлении и выполнении инъекции, низкий риск травматизации тканей при регулярном введении лекарства [29].
В проспективном исследовании SONATE оценивали удовлетворенность пациентов и медсестер новой формой выпуска ланреотида Аутожель в терапии нейроэндокринных опухолей. Согласно данным опроса, отмечается более высокая степень удовлетворенности пациентов и медсестер новой формой выпуска ланреотида Аутожель по всем критериям оценки (беспокойство пациента, качество поршня, качество колпачка для иглы, качество шприца в целом) [30]. Новаторскими отличиями нового шприца Соматулина Аутожель являются усиленный поршень, облегчающий введение препарата; прочный упор для пальцев и рельефный корпус, не допускающий скольжения; пластиковая подложка, обеспечивающая безопасность при транспортировке; рельефный защитный колпачок, способствующий более уверенному захвату и удобству в обращении.
Раздел 4
Продолжая тему пациенториентированного лечения, следует обсудить варианты комбинированной медикаментозной терапии при наличии частичной или полной резистентности к АС1. Как уже отмечалось, клиническая эффективность при применении АС1 в немалой степени зависит от особенностей рецепторного фенотипа опухолевых клеток. АС1 преимущественно связываются со 2-м и в меньшей степени с 5-м подтипами ССР, контролирующими секрецию ГР. Клетки ГР-секретирующих аденом гипофиза также преимущественно экспрессируют 2-й и 5-й подтипы ССР, аффинность к которым может отличаться в различных морфологических типах опухолей. Так, в клетках густогранулированных аденом выше относительная экспрессия 2-го подтипа ССР, тогда как в слабогранулированных аденомах больше представленность 5-го подтипа ССР. Наблюдаемая большая вариабельность экспрессии отдельных подтипов ССР свидетельствует прежде всего о том, что соматотропиномы представляют собой разнородную группу гипофизарных опухолей с различной рецепторной архитектоникой. Поэтому представляется важным попытаться предварительно определить индивидуальный рецепторный профиль для каждой опухоли для того, чтобы выработать адекватную лечебную стратегию [31–33].
Выявленные при иммуногистохимическом исследовании измененные соотношения между 2-м и 5-м подтипами ССР ГР-секретирующих аденом лежат в основе феномена чувствительности или резистентности к используемым формам АС. Как показывает клиническая практика, хорошая и стабильная чувствительность к АС1 наблюдается примерно у 40–50% больных акромегалией, в остальных случаях фиксируется либо частичная, либо полная резистентность. Поэтому в связи с реальными особенностями рецепторного фенотипа в различных опухолях гипофиза оптимальной терапевтической нишей для АС1 являются наиболее часто встречающиеся густогранулированные аденомы, отличающиеся наибольшей чувствительностью к этим препаратам. У пациентов данной категории контроль акромегалии достигается в 70–80% случаев [22].
При частичной резистентности рекомендуется эскалация АС1 до подключения других лечебных процедур. В работе A. Giustina et al. была проведена оценка эффективности и без-опасности применения ланреотида Аутожель в 2 режимах (120 мг/21 день и 180 мг/28 дней). Проведенное рандомизированное исследование показало, что увеличение дозы или частоты инъекций способствовало нормализации уровня ИРФ-I примерно у 30% больных с частичной резистентностью. При этом наибольшей эффективностью обладал режим увеличения дозы, чем снижения межинъекционных интервалов [34].
Селективный АД каберголин также оказывает супрессивное действие на секрецию ГР. Поскольку препарат направленно подавляет продукцию пролактина, одной из фармакологических ниш его использования при акромегалии являются смешанные (ГР-пролактинсекретирующие) опухоли. Также монотерапия каберголином рекомендуется при соматотропиномах с небольшой гормональной активностью, при этом контроль наблюдается в 36% случаев. По данным J. Bollerslev et al., при комбинации каберголина с АС1 безопасный уровень ГР и ИРФ-1 достигается в 75 и 55% случаев [7].
В работе M. Puig-Domingo et al. в случаях недостаточной эффективности использования монотерапии ланреотид Аутожелем, рекомендуется сочетание препарата с каберголином или пегвисомантом. Как резюмируют авторы, биохимический контроль при совместном приеме ланреотид Аутожеля и каберголина наблюдался в 48% случаев, тогда как комбинация ланреотид Аутожеля и пэгвисоманта способствовала нормализации уровня ИРФ-I в 70% случаев [35].
Наличие феномена резистентности и ограничение терапевтических возможностей АС1 активизировали дальнейшие научные изыскания и способствовали созданию новой полирецепторной лекарственной формы АС – пасиреотида, открывшего список аналогов соматостатина 2-й генерации. При сравнении с октреотидом пасиреотид обладает в 40, 30 и 5 раз более высокой связывающей способностью с 5-м, 1-м и 3-м подтипами ССР и в 2,5 раза меньшей аффинностью ко 2-му подтипу ССР. Благодаря этому пасиреотид оказывает значимое антисекреторное и антипролиферативное воздействие на октреотид-резистентных больных, поскольку преимущественно воздействует на слабогранулированные и смешанные соматотропиномы, экспрессирующие преимущественно 5-й подтип ССР. Отмечено, что использование пасиреотида ЛАР в дозе 40–60 мг/28 дней в течение года способствовало достижению биохимического контроля подавляющего числа больных из группы ранее плохо компенсированных пациентов, получавших АС1. Несмотря на удовлетворительную переносимость, следует отметить, что у 65% больных, получавших пасиреотид ЛАР, наблюдалось нарушение углеводного обмена по сравнению с 18,4% пациентов, получавших октреотид ЛАР, что снижает перспективы его широкого использования за пределами резистентной группы [7, 36]. В России данная лекарственная форма не зарегистрирована.
Дополнительной опцией при отсутствии контроля акромегалии является использование пэгвисоманта. Антагонист рецепторов гормона роста пэгвисомант представляет собой генно-инженерный аналог эндогенного ГР. Благодаря произведенным аминокислотным заменам препарат путем конкурентного ингибирования блокирует биологическое действие нативного ГР в периферических тканях и органах, способствуя терапевтическому снижению уровня ИРФ-I в крови и профилактике осложнений. В ходе международных клинических и обсервационных исследований было отмечено, что длительное использование пэгвисоманта обеспечивало нормализацию уровня ИРФ-I у 80–97% больных и регресс многих клинических симптомов. Отмечены положительные результаты совместного использования АС (или каберголина) и пэгвисоманта, позволяющие повышать чувствительность к АС и уменьшать терапевтическую дозу обоих препаратов. Начальная доза препарата составляет 10 мг/сут подкожно, максимальная суточная доза – 30 мг/сут [37].
Заключение
Таким образом, высокая эффективность действия препарата Соматулин Аутожель в качестве моно- или комбинированной фармакотерапии, облегченный и безопасный способ его введения, хорошая переносимость способствуют повышению приверженности пациентов длительному медикаментозному лечению. В отличие от схематических форм лекарственного пособия методом «ex juvantibus», комбинированная пациенториентированная терапия с учетом рецепторного фенотипа опухоли и метаболического статуса позволяет добиваться реального успеха большинству пациентов с повышением качества и продолжи-тельности жизни.


