Введение
Для Российской Федерации рост заболеваемости болезнями ЛОР-органов – не только медицинская, но и социальная проблема, а также фактор риска получения инвалидности, снижения продолжительности и качества жизни больных [1].
В связи с этим на первый план выходит задача по изучению факторов, отягощающих течение данных заболеваний, и поиску способов борьбы с ними. К одним из них относятся коморбидные заболевания, в т.ч. сахарный диабет 2 типа (СД2). По данным Государственного регистра больных СД2, на 01.01.2015 в нашей стране обращаемость в лечебные учреждения с данным заболеванием составила 3,7 млн человек [2].
Известно, что гнойно-воспалительные заболевания и СД взаимно отягощают друг друга. Высокая частота инфекций у больных СД обусловлена гипергликемической средой, способствующей иммунной дисфункции: нарушению функции нейтрофилов, угнетению антиоксидантной системы и гуморального иммунитета [3].
В настоящее время разработаны алгоритмы комплексного лечения гнойно-воспалительных заболеваний ЛОР-органов на фоне СД, включающие адекватную антибактериальную и сахароснижающую терапию, а также хирургическую санацию гнойных очагов [4]. Однако данные алгоритмы не включают иммунокорригирующей терапии, хотя доказано, что иммунные изменения играют важную роль в патогенезе как ЛОР-заболеваний, так и СД [5]. Кроме того, применение иммунокорригирующих препаратов препятствуют переходу острого воспалительного процесса в хроническую форму, уменьшая риск возникновения осложнений и позволяя повышать эффективность этиопатогенетической терапии [6]. Среди препаратов, благодаря высокой клинической эффективности хорошо зарекомендовавших себя при лечении гнойных заболеваний ЛОР-органов, следует отметить дезоксирибонуклеат натрия (ДН) и азоксимера бромид (АБ). Выбор данных иммуномодуляторов обусловлен тем, что они достаточно подробно изучены как при ЛОР-патологии, так и при СД [7, 8]. Однако нет данных о влиянии ДН и АБ на течение гнойно-воспалительных заболеваний ЛОР-органов на фоне СД2. Известно, что ДН восстанавливает и стимулирует В-звено иммунитета и популяцию Т-хелперов, а АБ оказывает стимулирующее влияние на систему фагоцитоза и естественные киллеры [9, 10].
Цель исследования: сравнительный анализ эффективности терапии препаратами ДН и АБ пациентов с риносинуситами (РС) и средними отитами (СО) на фоне СД2.
Методы
Проведено открытое проспективное рандомизированное клиническое исследование в параллельных группах. Обследование и терапия больных проведены в оториноларингологическом отделении ГБУЗ «Городская клиническая больница № 6 им. Г.А. Захарьина» (Пенза). Иммунологические исследования выполнены в Центральной научно-исследовательской лаборатории (ЦНИЛ) ПИУВ – филиала ФГБОУ ДПО РМАНПО Минздрава России.
В рамках исследования проведено иммунологическое обследование 25 пациентов с РС и СО на фоне СД2 в возрасте от 35 до 70 лет. Средний возраст пациентов составил 52,96±8,34 года. РС был диагностирован у 17 (66,6%) больных, среди них острый бактериальный РС выявлен у 9 пациентов. У 5 больных имелся хронический РС без полипоза носа, у 3 – хронический РС с полипозом носа. СО был диагностирован у 8 (32,0%) пациентов, среди них острый гнойный СО выявлен у 4 больных, хронический эпитимпано-антральный СО – у 3, хронический туботимпанальный гнойный СО – у 1 больного. На момент поступления 19 (74,0%) пациентов находились в стадии субкомпенсации СД, 6 (26,0%) – в стадии декомпенсации.
В зависимости от проводимой иммунокорригирующей терапии пациенты были разделены на две группы. Первую составили 13 больных, получавшие препарат ДН, который вводили внутримышечно по 5 мл 1,5%-ного раствора, разведенный в 2 мл 1%-ного новокаина с интервалом в 48 часов. Курс лечения составил 5 инъекций. Во вторую группу вошли 12 пациентов, получавших АБ, который вводили в дозе 6 мг по схеме: 5 инъекций через день, далее 5 инъекций в режиме 2 раза в неделю. Для коррекции углеводного процесса пациенты в исследуемых группах принимали таблетированные сахароснижающие препараты (15), инсулин (6), таблетированные сахароснижающие препараты в сочетании с инсулинотерапией (4).
Всем пациентам проведено иммунологическое обследование, включившее определение иммуноглобулинов (Ig) А, М, G и Е в сыворотке крови, а также интерлейкинов (ИЛ) -4 и -18 методом иммуноферментного анализа (Вектор-Бест). Исследование иммунологических показателей проводили в день поступления в стационар и через месяц после проведения иммунокорригирующей терапии. Заранее было получено информированное добровольное согласие больных на участие в исследовании.
Статистическую обработку результатов проводили с помощью программы Statistica 6,0. При обработке полученных данных применялись методы параметрической и непараметрической статистики. Сравнение количественных признаков в зависимых группах проводили по методу Вилкоксона. При р<0,05 различие между количественными признаками считались статистически значимыми.
Результаты исследования
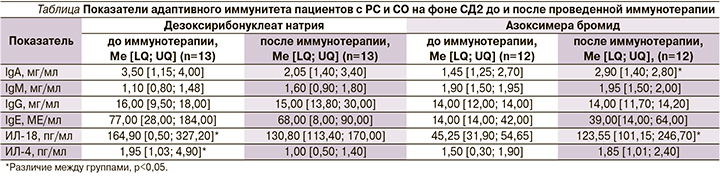
Данные, полученные в ходе изучения влияния иммунокорригирующей терапии на состояние иммунной системы больных РС и СО, представлены в таблице.
Обсуждение
После лечения препаратом ДН выявлено достоверное снижение уровня ИЛ-18 – с 164,90 [0,50; 327,20] до 130,80 [113,40; 170,00] пг/мл (Wilcoxon test, р=0,0312). Известно, что ИЛ-18 обладает провоспалительным эффектом и входит в семейство ИЛ-1. Имеются работы, подтверждающие диабетогенное свойство данного цитокина и указывающие, что повышение уровня ИЛ-18 ведет к деструкции β-клеток поджелудочной железы [11], а также участвует в патогенезе атопических, аутоиммунных и хронических воспалительных заболеваний [12]. Кроме того, выявлено достоверное снижение уровня ИЛ-4 – с 1,95 [1,03; 4,90] до 1,00 [0,50; 1,40] пг/мл. В настоящее время имеются данные о влиянии уровня ИЛ-4 на течение СД, а также о защитной роли высокого уровня ИЛ-4 при развитии СД [13]. Кроме того, ИЛ-4 отвечает за активность гуморального звена иммунитета, участвует в развитии провоспалительных реакций, процессах хронизации, причем низкие его значения говорят о хроническом воспалительном процессе [14]. Однако есть и противоположные данные, свидетельствующие о том, что повышение уровня ИЛ-4 подтверждает наличие вялотекущего воспалительного процесса [15].
После лечения препаратом АБ отмечено достоверное повышение показателей IgA в сыворотке крови – с 1,45 [1,24; 2,70] до 2,90 [1,40; 2,80] мг/мл (Wilcoxon test, р=0,0287) и достоверное повышение уровня ИЛ-18 – с 45,25 [31,90; 54,65] до 123,55 [101,15; 246,70] пг/мл (Wilcoxon test, р=0,0186). Известно, что АБ активирует гуморальный иммунитет, что и наблюдалось в нашем исследовании, согласуясь с исследованиями других авторов [16].
Клиническую эффективность терапии препаратами ДН и АБ оценивали по наступлению ремиссии РС и СО и влиянию на уровень сахара крови. После курса лечения препаратом ДН (Деринат) ремиссия наступала в 81% случаев, у 19% пациентов эффекта не наблюдалось. Уровень сахара до применения ДН составлял 11,10 [10,0; 13,2] ммоль/л, после лечения он снижался до 6,0 [5,9; 7,0] ммоль/л (р=0,0015).
После лечения препаратом АБ ремиссия наступала в 83% случаев, у 17% пациентов эффекта не наблюдалось. Уровень сахара до применения АБ был 10,9 [9,75; 11,45] ммоль/л, после лечения – 7,3 [6,65; 7,95] ммоль/л (р=0,0022).
На фоне проводимого лечения препаратами ДН и АБ сахароснижающая терапия не менялась.
Заключение
Таким образом, по клинической эффективности препараты ДН и АБ существенно не различались. Однако после лечения препаратом ДН выявлено снижение уровней ИЛ-4 и -18, а после применения АБ имело место повышение содержания IgA и ИЛ-18, что отражает направленность иммунокоригирующего действия изучаемых препаратов.
Вклад авторов. Концепция и дизайн исследования – Н.А. Шкурова, Н.И. Баранова. Сбор и обработка материала – Н.А. Шкурова, А.В. Федин. Статистическая обработка данных – Н.А. Шкурова, А.В. Федин. Написание текста – Н.А. Шкурова. Редактирование – Н.И. Баранова.


