Введение
В связи с широким использованием в клинической практике визуализирующих методов обследования случайно выявленные опухоли надпочечников (инциденталомы надпочечников – ИН) стали одной из актуальных проблем эндокринологии и эндокринной хирургии за последние десятилетия. По данным литературы, частота выявления новообразований при проведении компьютерной томографии (КТ) органов брюшной полости больных старше 70 лет достигает 10% [1]. Несмотря на то что у многих пациентов нет специфических клинических проявлений гиперпродукции гормонов, часть из ИН (5–48%) имеет нарушения стероидогенеза. Для определения гормональной активности опухолей надпочечников традиционно используются методы иммунохимического анализа с определением уровней адренокортикотропного гормона (АКТГ) в плазме крови, кортизола в сыворотке крови, экскреции свободного кортизола с мочой, свободного кортизола в слюне, а также различные стимулирующие и подавляющие тесты [2–4]. Специфичность и чувствительность перечисленных лабораторных анализов и тестов составляют 85–90% [5–6]. При пограничных значениях гормональных показателей в сомнительных ситуациях, когда у пациента отмечена коморбидная патология, потенциально связанная с имеющимися новообразованиями надпочечников, для выбора оптимальной тактики лечения больного возникает необходимость в дополнительных высокочувствительных тестах с использованием методов хроматографии, на сегодняшний день наиболее информативных для изучения метаболизма стероидов [2, 7–9]. Большое значение методам хроматографии отведено при диагностике мягких форм гиперкортизолизма, неклассических форм врожденной дисфункции коры надпочечников и других заболеваний с нарушениями стероидогенеза, когда традиционные тесты не всегда информативны [10–11]. Исследование стероидных профилей мочи (СПМ) методом газовой хромато-масс-спектрометрии (ГХ-МС) расширяет возможности лабораторной диагностики за счет определения метаболитов промежуточных продуктов адреналового стероидогенеза [12–14]. Ранее нами были проведены исследования по оценке значения стероидного профилирования методом ГХ-МС для дифференциальной диагностики разных форм гиперкортицизма, заболеваний с синдромом гиперандрогении у женщин, ранней диагностики адренокортикального рака [14–16]. В данной работе мы впервые изучили особенности метаболизма стероидных гормонов у пациентов с ИН в зависимости от степени их функциональной автономии.
Цель исследования: изучить особенности метаболизма стероидов у больных ИН с использованием метаболомного анализа на основе ГХ-МС.
Методы
Обследованы 205 больных опухолями надпочечников без выраженных клинических проявлений и без признаков злокачественного процесса по результатам КТ. У всех больных была нормальная или избыточная масса тела, средний возраст составил 53 (35–65) года. В группу контроля (ГК) вошли 27 здоровых лиц, соответствовавших обследованным по индексу массы тела и возрасту. Все больные ИН были разделены на три большие группы по результатам проведения подавляющего дексаметазонового теста (ПДТ) с 1 мг дексаметазона. У 35 пациентов с уровнем кортизола после пробы от 50 до 138 нмоль/л диагностирована возможная автономная секреция кортизола (ВАСК) опухолью. У 29 пациентов с уровнем кортизола в сыворотке крови более 138 нмоль/л после ПДТ с 1 мг дексаметазона определена автономная секреция кортизола (АСК).
У 141 пациента с ИН уровень кортизола после ПДТ с 1 мг дексаметазона был менее 50 нмоль/л. Топическая диагностика, определение размеров и лучевая характеристика опухолей проведены по результатам КТ надпочечников. Для оценки функционального состояния системы гипофиз–кора надпочечников использовали классические тесты, основанные на методе иммунохемилюминесцентного анализа (ИХЛА) с определением свободного кортизола в слюне, уровней АКТГ в плазме крови, 17-ОН-прогестерона, дегидроэпиандростерон-сульфата (ДЭА-С), кортизола в 9.00 (Ку) и 20.00 (Кв) в сыворотке крови и уровней кортизола после ПДТ с 1 мг дексаметазона. Методом ГХ-МС с оптимизацией регламента пробоподготовки исследовали СПМ [15]. Всего идентифицировано 69 стероидов. СПМ получены на газовом хромато-масс-спектрометре SHIMADZU GCMS-QP2020.
Статистическая обработка полученных результатов осуществлена с применением пакета программ для статистического анализа Statistiсa for Windows (версия 10) и GraphPadPrism 6. При сравнении показателей использовали непараметрический U-критерий Манна–Уитни. Проводили корреляционный анализ с применением коэффициента ранговой корреляции Спирмена. Основные количественные характеристики больных представлены в виде медианы (Me), 25-го и 75-го перцентилей (Q25–Q75). Статистически значимым считался критерий достоверности р<0,05. Исследование проведено в соответствии с Международными стандартами надлежащей клинической практики GCP (Good Clinical Practice).
Результаты
У пациентов с ВАСК уровень кортизола в сыворотке крови после ПДТ с 1 мг дексаметазона составил 49,6 (79–139), у пациентов с АСК – 181 (154–315) нмоль/л. В обеих группах пациентов получены общие нарушения метаболизма андрогенов по данным ГХ-МС: снижение экскреции с мочой (ЭМ) метаболитов андростендиона (андростерона – An, этиохоланолона – Et], дегидроэпиандростерона (DHEA) и его метаболитов по сравнению с ГК. Однако ЭМ 11-ОН-An, 11-OH-Et и 11-oxo-Et была увеличена у пациентов с АСК по сравнению с показателями ГК, а ЭМ DHEA (р=0,04), 11-OH-Et (р=0,04) и 11-oxo-Et (р=0,007) была выше у пациентов с ВАСК по сравнению с показателями больных АСК (табл. 1).
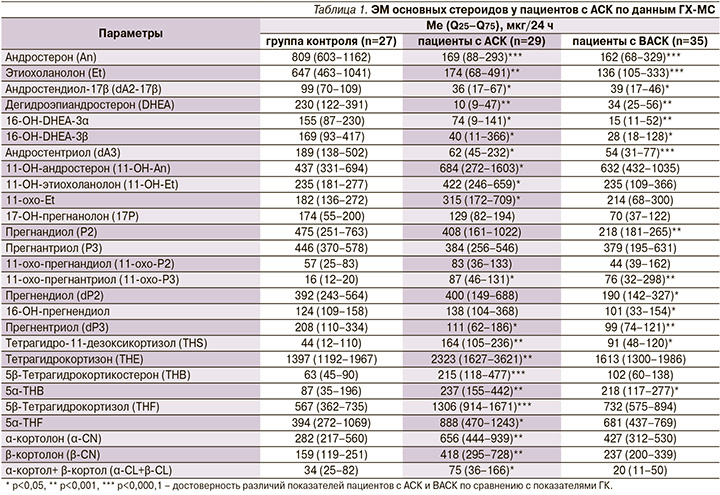
Пациентами с ВАСК и АСК по сравнению с ГК получено повышение ЭМ метаболитов глюкокортикоидов: 5α-тетрагидрокортикостерона (5α-ТНВ) и тетрагидро-11-дезокси-кортизола (ТНS). Больными АСК дополнительно получено увеличение ЭМ 5β-ТНВ, тетрагидрокортизона (ТНЕ), 5β-тетрагидрокортизола (5β-THF), 5α-THF, α- и β-кортолонов, суммы α-кортола и β-кортола по сравнению с показателями пациентов как с ГК, так и с показателями пациентов с ВАСК (табл. 1).
Общим нарушением метаболизма глюкокортикоидов у пациентов обеих групп было снижение активности фермента 11β-HSD 2-го типа, участвовавшего в превращении биологически активного кортизола в менее активный кортизон и кортикостерона – в 11-дегидрокортикостерон (А), о чем свидетельствует увеличение соотношений 5β-THF/ТНЕ, (5β-THF+5α-THF)/ТНЕ и ТНВ/ТНА. Уменьшение активности фермента 11β-гидроксилазы, что подтверждается снижением соотношения (5β-THF+5α-THF+ТНЕ)/THS, способствует накоплению малоактивного 11-дезоксикортизола и 11-дезоксикортикостерона, обладающего минералокортикоидной активностью, при замедлении образования кортизола и кортикостерона. От пациентов с АСК были получены признаки повышения активности 5β-редуктазы: снижение соотношений An/Et и 5α-THF/5β-THF (табл. 2).
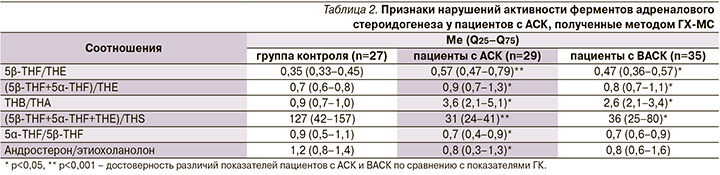
Уровень кортизола после ПДТ с 1 мг с дексаметазоном меньше 50 нмоль/л получен у 141 пациента с ИН. От 43 пациентов с ИН с уровнем кортизола после ПДТ с 1 мг дексаметазона менее 50 нмоль/л не было получено данных о нарушениях метаболизма кортикостероидных гормонов. ЭМ андрогенов, тетрагидрометаболитов глюкокортикоидов (THF, THE, THB, THS) и тетрагидро-11-дезоксикортикостерона (THDOC) не отличалась от показателей ГК (p>0,05). Данные пациенты вошли в группу гормонально-неактивных аденом надпочечника (ГНА). У 15 больных ИН и уровнем кортизола после ПДТ с 1 мг менее 50 нмоль/л получены СПМ по данным ГХ-МС, характерные для недостаточности фермента 21-гидроксилазы (21-ГН). У данных пациентов была увеличена ЭМ андрогенов: DHEA и его метаболитов, 5α-метаболитов андростендиона (An, 11-OH-An), метаболитов 17-ОН-прогестерона (17-OH-прегнанолона – 17P, прегнантриола – P3, 11-oxo-P3) и метаболитов прегненолона (прегнендиола – dP2, 16-OH-dP2, прегнентриола – dP3) по сравнению с ГК (табл. 3).
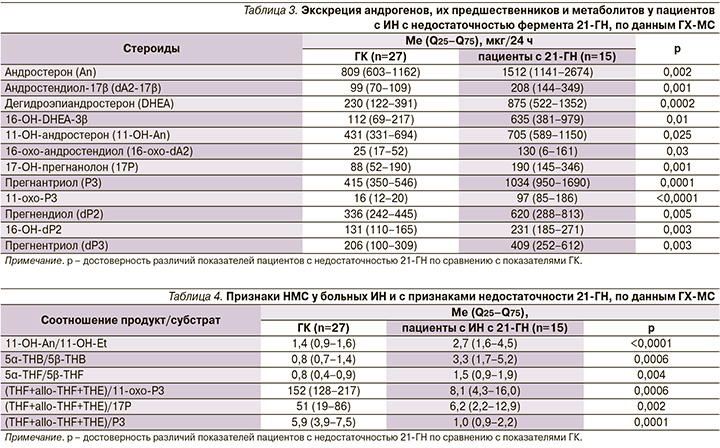
У пациентов с 21-ГН было получено снижение соотношений (5β-THF+5α-THF+ТНЕ)/Р3 (меньше 2,2), (5β-THF+5α-THF+ТНЕ)/11-охо-Р3 (меньше 16,0) и (5β-THF+5α-THF+ТНЕ)//17Р (меньше 13,0), которые являются основными биомаркерами 21-ГН, по данным ГХ-МС [16]. Увеличение соотношений 11-ОН-Аn/11-OH-Et, 5α-THB/5β-THB и 5α-THF/5β-THF свидетельствовало о повышении активности 5α-редуктазы у пациентов с 21-ГН (табл. 4).
Кроме этого у пациентов с 21-ГН были определены стероиды, не детектируемые у здоровых лиц и характерные для дефекта 21-ГН: 21-deoxy-THF, 16-гидроксилированные метаболиты прегнанолона, 5-еne-прегнены (табл. 5).
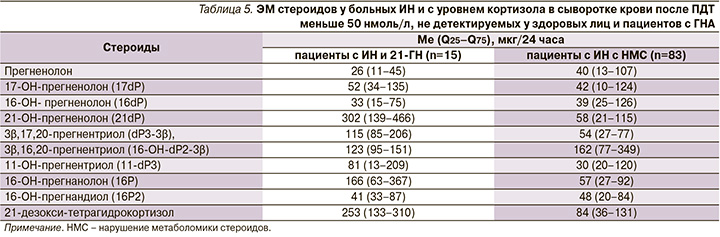
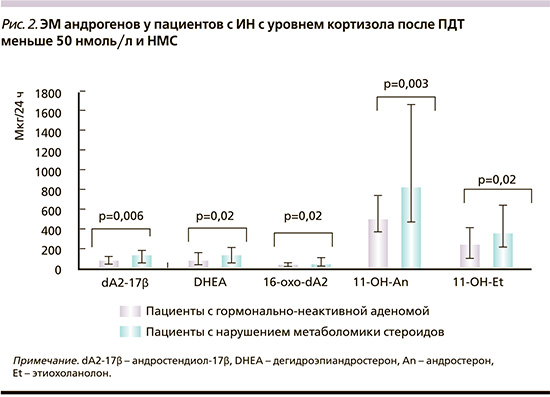
У 83 больных ИН и с уровнем кортизола после ПДТ с 1 мг менее 50 нмоль/л была повышена ЭМ метаболитов глюкокортикоидов (ТНЕ, 5α-ТНF, 5β-ТНF, ТНS, α- и β-кортолонов), увеличена минералокортикоидная функция коры надпочечников, связанная с повышением ЭМ тетрагидрометаболитов – предшественников альдостерона (5β-THB, 5α-THB, ТНА и THDOC), по сравнению как с ГК (р<0,01), так и с ГНА (рис. 1). ЭМ андрогенов у данных пациентов с ИН с различными НМС была повышена по сравнению с показателями пациентов с ГНА, но не отличалась от ГК (р>0,05, рис. 2). От пациентов с ИН с НМС получены признаки снижения активности 11β-гидроксилазы: увеличение ЭМ ТНS и THDOC, снижение соотношения (5β-THF+5α-THF+THF)/ТНS до 41,3 (24,7–55,0) по сравнению с ГК (р<0,0001) и ГНА (р<0,0001), определение ЭМ гексагидро-11-дезоксикортизола – 110 (38–159) мкг/24 ч. У пациентов с ИН и НМС увеличение ЭМ 5β-ТНВ, 5α-ТНВ и ТНА, снижение соотношения (5β-THF+5α-THF+ТНЕ)/(5β-ТНВ+5α-ТНВ+ТНА) до 7,2 (5,2–9,9), р=0,015 (меньше 10) и соотношения (An+Et)/(5β-ТНВ+5α-ТНВ+ТНА) до 1,9 (0,8–3,9), p<0,0001 (меньше 4,0) по сравнению с ГК: 11,2 (9,7–17,9) и 6,4 (4,1–10,6) соответственно указывают на уменьшение активности 17-гидроксилазы, что способствует повышению минералокортикоидной функции коры надпочечников. У 17 пациентов с ИН и НМС на основании гистологического анализа послеоперационного материала определен злокачественный потенциал 1–3 балла по шкале L.M. Weiss. Кроме этого от пациентов с ИН с НМС получены положительные корреляции Et (r=0,57), DHEA (r=0,53), 16-OH-DHEA-3β (r=0,58), dA2-17β (r=060) и dA3 (0,77) с наличием злокачественного потенциала, а также определены стероиды, не детектируемые у здоровых лиц и пациентов с ГНА (табл. 5).

Обсуждение
Исследование СПМ методом ГХ-МС у пациентов с ИН расширяет возможности лабораторной диагностики гормональных нарушений за счет одновременного определения метаболитов андрогенов, глюкокортикоидов, минералокортикоидов и промежуточных продуктов адреналового стероидогенеза [15]. В нашем исследовании получены общие нарушения метаболомики андрогенов и глюкокортикоидов у больных АСК и ВАСК, связанные со снижением экскреции с мочой андрогенов, признаками уменьшения активности 11β-HSD 2 типа и 11β-гидроксилазы.
У пациентов с АСК дополнительно получены признаки повышения активности 5β-редуктазы, у 10,6% пациентов с ИН с уровнем кортизола после ПДТ с 1 мг меньше 50 нмоль/л получены признаки недостаточности 21-гидроксилазы, у 58,9% – нарушения метаболизма андрогенов, глюкокортикоидов и минералoкортикоидов, признаки недостаточности 11β-гидроксилазы и 17-гидроксилазы. Только у 30,5% пациентов с ИН не были отмечены нарушения метаболизма стероидов.
У оперированных больных установлена взаимосвязь повышения экскреции с мочой андрогенов со злокачественным потенциалом опухоли. Полученные данные по метаболомике стероидов методом ГХ-МС играют дополнительную, а в некоторых случаях определяющую роль в решении вопроса о необходимости хирургического лечения.
Заключение
Методом ГХ-МС у больных АСК и ВАСК установлено снижение экскреции с мочой метаболитов андростендиона и дегидроэпиандростерона, признаки уменьшения активности 11β-HSD 2 типа и 11β-гидроксилазы, Увеличение экскреции с мочой тетрагидрометаболитов кортизола, кортизона, кортикостерона и 11-дезоксикортизола, кортолов и кортолонов у пациентов с АСК по сравнению с показателями больных ВАСК свидетельствует о большем повышении глюкокортикоидной функции коры надпочечников в данной группе. У пациентов с ИН с уровнем кортизола после ПДТ с 1 мг меньше 50 нмоль/л установлены различные нарушения метаболомики стероидов по данным ГХ-МС: у 10,6% – признаки недостаточности 21-гидроксилазы, у 58,9% – признаки недостаточности 11β-гидроксилазы и 17α-гидроксилазы, увеличение экскреции с мочой андрогенов, глюкокортикоидов и тетрагидрометаболитов предшественников альдостерона (ТНВ, THA, ТНDOC), Признаки повышения активности 5α-редуктазы получены у больных с 21-ГН, увеличения активности 5β-редуктазы – у пациентов с АСК. У оперированных больных с ИН установлены положитедьные корреляции экскреции с мочой этиохоланолона, DHEA и его метаболитов со злокачественным потенциалом опухоли, определены 5-еne-прегнены, не обнаруженные у пациентов с ГНА. Полученные результаты при исследовании СПМ методом ГХ-МС играют важную роль в определении тактики и объема хирургического лечения пациентов с ИН.


