Введение
В Российской Федерации (РФ), как и во всем мире, продолжает увеличиваться число больных сахарным диабетом (СД). По данным федерального регистра СД в РФ на окончание 2016 г. состояли на диспансерном учете 4,35 млн человек (3,0% населения), из них 4 млн (92%) – это пациенты с СД 2 типа (СД2) [1]. Также в настоящее время отмечается рост числа больных первичным гипотиреозом. Причем частота гипотиреоза у больных СД2 значительно выше, чем в общей популяции, и составляет, по данным разных авторов, от 6,8 до 31,4% [2–4]. Снижение функции щитовидной железы у пациентов с СД усугубляет уже имеющиеся нарушения углеводного обмена, инсулинорезистентность, атерогенную дислипидемию, тем самым повышая риск развития и способствуя прогрессированию микро- и макрососудистых осложнений СД [5].
В большинстве случаев СД2 развивается на фоне избыточной массы тела или ожирения различной степени. Одним из самых частых симптомов, сопровождающих гипотиреоз, также является повышение массы тела. Жировая ткань представляет собой гормонально активную систему, в которой синтезируется ряд биологически активных веществ – адипокинов, оказывающих влияние на многие обменные процессы в организме [6]. В настоящее время активно изучается роль различных адипокинов в формировании ожирения, инсулинорезистентности, атеросклероза и их влияние на развитие и течение различных заболеваний.
Цель исследования: оценить взаимосвязь уровня резистина и гормонально-метаболических показателей у больных гипотиреозом, СД2 и их сочетанием.
Методы
Были обследованы 119 женщин в возрасте от 45 до 74 лет. Было сформировано 3 клинические группы.
В первую группу вошли 42 женщины с первичным манифестным гипотиреозом, средний возраст которых составил 58,00 (52,00–62,25) лет, а индекс массы тела (ИМТ) – 27,91 [24, 31, 33; 36] кг/м2.
Во вторую группу были объединены 38 женщин с СД2, средний возраст которых был 60 (55–64) лет, а ИМТ – 31,98 (28,75–36,03) кг/м2. Третью группу составили 39 женщин с сочетанием СД2 и первичного гипотиреоза в среднем возрасте 64 (60,25–68,00) года и величиной ИМТ – 32,59 (28,65–36,40) кг/м2. Контролем служили результаты обследования 35 практически здоровых женщин. В младшую контрольную группу вошли 20 женщин в среднем возрасте 21 (20–22) год. Старшую контрольную группу составили 15 женщин в возрасте 51 (47–57) года.
Диагноз «сахарный диабет 2 типа» был поставлен на основании критериев Всемирной организации здравоохранения (ВОЗ, 2013) [1]. Диагноз первичного гипотиреоза был установлен на основании данных клинико-лабораторного обследования [7].
В группе пациенток с первичным гипотиреозом у 32 (76,2%) женщин снижение функции щитовидной железы возникло вследствие хронического аутоиммунного тиреоидита.
У 10 (23,8%) женщин гипотиреоз был послеоперационным. Медиана уровня тиреотропного гормона (ТТГ) у данных пациенток составила 1,73 (0,81–3,89) мМЕ/л, а уровня свободного тироксина (Т4св.) – 12,97 (10,83–15,28) пмоль/л. Все женщины получали лечение препаратами левотироксина: медиана дозы левотироксина – 62,5 (31,25–93,75) мкг. Среди сопутствовавших заболеваний у обследованных в этой группе были установлены ишемическая болезнь сердца (ИБС), стенокардия напряжения I и II функциональных классов у 10 (23,8%) женщин, артериальная гипертензия I и II степеней у 16 (38,1%) женщин. Диагноз ИБС, стенокардии напряжения ставился кардиологом согласно рекомендациям Всероссийского научного общества кардиологов (ВНОК, 2008). Диагноз артериальной гипертензии верифицировался в соответствии с рекомендациями ВНОК по диагностике и лечению артериальной гипертензии (2010).
Больные СД2 предъявляли жалобы на сухость во рту, учащенное мочеиспускание, общую слабость, ухудшение зрения, а также на онемение стоп, боли и судороги в икроножных мышцах, преимущественно в покое. У 6 (15,8%) женщин была диагностирована диабетическая ретинопатия, у 20 (52,6%) женщин – диабетическая полиневропатия. Кроме того, у 26 (68,4%) пациенток с СД2 была установлена артериальная гипертензия I и II степеней, у 15 (39,5%) пациенток наблюдалась ИБС, стенокардия напряжения I или II функциональных классов. Перенесенное острое нарушение мозгового кровообращения (ОНМК) в анамнезе имела 1 (2,6%) больная, перенесенный инфаркт миокарда – 2 (5,3%) пациентки. В качестве терапии СД2 все пациентки получали различные пероральные сахароснижающие препараты (препараты групп бигуанидов, производных сульфонилмочевины, ингибиторов дипептидилпептидазы-4 (ДПП-4).
Среди пациенток с сочетанием СД2 и первичного гипотиреоза наиболее частыми были жалобы на сухость во рту, общую слабость, сонливость, снижение чувствительности и боли в нижних конечностях, преимущественно в покое. Диабетическая ретинопатия была диагностирована у 17 (43,6%) пациенток в данной группе, диабетическая полиневропатия – у 32 (82,5%) .
У 25 (64,1%) пациенток была установлена ИБС, стенокардия напряжения I или II функционального класса, у 28 (78,1%) пациенток – артериальная гипертензия I или II степени. Перенесенный инфаркт миокарда в анамнезе имели 5 (12,8%) женщин, перенесенное ОНМК – 3 (7,7%). Причинами тиреоидной недостаточности в данной группе были хронический аутоиммунный тиреодит у 26 (66,7%) пациенток, а также оперативные вмешательства на щитовидной железе у 13 (33,3%) пациенток. Все обследованные женщины с сочетанием СД2 и гипотиреоза получали заместительную терапию препаратами левотироксина: медиана дозы левотироксина в данной группе составила 100,0 (50,0–106,25) мкг, уровень ТТГ – 2,06 (0,78–3,68) мМЕ/л, Т4св. – 12,75 (11,29–14,98) пмоль/л.
В качестве сахароснижающей терапии 20 (51,3%) женщин данной группы получали различные таблетированные препараты (бигуаниды, производные сульфонилмочевины, ингибиторы ДПП-4), 10 (25,6%) находились на инсулинотерапии, а 9 (23,1%) женщин получали пероральные сахароснижающие препараты в комбинации с инсулином длительного действия.
При сравнительном анализе частоты осложнений СД и сопутствующих заболеваний во всех трех группах обследованных было получено, что в группе женщин с сочетанием гипотиреоза и СД2 достоверно чаще встречались диабетическая ретинопатия (χ2=7,101; p=0,008), диабетическая полиневропатия (χ2=7,598; p=0,006), ИБС, стенокардия напряжения (χ2=4,677; p=0,031) относительно группы больных СД2. Также была установлена более высокая частота ИБС, стенокардии напряжения (χ2=11,084; p=0,000) и артериальной гипертензии (χ2=6,928; p=0,009) у женщин с сочетанием заболеваний по сравнению с группой больных гипотиреозом.
Всем обследованным пациенткам были измерены рост, масса тела, окружность талии (ОТ), окружность бедер (ОБ) с последующим расчетом отношения ОТ/ОБ и ИМТ по формуле (ВОЗ (1997): ИМТ=масса тела (кг)/рост (м2). Степень ожирения оценивали по классификации ВОЗ (1997): при значении ИМТ 25–29,9 кг/м2 диагностировали избыточную массу тела: 30–34,9 кг/м2 – I степень ожирения, 35–39,9 кг/м2 – II степень ожирения, 40 кг/м2 и более – III степень ожирения. Тип ожирения определяли по величине отношения ОТ/ОБ: глютеофеморальный тип у женщин диагностировали при величине ОТ/ОБ<0,85, абдоминальный – при ОТ/ОБ≥0,85.
Всем пациенткам был произведен забор крови из вены натощак. Определяли концентрацию глюкозы в плазме, уровень иммунореактивного инсулина (ИРИ), показатели липидного спектра (общий холестерин – ОХС, холестерин липопротеидов низкой плотности – ЛПНП, триглицериды – ТГ, холестерин липопротеидов высокой плотности – ЛПВП). Также методом иммуноферментного анализа исследовали концентрацию резистина. На основании полученных данных был произведен расчет коэффициента атерогенности (КА) и индекса инсулинорезистентности HOMA-IR (Homeostasis Model Assessment of Insulin Resistance). КА рассчитывался по формуле: КА=(ОХ-ЛПВП)/ЛПВП. Повышение показателя КА более 3,0 ассоциировано с высоким риском развития атеросклероза. Индекс HOMA-IR рассчитывался по формуле: HOMA-IR=ИРИ х гликемия натощак/22,5. Значение индекса HOMA-IR более чем 2,77 свидетельствовало о наличии у пациентки инсулинорезистентности.
Статистическая обработка полученных данных проводилась с использованием различных методов. Для анализа качественных признаков строились таблицы сопряженности с расчетом χ2-критерия. При описании полученных результатов использовали медиану 25-го и 75-го процентилей: Ме (25–75). Поскольку полученные в ходе обработки материала данные не подчинялись нормальному закону распределения, применялись непараметрические методы математической статистики – ранговый корреляционный метод Спирмена, однофакторный непараметрический дисперсионный анализ Краскела–Уоллиса и критерий Манна–Уитни. При проверке всех гипотез использовался уровень значимости р<0,05. Статистическая обработка результатов проводилась на компьютере с помощью Microsoft Excel 2010 и пакета программ SPSS 11.5 (SPSSInc., США).
Результаты исследования
Величина ИМТ в группах больных СД2 и его сочетанием с гипотиреозом составила 31,98 (28,75–36,030 и 32,59 (28,65–36,40) кг/м2 соответственно, соответствовала I степени ожирения и достоверно превышала величину ИМТ обеих контрольных группах (p<0,05). Медиана ОТ у женщин с СД2 составила 102,00 (92,00–112,50) см, у женщин с СД2 и гипотиреозом – 104,00 (94,00–115,00) см. Отношение ОТ/ОБ у женщин данных групп было 0,92 (0,88–0,97) и 0,90 (0,86–0,95) соответственно. Таким образом, величина ОТ более 88 см и отношение ОТ/ОБ более 0,85 у женщин с СД2 и его сочетанием с гипотиреозом позволили говорить о развитии у них абдоминального ожирения.
У женщин с гипотиреозом значение ИМТ соответствовало избыточной массе тела – 27,91 (24,33–31,36) см и достоверно превышало значение только младшей контрольной группы (p<0,001)
Анализ показателей липидного обмена позволил обнаружить наличие признаков атерогенной дислипидемии во всех трех группах обследованных (табл. 1).
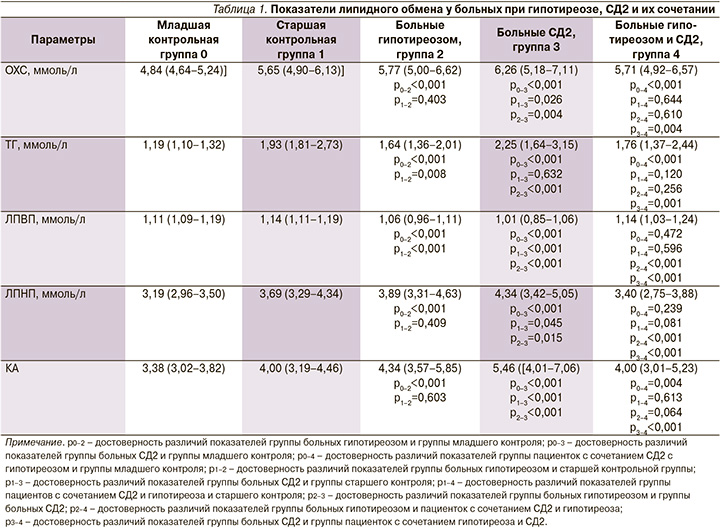
У женщин с гипотиреозом, СД2 и их сочетанием были достоверно повышены уровни ОХС, ТГ, а также значение КА по сравнению с младшей контрольной группой (p<0,001). Уровень ТГ в группе больных гипотиреозом положительно коррелировал с величиной ОТ (r=0,223; p=0,032) и ОБ (r=0,247; p=0,018). У пациенток с СД2 отношение ОТ/ОБ положительно коррелировало с уровнем ОХС (r=0,181; p=0,028), ТГ (r=0,198; p=0,016) и отрицательно – с ЛПВП (r=-0,255; p=0,002). Это может свидетельствовать о роли висцерального ожирения в развитии атерогенных нарушений при СД2.
Наличие атерогенной дислипидемии как при СД2, так и при гипотиреозе установлено также в работах других авторов [5, 8–10]. При этом в ряде работ показано, что при сочетании гипотиреоза и СД2 нарушения липидного обмена выражены значительнее по сравнению с изолированным течением этих заболеваний [8, 9]. По нашим данным, максимальные изменения показателей липидного обмена отмечались в группе больных СД2: было также установлено достоверное повышение уровней ОХС, ЛПНП и КА относительно старшей группы контроля.
Исследованные показатели углеводного обмена представлены в табл. 2.
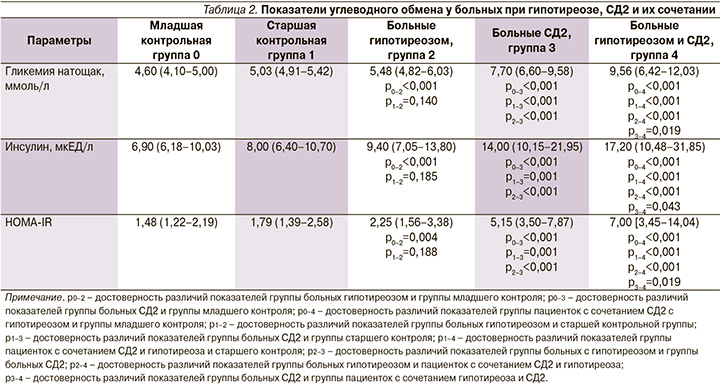
Было выявлено, что в группе больных гипотиреозом уровень глюкозы соответствовал диапазону нормальных значений, хотя при этом достоверно превышал аналогичный показатель младшей контрольной группы (p<0,001). Гликемия у пациенток с СД2 и пациенток с сочетанием СД2 и гипотиреоза достоверно превышала аналогичный показатель как контрольных групп, так и группы женщин с гипотиреозом (p<0,001). При этом при сочетании гипотиреоза и СД2 гипергликемия была максимальной и достоверно превышала показатель гликемии пациенток только с СД2 (p<0,05).
У обследованных с СД2 и его сочетанием с гипотиреозом также выявлена инсулинорезистентность, которая сопровождалась гиперинсулинемией. Наиболее выражены эти нарушения, как и гипергликемия, были в группе женщин с сочетанием СД2 и гипотиреоза. Можно предположить, что снижение функции щитовидной железы способствует ухудшению компенсации СД2.
При анализе уровня инсулина и индекса HOMA-IR у больных гипотиреозом выявлено повышение данных показателей у пациенток этой группы по сравнению с группой младшего контроля (p<0,05). В работе И.Ю. Капраловой [11] также было показано снижение чувствительности к инсулину у пациенток с первичным гипотиреозом.
В группах пациенток с СД2 и его сочетанием с гипотиреозом выявлены положительные корреляции индекса HOMA-IR с ИМТ (r=0,380; p<0,001 и r=0,294; p=0,025 соответственно), отношением ОТ/ОБ (r=0,167; p=0,049 и r=0,340; p=0,010 соответственно), уровнем гликемии (r=0,393; p=0,001 и r=0,701; p<0,001 соответственно). В группе пациенток с гипотиреозом также выявлены положительные корреляции HOMA-IR с ИМТ (r=0,493; p<0,001), отношением ОТ/ОБ (r=0,218; p=0,038) и глюкозой плазмы (r=0,280; p=0,006). Данные корреляции могут свидетельствовать о роли висцерального ожирения в развитии инсулинорезистентности у пациенток с СД2 и гипотиреозом.
У больных гипотиреозом и больных СД2 установлено достоверное повышение концентрации резистина относительно групп младшего и старшего контроля (табл. 3).

Уровень этого адипокина у пациенток с сочетанием заболеваний не отличался значимо от его содержания у лиц контрольных групп, что можно объяснить, по-видимому, разбросом данных. При этом в данной группе выявлена положительная корреляция резистина с уровнем инсулина (r=0,466; p=0,001) и HOMA-IR (r=0,388; p=0,003), что может свидетельствовать о влиянии этого адипокина на инсулинорезистентность. В группе женщин с СД2 резистин положительно коррелировал с уровнем ОХС (r=0,212; p=0,041), ТГ (r=0,247; p=0,017) и ЛПНП (r=0,277; p=0,007). У пациенток с гипотиреозом выявлена отрицательная корреляция резистина и глюкозы крови (r=-0,333; p=0,008).
В литературе представлены различные данные о содержании резистина у пациенток с СД2 и гипотиреозом.
В ряде работ показано повышение концентрации резистина и при гипотиреозе, и при СД2 [10, 11]. А.В. Пашенцева в своей работе также сообщает о гиперрезистинемии у пациенток с СД2 [12]. В то же время имеются данные о том, что уровень резистина при снижении функции щитовидной железы значимо не отличается от контрольных значений [13]
Выводы
У обследованных пациенток с СД2 и его сочетанием с гипотиреозом на фоне висцерального ожирения установлены гипергликемия, инсулинорезистентность и гиперинсулинемия.
У больных гипотиреозом отмечена тенденция к снижению чувствительности к инсулину. Максимально выражены инсулинорезистентность и гиперинсулинемия в группе пациенток с сочетанием СД2 и гипотиреоза.
Во всех трех группах обследованных больных выявлена атерогенная дислипидемия, которая характеризовалась повышением уровней ОХС, ТГ ЛПНП, КА.
У больных гипотиреозом и больных СД2 установлено достоверное повышение уровня резистина. Резистин влияет на развитие инсулинорезистентности у больных СД2 и гипотиреозом, о чем свидетельствует положительная корреляционная зависимость индекса HOMA-IR и этого адипокина.


