Введение
Злокачественные опухоли двенадцатиперстной кишки (ДПК) являются относительно редкой патологией. Лейомиосаркома ДПК представляет собой опухоль соединительной ткани гладкой мускулатуры ДПК, составляя 0,2% от злокачественных новообразований желудочно-кишечного тракта [1]. Как правило, заболевание развивается медленно, начало его проявляется маловыраженными и неспецифическими клиническими признаками, присущими многим заболеваниям желудочно-кишечного тракта. Этим скорее всего объясняется позднее обращение пациентов за специализированной помощью и большой процент случаев с запущенным опухолевым процессом. Наиболее характерным клиническим признаком злокачественного поражения ДПК является болевой синдром [2, 3]. Лейомиосаркома ДПК резистентна к химио- и лучевой терапии [4]. Прогноз неблагоприятный [5]. Известно, что размер опухоли и сосудистая инвазия являются надежным прогностическим фактором [6]. По данным литературы, правильный предоперационный диагноз устанавливается приблизительно в 50% случаев. Наиболее информативным методом диагностики остается фиброгастродуоденоскопия [7]. Использование этого метода позволяет не только визуально оценивать размеры опухоли, уточнять локализацию процесса, но и выполнять биопсию новообразования для последующего гистологического исследования. Правильная интерпретация эндоскопической картины может быть затруднена в поздних стадиях при возникновении деформаций и сужений ДПК, вовлечении в опухолевый процесс соседних органов, в первую очередь головки поджелудочной железы. Диагностика при дуоденоскопии включает установление признаков, характерных для рака или саркомы; определение первичной локализации; дифференциальную диагностику с первичными опухолями поджелудочной железы и большого дуоденального соска; биопсию опухолевой ткани. Основным методом лечения злокачественных новообразований ДПК остается хирургический. Объем и вид проводимой операции зависят от распространенности первичной опухоли, степени ее дифференцировки, наличия отдаленных метастазов. В качестве радикальной операции при опухолях ДПК остается гастропанкреатодуоденальная резекция (ГПДР) с удалением регионарного лимфатического аппарата и большого сальника или пилосохраняющая ПДР [8, 9]. Пятилетняя выживаемость после радикальной операции, по данным различных источников, колеблется в пределах 15–67%, в среднем составляя около 40% [10–12]. В случае рецидива заболевания или при диссеминации процесса медиана выживаемости не превышает 10–20 месяцев [10]. К моменту диагностики злокачественных опухолей у 15–50% пациентов обнаруживаются метастазы, что исключает радикальное хирургическое лечение [10, 13–15]. Химиотерапия чаще всего проводится в неоадъювантном и адъювантном режимах, включающих 5-фторурацил в сочетании с митомицином, доксорубицином, ломустином, препаратами платины [10]. Применение лучевой терапии возможно как в сочетании с радикальной операцией, так и с паллиативной целью.
По литературным данным, применение лучевой терапии в отношении пациентов, не подвергавшихся оперативному лечению, значительно увеличивает продолжительность жизни (медиана выживаемости пациентов, прошедших курс лучевой терапии, составила 30,5, не прошедших – 7,1 месяца), в то время как ее сочетание с радикальной операцией особого влияния на прогноз не оказывает [16]. Описываемый нами случай является ярким примером сложности в диагностике при опухолях гепатопанкреатодуоденальной зоны и демонстрирует высокий процент диагностических ошибок с таким осложнением, как профузное кровотечение.
Клинический случай
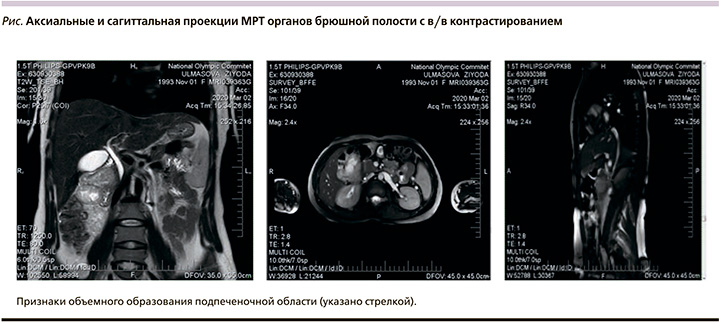
Пациентка У. 27 лет 22.02.2020 в экстренном порядке была госпитализирована в Республиканский научный центр экстренной медицинской помощи с диагнозом «желудочно-кишечное кровотечение неясной этиологии. Постгеморрагическая анемия тяжелой степени». После оказания первой медицинской помощи при выполнении диагностических исследований по данным ультразвукового исследования установлен диагноз «образование в брюшной полости». Больная обратилась 27.03.2020 в консультативную поликлинику ТГФ РСНПЦОиР, где в амбулаторных условиях была выполнена магнитно-резонансная томография (МРТ) органов брюшной полости с внутривенным (в/в) контрастированием от 02.03.2020, при которой в подпеченочной области выявлено объемное образование с интенсивным неравномерным накоплением контрастного вещества неправильной формы кистозно-солидной структуры с прорастанием в желчный пузырь, печеночный изгиб ободочной кишки с компримированием головки поджелудочной железы размером 6,2×5,7×7,6 см (см. рисунок). Заключение: МРТ-признаки объемного образования подпеченочной области с прорастанием в желчный пузырь, печеночный изгиб ободочной кишки.
Обзорная R-графия органов грудной клетки от 27.02.2020: хронический бронхит.
Ирригография от 4.03.2020: небольшое сдавление печеночного угла толстой кишки. Долихосигма. Маловыраженный катаральный колит.
Состояние больной средней степени тяжести, ECOG-2. Анемия 3-й ст. (гемоглобин – 70 г/л).
При осмотре в области эпигастрия и правом подреберье брюшной полости пальпируется образование без четких контуров, ограниченно смещаемое, размером 10,0×9,0×8,0 см. Асцита нет. Симптомов раздражения брюшины нет.
Больная взята на операцию 13.03.2020. Ревизия: в проекции нисходящего отдела ДПК определяется опухолевый конгломерат размером 10×9×7 см, включивший ДПК, брыжейку печеночного изгиба ободочной кишки и поперечно-ободочной кишки, правую половину большого сальника. Со стороны печени, желчного пузыря, желудка, тонкой и толстой кишки видимых патологических изменений не выявлено. В петлях тонкой кишки обнаружена жидкость геморрагического характера. При этом после ревизии хирургу не удавалось определить органную принадлежность опухоли. Принято решение о проведении комбинированно-расширенной операции. Опухолевый конгломерат мобилизован острым путем. Резекция правой половины большого сальника, иссечение брыжейки печеночного изгиба ободочной кишки и поперечно-ободочной кишки в пределах здоровой ткани. На этом этапе удалось окончательно установить, что опухоль исходит из передней стенки нисходящего отдела ДПК. Опухоль иссечена радикально. Интраоперационно при срочном морфологическом исследовании края резекция интактны. Целостность стенки ДПК восстановлена путем наложения атравматических швов в два ряда без нарушения проходимости. Операция завершена с адекватным дренированием и послойным ушиванием раны.
Макропрепарат: органокомплекс: часть большого сальника, брыжейка печеночного изгиба ободочной кишки и поперечно-ободочной кишки, забрюшинная клетчатка, передняя стенка нисходящей части ДПК с опухолью.
Патогистологическое исследование № 19619/2020: лейомиосаркома, G-2.
Течение послеоперационного периода гладкое. Заживление первичное. На 11-е сутки больная выписана под наблюдение онколога и хирурга по месту жительства. По данным планового морфологического исследования удаленного препарата в крае резекции, жировой клетчатке опухолевого роста нет. В 2 из 18 исследованных лимфатических узлов – метастаз лейомиосаркомы. Опухоль стадирована как pT3N1M0. Данных за рецидив и наличие метастазов не выявлено (период наблюдения – 5 месяцев). Пациентка находится под динамическим наблюдением.
Обсуждение
Впервые случай лейомиосаркомы ДПК был описан Вон Салисом в 1920 г. [17]. Частота встречаемости лейомиосаркомы по сравнению с аденокарциномой ДПК ниже. Так, при анализе 474 карцином ДПК было зарегистрировано 40 случаев с лейомиосаркомой [18]. Опухоли ДПК не имеют специфических клинических проявлений, длительное время они могут протекать бессимптомно, что делает затруднительным раннюю диагностику заболевания. При экзофитном росте опухоли часто подвергаются распаду. В этом случае внутрикишечное кровотечение может быть первым признаком заболевания. Приведенный клинический случай показывает, что, несмотря на выполнение комплекса общепринятых диагностических процедур, дооперационное определение топики осложненного течения опухолевого процесса затруднительно. Алгоритм лечения пациентов со злокачественными опухолями ДПК должен основываться на своевременной морфологической и иммуногистохимической верификации опухоли и тщательной оценке операбельности процесса, а наличие регионарных лимфогенных метастазов требует комплексной терапии с включением химиолучевого лечения. Задачей данной публикации является повышение онконастороженности среди хирургов, оказывающих ургентную помощь при неотложных состояниях онкологических пациентов.
Заключение
Алгоритм лечения пациентов со злокачественными опухолями ДПК должен основываться на своевременной морфологической и иммуногистохимической верификации опухоли и тщательной оценке операбельности процесса, а наличие регионарных лимфогенных метастазов требует комплексной терапии с включением химиолучевого лечения. Задачей данной публикации является повышение онконастороженности среди хирургов, оказывающих ургентную помощь при неотложных состояниях онкологических пациентов.


