Введение
Исследования в реальной клинической практике становятся все более важными для доказательства эффективности и безопасности лечения пациентов. Безусловно, рандомизированные клинические исследования (РКИ) по-прежнему остаются «золотым» стандартом для оценки безопасности и эффективности новых лекарственных препаратов: именно на основе их результатов осуществляется регистрация препаратов. Вместе с тем обязательное следование строгим критериям включения и исключения пациентов из РКИ означает, что включенная популяция часто не репрезентативна тем пациентам, которые встречаются в реальной клинической практике. Поэтому как лечащие врачи, так и руководители здравоохранения, а также профессиональные сообщества заинтересованы в получении данных об эффективности и безопасности того или иного препарата для групп пациентов, более репрезентативных для повседневной клинической практики. Например, по данным одного из исследований, среди 334 пациентов с бронхиальной астмой (БА), посещавших врача, только 11 (3,3%) соответствовали обычным критериям включения в РКИ по БА: имели подтвержденный диагноз БА и персистирующие симптомы, объем форсированного выдоха за 1-ю секунду (ОФВ1) 50–85% должного значения, обратимость бронхиальной обструкции 12% и 200 мл, не имели значимых сопутствующих заболеваний, индекс курения меньше 10 пачка/лет, регулярно применяли ингаляционные кортикостероиды (ИГКС) [1]. В отличие от РКИ в исследования в реальной клинической практике включается широкая группа пациентов разного возраста, с различными сопутствующими заболеваниями, вредными привычками и различным образом жизни. В этих исследованиях может использоваться информация из электронных баз данных о состоянии здоровья и предписанном лечении, которые предоставляют большие наборы данных, полученных от разных популяций пациентов и/или они могут быть наблюдательными, собирающими проспективные или ретроспективные данные за длительный период времени. Таким образом, эти исследования могут предоставлять информацию о долгосрочной эффективности и безопасности лекарственного препарата в большой разнородной группе пациентов, а также информацию о возможных режимах и схемах длительного применения и экономической выгоде, что особенно важно для препаратов биологической терапии.
Тяжелая БА (ТБА) – гетерогенное, нередко сложно курируемое заболевание, при котором клинический контроль не достигается на фоне хорошей приверженности пациентов максимальной оптимизированной терапии, соответствующей 4–5-й ступеням по GINA (Global Initiative for Asthma), и лечения/устранения состояний, усугубляющих течение заболевания, или же ухудшается при попытках снизить высокие дозы препаратов [2]. Распространенность ТБА составляет 3–10% от общей популяции больных БА [3]. Ранее ТБА рассматривалась в качестве синонима «астмы, рефрактерной к терапии», т.к. в качестве одного из критериев ТБА выступала относительная рефрактерность к высоким дозам ИГКС в сочетании с другими препаратами [4]. Внедрение в клиническую практику генно-инженерных биологических препаратов позволило изменить это восприятие [3].
Наиболее распространенным является патогенетический вариант ТБА с преобладанием T2-воспаления, при котором наблюдается повышенная экспрессия цитокинов активированными Th2-лимфоцитами и/или врожденными лимфоидными клетками 2-го типа (ИЛC2-клетками) [3]. В рамках данного эндотипа выделяют фенотипы тяжелой аллергической и неаллергической БА, при которых зачастую наблюдается повышение уровня эозинофилов в крови (≥150 кл/мкл) и/или в мокроте (≥2%) [5].
Являясь характерной чертой БА, эозинофильное воспаление приобретает особую значимость именно для больных тяжелой формой заболевания, определяя их склонность к неконтролируемому стандартной фармакотерапией течению болезни, а также повышая риск неблагоприятного прогноза (более частых обострений и госпитализаций, потребность в более интенсивной базисной терапии, включая применение высоких доз ИГКС и системных ГКС) [6, 7]. Ключевую роль в пролиферации, дифференцировке, созревании эозинофилов, миграции их в ткани, а также в выживании зрелых клеток и стимулировании их цитотоксичности играет интерлейкин-5 (ИЛ-5) [8]. Этот цитокин секретируется многими клетками, такими как Th2-лимфоциты, тучные клетки, лимфоидные клетки врожденного иммунитета 2-го типа (ИЛC2), эозинофилы и базофилы [9]. В связи с этим вспомогательная терапия, направленная на подавление действия ИЛ-5, может значительно улучшить течение ТБА эозинофильного профиля.
Эффективность меполизумаба в лечении ТБА по данным РКИ
Меполизумаб – препарат гуманизированных моноклональных антител иммуноглобулина G1 (IgG1), связывающих и инактивирующих ИЛ-5.
В опорных РКИ больных ТБА (с исходным уровнем эозинофилов крови ≥150 кл/мкл на начало исследования или ≥300 кл/мкл на протяжении предшествовавших 12 месяцев), а также с повторяющимися обострениями (≥2 за последние 12 месяцев) и/или зависимостью от системных ГКС меполизумаб при подкожном (п/к) введении в дозе 100 мг каждые 4 недели уменьшал частоту обострений на 53–58% по сравнению с плацебо [10, 11], позволял снижать дозу оральных ГКС (ОГКС) в среднем на 50% по сравнению с плацебо [12], значительно улучшал качество жизни и контроль заболевания [11, 12], а также увеличивал ОФВ1 до и после пробы с бронходилататором [10].
В исследованиях меполизумаб продемонстрировал эффективность в отношении снижения частоты обострений у больных тяжелой Т2-астмой как при умеренном повышении уровня эозинофилов в крови (снижение против плацебо на 57 и 64% при исходном уровне эозинофилов ≥150 и ≥300 кл/мкл крови соответственно), так и при выраженной эозинофилии крови (уменьшение частоты обострений на 70 и 85% по сравнению с результатом плацебо при исходном значении эозинофилов крови ≥400 и ≥750 кл/мкл соответственно). Также более высокий уровень эозинофилов в крови на начало терапии соответствовал более выраженному влиянию на контроль астмы и качество жизни больных [13].
Клиническая эффективность меполизумаба в виде снижения частоты обострений ТБА проявлялась у пациентов как с положительным атопическим статусом, так и с отрицательным результатом обследования на сенсибилизацию к аэроаллергенам (снижение частоты обострений на 56 и 57% по сравнению с результатом плацебо соответственно). Исходный уровень общего IgE также не влиял на эффективность меполизумаба в отношении снижения частоты обострений у больных ТБА эозинофильного профиля [14].
Ретроспективный анализ исследования DREAM, включившего пациентов как с положительным атопическим статусом, так и без него, подтвердил, что исходное значение FeNO (в отличие от уровня эозинофилов крови на начало лечения) не является значимым предиктором эффективности для меполизумаба. При уровне эозинофилов в крови ≥150 кл/мкл препарат продемонстрировал значимое снижение частоты обострений и улучшение функции легких как в группе с высоким значением FeNO (≥25 ppb), так и у пациентов с низким уровнем данного биомаркера (<25 ppb) [15].
В исследовании OSMO меполизумаб продемонстрировал эффективность для больных тяжелой Т2-астмой с уровнем эозинофилов крови ≥150 кл/мкл и предшествовавшим опытом неуспешной анти-IgE-терапии (омализумаб) [16].
В ретроспективном совокупном анализе исследований MENSA и MUSCA у пациентов с исходным уровнем эозинофилов крови ≥300 кл/мкл наблюдалось снижение частоты обострений на фоне терапии меполизумабом по сравнению с плацебо на 63%, 69 и 72% при наличии соответственно ≥2, ≥3 и ≥4 обострений за предшествовавшие терапии 12 месяцев. Таким образом, так же как и влияние более высокого уровня исходной эозинофилии крови, анамнез более частых обострений БА за предшествовавший началу терапии год ассоциировался с более выраженным снижением частоты обострений [13].
Применение меполизумаба в фиксированной дозе 100 мг подкожно каждые 4 недели оказалось эффективным для пациентов как с нормальной, так и с избыточной массой тела и ожирением. В ретроспективном анализе объединенных данных исследований MENSA и MUSCA независимо от массы тела и индекса массы тела (ИМТ) меполизумаб эффективно уменьшал уровень эозинофилов крови, снижал частоту клинически значимых обострений, а также демонстрировал статистически значимое улучшение качества жизни и контроля БА [13].
Результаты РКИ критичны для заключения об эффективности и безопасности исследуемой терапии, поскольку их дизайн минимизирует влияние на результат любых других возможных факторов. Однако выше уже упоминалось, что данные РКИ сложно распространить на всю популяцию больных в реальной практике. В первую очередь это связано с жесткими критериями включения пациентов в исследование, а также с ограниченным выбором конечных точек. Поэтому доказательная база клинических исследований биологических препаратов нуждается в дополнении данными наблюдательных исследований, в которых исследуемая терапия применяется в широкой популяции пациентов в условиях рутинной клинической практики [17].
Исходные характеристики популяций больных ТБА, получающих меполизумаб, в открытых наблюдательных исследованиях и РКИ
Первые открытые наблюдательные исследования применения меполизумаба в условиях обычных пульмонологических отделений были небольшими, одноцентровыми и включали менее 50 пациентов [18–21]. В дальнейшем число пациентов, длительно получавших меполизумаб, в открытых наблюдательных исследованиях увеличилось. Так, ретроспективное когортное исследование в США [22] и австралийский регистр пациентов, получавших меполизумаб AMR (Australian Mepolizumab Registry), включали более чем по 300 участников [23]. Полученные данные свидетельствовали о том, что популяция пациентов в реальной практике отличается от строгих условий РКИ. В частности, авторы исследования сравнили исходные характеристики пациентов регистра AMR с участниками РКИ MENSA [10] и MUSCA [11]. Пациенты из регистра AMR были не только старше, но и статистически значимо чаще страдали ожирением, имели меньший уровень обратимости бронхиальной обструкции, более низкий уровень контроля заболевания, более высокое число эозинофилов крови и бо́льшую частоту обострений за последний год.
Их продолжительность БА была в среднем на 10 лет больше, чем в РКИ [23].
Значительная часть пациентов в исследованиях реальной практики имели одно или несколько сопутствующих заболеваний, среди которых самыми частыми оказались хронический риносинусит, полипоз носа, гастроэзофагеальная рефлюксная болезнь (ГЭРБ), аллергический ринит, ожирение, бронхоэктазы, остеопороз, сахарный диабет, обструктивное апноэ сна, сердечно-сосудистая патология [18–23].
Доля пациентов, получавших постоянную поддерживающую терапию ОГКС, почти во всех опубликованных исследованиях реальной практики была больше, чем в РКИ (кроме исследования SIRIUS, где степень снижения дозы ОГКС была первичной конечной точкой и исходно их получали все участники), варьируясь от 47 [23] до 92,8% [24]. При этом, если средняя суточная доза ОГКС в эквиваленте преднизолона в группах п/к меполизумаба в РКИ MENSA, MUSCA и SIRIUS составляла 12,5–12,6 мг [10–12], то в наблюдательных исследованиях она могла быть как ниже (6,25–8,5 мг) [25–27], так и значительно выше (>20 мг) [24, 28]. Исходное среднее число обострений на 1 пациента в год в группах п/к меполизумаба составляло 3,8 в MENSA [10], 2,9 в MUSCA [11] и 3,3 в SIRIUS [12]. В 4 из 9 наблюдательных исследований этот показатель был выше 4 [23, 24, 29, 30]; в остальных число обострений было сопоставимым с РКИ.
Отметим, что пострегистрационные наблюдательные исследования продемонстрировали склонность к назначению меполизумаба пациентам с исходно более выраженной периферической эозинофилией на начало лечения и/или в течение предшествовавших 12 месяцев (>400 кл/мкл) по сравнению со средними и медианными значениями уровней эозинофилов в крови участников РКИ [10–12, 24, 31]. Потенциально это могло быть связано с тем, что меполизумаб резервировался для более тяжелых больных, поскольку, по данным РКИ, при более выраженной исходной эозинофилии крови отмечен наиболее яркий клинический эффект меполизумаба при ТБА.
Результаты лечения больных ТБА меполизумабом в открытых наблюдательных исследованиях и РКИ
В исследованиях реальной клинической практики, включивших >50 участников, оценивались такие показатели, как число обострений БА на фоне терапии и суточная доза ОГКС в эквиваленте преднизолона (и/или доля пациентов, которым удалось отменить поддерживающую терапию ОГКС). Статистически значимое снижение числа обострений в расчете на 1 пациента в год наблюдалось во всех случаях, хотя авторы могли использовать разные определения обострения. Лишь в исследовании J.-P. Llanos et al. (2020) снижение частоты обострений составило 38,4% [29], в других число обострений на фоне терапии меполизумабом уменьшилось на 54–89%, т.е. либо соответствовало величине, полученной в РКИ при сравнении с плацебо, либо значительно превышало ее (табл. 1).
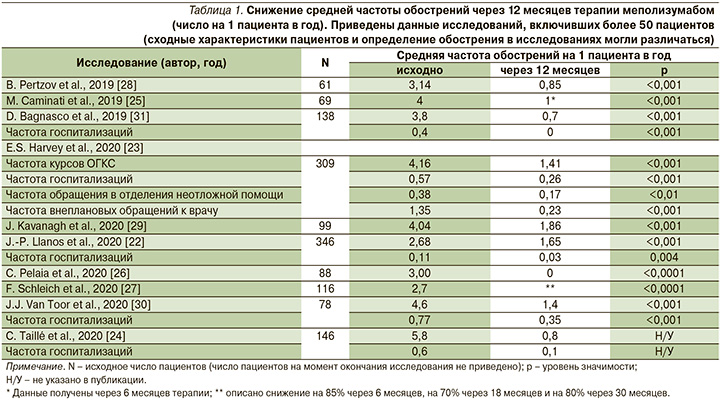
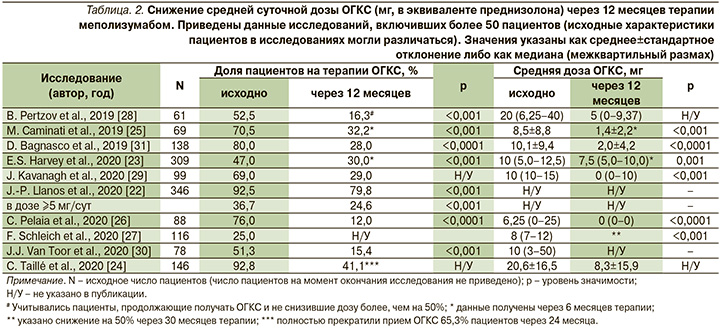
В РКИ SIRIUS доза ОГКС на фоне терапии меполизумабом снизилась на 50% от исходного значения, при этом 23% пациентов поддерживающую терапию ОГКС удалось отменить [12]. В большинстве наблюдательных исследований [24–26, 28–31] отмечено еще более выраженное влияние меполизумаба на снижение дозы ОГКС и долю пациентов, прекративших их прием. Значительное улучшение было достигнуто даже в популяциях пациентов, где исходная средняя доза ОГКС составляла около 20 мг [24, 28] (табл. 2).
Уровень контроля ТБА оценивался в большинстве исследований с использованием теста по контролю астмы – АСТ (Asthma Control Test)-тест [25–27, 31] и/или опросника по контролю БА (ACQ-5, ACQ-6) [23, 27, 29, 30]. Во всех случаях отмечено статистически значимое улучшение контроля. В исследовании AMR [23] авторы сравнили степень улучшения контроля БА на фоне терапии меполизумабом с популяцией РКИ MENSA и MUSCA. Несмотря на то что пациенты в реальной практике были старше, чаще получали поддерживающую терапию ОГКС, имели более длительный анамнез БА, худший исходный уровень контроля по ACQ-5 и более высокое число эозинофилов крови, эффект меполизумаба в отношении контроля БА у них оказался более выраженным [23].
Качество жизни до и после терапии в исследованиях реальной практики оценивалось по опроснику AQLQ, [23, 27–29]. Во всех случаях улучшение показателя на фоне терапии меполизумабом было статистически значимым. Кроме того, в подавляющем большинстве исследований отмечено статистически значимое увеличение ОФВ1 по сравнению с исходным значением [23–28, 30, 31]. Только в одном опубликованном исследовании (J. Kavanagh et al., 2020) не было выявлено статистически значимых различий по значению ОФВ1 [29]. Мак-симальное увеличение ОФВ1 было достигнуто в популяции исследования D. Bagnasco et al. (2019), составив +340 мл через 12 месяцев (p<0,001) [31].
В РКИ меполизумаб продемонстрировал значимое влияние на выраженность эозинофильного воспаления, снизив уровень эозинофилов крови и мокроты. В большинстве открытых наблюдательных исследований, так же как и в опорных РКИ, содержание эозинофилов снизилось до уровня <100 кл/мкл, причем этот эффект был достигнут в течение первых 1–3 месяцев и поддерживался в течение всего периода наблюдения [23, 25, 28, 31].
В исследовании F. Schleich et al. (2020) было выявлено влияние терапии меполизумабом на содержание эозинофилов в мокроте, уровень которых снизился на 60% через 6 месяцев терапии [27].
Обращает на себя внимание следующее: в двух открытых наблюдательных исследованиях D. Bagnasco et al. (2019) и M. Caminati et al. (2019) отмечено снижение уровня фракционного оксида азота выдыхаемого воздуха (FeNO) в ходе лечения меполизумабом на протяжении 6 и более месяцев [25, 31]. Отметим, что в данных исследованиях исходный уровень FeNO был значимо повышен и составлял 75±53 ppb (частей на миллиард) [31] и 77,7±44,5 ppb [25] соответственно. Это согласуется с данными исследования AMR, согласно которым более высокий исходный уровень FeNO прямо коррелировал с достижением или улучшением контроля при терапии меполизумабом [23].
Некоторые аспекты безопасности меполизумаба в лечении ТБА по данным опубликованных исследований реальной клинической практики
Во всех исследованиях имела место хорошая переносимость меполизумаба. По совокупным данным, самыми частыми побочными эффектами были головная боль, тошнота, боль в спине, локальные реакции в месте инъекции. По данным отдельных авторов, головная боль чаще отмечалась после первой инъекции и становилась меньше в течение 6 месяцев терапии [30]. Из аллергических проявлений это сыпь/крапивница; был описан один случай ангионевротического отека [23], не было зарегистрировано анафилактических реакций.
В исследовании AMR общая частота зарегистрированных побочных эффектов составила 18,8%, из которых чаще всего встречалась головная боль (9,9%). Только у 6 (1,9%) пациентов побочные эффекты привели к прекращению терапии. В 2 случаях это была головная боль, в 1 – сыпь, в 1 – артралгия, в 1 – зуд и в 1 – боль в спине. Было отмечено 25 серьезных побочных эффектов, среди которых наблюдалось 2 летальных исхода. Причины обоих летальных исходов (ишемическая болезнь сердца, острый инфаркт миокарда) были расценены как не связанные с проводимой терапией [23].
В итальянском исследовании C. Lombardi et al. (2019) по оценке частоты и причин прекращения терапии меполизумабом в реальной клинической практике частота выбывания пациентов из программы лечения была ниже, чем в РКИ и ряде других наблюдательных исследований. Из 143 пациентов прекратили терапию 6 (4,2%). В 5 случаях имело место отсутствие эффекта (двое из этих пациентов ранее не ответили на терапию омализумабом), в 1 – побочный эффект (генерализованная крапивница). Из прочих побочных эффектов, которые не привели к прекращению терапии, самыми частыми были головная боль и легкие реакции в месте инъекции, не потребовавшие дополнительной терапии [32].
Открытое наблюдательное исследование меполизумаба у больных ТБА во Франции
Недавнее французское исследование, проведенное в рамках программы предоставления раннего доступа к препарату ATU (Temporary Authorization for Utilization, «Программа временной регистрации лекарственного препарата для использования»), включило наиболее тяжелых пациентов, состояние которых не позволяло дожидаться окончательной регистрации меполизумаба. К участию в ретроспективном наблюдательном исследовании приглашались центры на базе специализированных пульмонологических отделений университетских больниц. Требованиями для включения пациента в программу были диагноз тяжелой эозинофильной БА (без признаков эозинофильного гранулематоза с полиангиитом); отсутствие других доступных вариантов лечения; невозможность включения в РКИ; состояние, требующее срочной коррекции терапии для предотвращения тяжелых обострений и/или тяжелых побочных эффектов ОГКС [24].
Меполизумаб назначался подкожно в дозе 100 мг каждые 4 недели. В анализ вошли данные 146 пациентов, получивших >1 инъекции меполизумаба. Почти все они (92,8%) получали постоянную терапию ОГКС в средней дозе 20,6±16,5 мг в эквиваленте преднизолона, при этом переносили в среднем 5,8±4,4 обострения на 1 пациента в год, а средний уровень ОФВ1 составил у них 62±19,4% от должного значения. Аллергическая сенсибилизация была подтверждена у 62 пациентов, из них 54 (87,1%) имели сенсибилизацию к аэроаллергенам (пыльцевые, эпидермальные, плесневые аллергены, таракан). У 12 (19,4%) пациентов отмечена пищевая аллергия, у 5 (8,1%) – кожные аллергические проявления. Почти все участники исследования имели как минимум одно сопутствовавшее заболевание. При этом в 56,2% случаев встречалась патология ЛОР-органов (полипоз носа, аллергический ринит). Отметим, что 65,9% больных ранее получали омализумаб [24] (табл. 3).
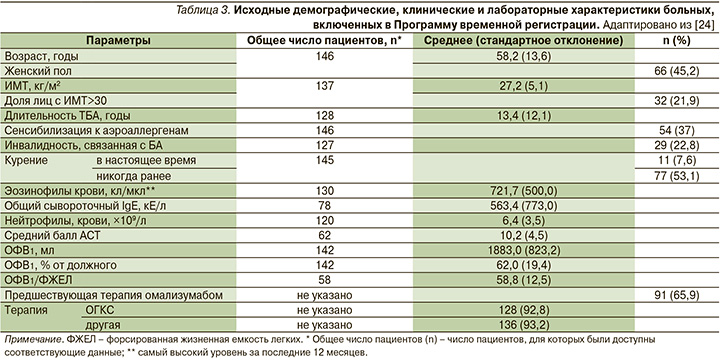
За время наблюдения данной группы в течение 2 лет были достигнуты выраженные улучшения. Частота обострений снизилась на 86,2% (до 0,8±1,1 на 1 пациента в год через 12 месяцев и 0,8±0,9 через 24 месяца). Средняя доза ОГКС была уменьшена на 38,8% через 3 месяца, на 59,7% через 12 и на 62,1% через 24 месяца. Через 12 месяцев прекратили прием ОГКС 58,9% участников программы, через 24 – 65,3% [24].
Средний ОФВ1 до пробы с бронходилататором увеличился по сравнению с исходным значением во все точки времени. Через 10 месяцев терапии он достиг примерно 70% от должного уровня и далее стабилизировался. Аналогичной была и динамика соотношения ОФВ1/ФЖЕЛ [24].
Средняя сумма баллов АСТ за первые 3 месяца увеличилась с 10,2 до 17,4, и этот ответ поддерживался в течение дальнейшего периода наблюдения. Это изменение превысило минимальное клинически значимое различие, составившее >3 баллов [24].
Среднее содержание эозинофилов крови снизилось с 722±500 до 101±83,9 кл/мл через 3 месяца терапии меполизумабом, до 75±63,7 через 12 и до 92±72,3 через 24 месяца [24].
Серьезные НЯ/побочные эффекты, расцененные как возможно связанные с терапией, включали 14 эпизодов у 8 пациентов. Число побочных эффектов особого интереса составило 15 (2 – сыпь, 1 – эритема в месте инъекции, 5 – инфекции, 4 – сосудистые расстройства, 1 – сердцебиение). Один из них отнесен к серьезным (пневмония) [24].
Авторы отметили высокий уровень выбывания пациентов из программы (данные за 24 месяца наблюдения были доступными для 75 человек), объяснив это тем, что меполизумаб был новым для врачей препаратом, для которого отсутствовали четкие рекомендации в отношении продолжительности терапии и ее отмены [24].
Заключение
Таким образом, в широкой популяции больных тяжелой эозинофильной БА в реальной клинической практике меполизумаб эффективно снижает число обострений и госпитализаций, увеличивает уровень контроля БА, качество жизни пациентов и улучшает функцию легких.
Эти преимущества не менее, а зачастую и более выражены, чем в условиях РКИ. При этом терапия характеризуется хорошей переносимостью и низким риском развития серьезных побочных эффектов.
Конфликт интересов
Федосенко С.В. является медицинским научным экспертом в АО «ГлаксоСмитКляйн Трейдинг».
Барабанова Е.Н. являетя менеджером по научно-медицинским коммуникациям в АО «ГлаксоСмитКляйн Трейдинг».


