Введение
В условиях реальной клинической практики стратегия длительного лечения больных бронхиальной астмой (БА) с применением высокоэффективных противовоспалительных фармакотерапевтических препаратов – ингаляционных глюкокортикостероидов (ИГКС), используемых в комплексе с длительно действующими β2-агонистами (ДДБА) [1–3], не всегда сопровождается достижением критериев контролируемого течения заболевания. В ответ на предложенную стандартную комбинированную терапию около 60% больных не имеют адекватного контроля над симптомами астмы [4]. В Европе среди пациентов, пользующихся ИГКС, распространенность неконтролируемой БА варьируется от 20% в Исландии до 67% в Италии [5], что может быть связано с инертностью регуляции ИГКС/ДДБА воспаления дыхательных путей, ассоциированного с клиническими параметрами болезни. Так, снижение воспалительной реакции бронхов скоординировано с достижением высокой стабильности и контролем заболевания у больных легкой персистирующей БА [6]. В случае тяжелого неконтролируемого течения астмы характер воспалительного паттерна бронхов оказывает существенное влияние на функцию внешнего дыхания и клинические результаты лечения [7].
В опубликованных нами ранее исследованиях показано, что воспалительные паттерны больных БА, относящихся к особому фенотипу лиц с холодовой и/или осмотической гиперреактивностью дыхательных путей, детерминированной полиморфизмом генов TRPM8, TRPV2, TRPV4 с проявлением в условиях избыточной влажности и низких температур атмосферного воздуха Тихоокеанского региона, отличаются полиморфностью, основанной на динамическом соотношении структуры и медиаторной активности гранулоцитов, инфильтрирующих слизистую оболочку дыхательных путей [8–10]. Тождественность клинико-функциональных манифестаций воспалительных паттернов у таких пациентов заключается в генерализованных нарушениях бронхиальной проходимости, появлении необратимого компонента обструкции, вызванного ремоделированием бронхов, связью между реакцией дыхательных путей на стимулы и уровнем системной эозинофилии [9].
Одним из постулированных факторов неконтролируемого течения БА служит вовлечение в патологический процесс малых дыхательных путей, персистенция воспаления в которых сопровождается явлениями раннего закрытия, формированием «воздушных ловушек», вероятностью развития дисфункции даже при легком течении астмы и не всегда корригируется рутинной ингаляционной терапией из-за невозможности достижения периферических отделов легких вдыхаемыми частицами стандартных размеров (>2 мкм) [11, 12]. В связи с этим преимуществом по сравнению с другими ИГКС/ДДБА обладает комбинация беклометазона дипропионата и формотерола фумарата (БДП/ФФ), используемая в виде экстрамелкодисперсного дозированного аэрозоля, способного оказывать противовоспалительное действие на малые дыхательные пути и обеспечивать высокий уровень легочной депозиции за счет равномерного распределения в легких частиц с наименьшим средним аэродинамическим диаметром (около 1,5 мкм по сравнению с 3–3,5 мкм у обычных комбинаций) [1–3, 11]. В данной комбинации доза 100 мкг БДП в виде экстрамелкодисперсного аэрозоля клинически эквивалентна дозе 250 мкг обычного БДП. Благодаря минимальному размеру частицы аэрозоля достигают малых дыхательных путей, в наименьшем количестве оседая в верхних дыхательных путях, что позволяет снижать системную стероидную нагрузку и сохранять достаточный уровень кортизола в крови без уменьшения противовоспалительного эффекта, тем самым потенциально улучшая соотношение эффективности и безопасности препарата [1–3].
Цель исследования
Целю настоящей работы стало изучение возможности достижения контроля над БА терапией фиксированной комбинацией экстрамелкодисперсного БДП/ФФ больных с гиперреактивностью дыхательных путей на холодовой и/или осмотический триггеры.
Методы
В период низких температур года было проведено одноцентровое наблюдательное когортное проспективное клиническое исследование с продолжительностью наблюдения 12 недель, в котором приняли участие 23 пациента в возрасте 25–60 лет (средний возраст – 41,4±2,0 года) обоих полов (15 женщин, 8 мужчин) с диагнозом «БА смешанной формы неконтролируемого течения» [13] и холодовой и/или осмотической гиперреактивностью дыхательных путей, подтвержденной при проведении бронхопровокационных проб: стандартной 3-минутной изокапнической гипервентиляцией холодным (-20°С) воздухом (ИГХВ) либо 3-минутной ультразвуковой ингаляцией дистиллированной воды (ИДВ) [10]. Гипотеза исследования: базисная терапия БА у больных с холодовой и/или осмотической гиперреактивностью дыхательных путей в течение 12 недель экстрамелкодисперсным БДП/ФФ в стабильной дозе 100 мкг БДП и 6 мкг ФФ 2 раза в сутки способствует достижению и поддержанию контроля над заболеванием.
Критериями включения в исследование служили документально подтвержденный клинический диагноз персистирующей БА с систематической базисной терапией ИГКС (в дозе <1000 мкг в пересчете на беклометазон) не менее 12 недель до момента включения в исследование; величина объема форсированного выдоха за первую секунду (ОФВ1) более 70% от должного на момент включения в исследование; документально подтвержденный диагноз холодовой и/или осмотической гиперреактивности дыхательных путей (падение ОФВ1 более чем на 10% при пробе ИГХВ и/или при пробе ИДВ [10]); сохраняющийся контакт с природными климатическими факторами (сочетанное воздействие низкой температуры и высокой влажности атмосферного воздуха); правильная техника проведения ингаляции комбинированного препарата; оптимальная приверженность назначенной терапии; отсутствие фоновой патологии, которая могла бы влиять на контроль основного заболевания; отсутствие острых респираторных заболеваний и обострений БА в течение предшествовавших 4 недель; письменное информированное согласие пациента на участие в предстоящем исследовании.
Протоколом клинического исследования предусматривалось назначение на срок 12 недель экстрамелкодисперсного БДП/ФФ (Фостер®) в стабильной дозе 100 мкг БДП и 6 мкг ФФ 2 раза в сутки – утром и вечером.
В качестве неотложной помощи допускалось дополнительное использование аэрозоля для ингаляций β2-агониста короткого действия (КДБА) на весь срок лечения. Больные проходили трехкратное обследование: во вводном периоде (1-й визит), через 6 недель (2-й) и на этапе завершения наблюдения через 12 недель (3-й визит). На этапе 2-го и 3-го визитов допускалось смещение запланированных временных интервалов контрольной явки в клинику не более 3 дней. Пациент считался завершившим исследование, если была проведена оценка исходного состояния, выполнены все инструментальные исследования и осуществлены все визиты до планируемой даты их завершения. Досрочное выведение больного из исследования предполагалось при условии тяжелого обострения БА, требовавшего изменения назначенной терапии.
Дизайн исследования включал при каждом визите пациента мониторирование симптомов БА, которые оценивались суммарно по 5-балльной шкале симптомов, включенных в Опросник по контролю над астмой – Asthma Control Test (ACT, Quality Metric Inc., 2002), с анализом ответов на каждый из предложенных вопросов. Оценку вентиляционной функции легких проводили методом спирометрии на аппарате Easy on PC (ndd Medizintechnik AG, Швейцария) с анализом кривой поток–объем форсированного выдоха и регистрацией показателей (ОФВ1, ФЖЕЛ, ОФВ1/ЖЕЛ, ПОС, МОС50, МОС75, СОС25-75) исходно и через 15 минут после введения аэрозоля для ингаляций КДБА (сальбутамол, 400 мкг).
Условия проведения функциональных тестов соблюдались в соответствии с международными стандартами проведения спирометрического исследования (АТС/ЕРС, 2005) [14]; для анализа использовались должные значения ECCS/EGKS для лиц европеоидной расы старше 18 лет. Больных просили воздерживаться от приема бронхолитических препаратов как минимум за 6–12 часов до предполагаемых процедур. На 1-м и 3-м визитах осуществляли сбор образцов индуцируемой мокроты по стандартной процедуре [15]. Изучение цитологических мазков проводилось при помощи светооптической иммерсионной микроскопии с подсчетом не менее 400 клеток в 100 полях зрения, в центральных и периферических частях препарата. Подсчитанное число клеток выражали в процентах, по результатам проводилось формирование цитограмм.
Оценка эффективности предложенной схемы базисной терапии осуществлялась:
- по увеличению числа баллов при ответе на вопросы теста по контролю над астмой (АСТ): уменьшению дневных и ночных симптомов БА, эпизодов затрудненного дыхания днем и/или ночью, уменьшению потребности в использовании быстродействующего бронхолитика, отсутствию ограничений активности пациентов из-за симптомов астмы, увеличению объема обычно выполняемой работы;
- по увеличению базальных (до применения бронхолитика) величин ОФВ1, МОС50, МОС75, СОС25-75 после 12-недельного периода лечения по сравнению с исходными значениями;
- по уменьшению величины прироста (∆) спирометрических показателей (∆ОФВ1, ∆МОС50, ∆МОС75, ∆СОС25-75) на введение КДБА (сальбутамол, 400 мкг) после 12-недельного периода лечения;
- по увеличению числа пациентов с контролируемым течением заболевания после 12-недельной терапии.
Этическая экспертиза
Клиническое исследование выполнено в соответствии с Хельсинкской декларацией Всемирной медицинской ассоциации «Этические принципы проведения научных медицинских исследований с участием человека» с поправками 2000 г. и Правилами клинической практики в Российской Федерации, утвержденными Приказом Минздрава РФ № 266 от 19.06.2003. Все пациенты подписали информированное согласие на участие в исследовании в соответствии с протоколом, одобренным Локальным комитетом по биомедицинской этике Дальневосточного научного центра физиологии и патологии дыхания (протокол № 121 от 25.10.2017).
Статистический анализ
Статистический анализ полученного материала проведен с помощью пакета программного обеспечения Statistica 10.0 (StatSoft, Inc. 2011) и с использованием программы «Автоматизированная система для научных исследований» [16]. Оценка соответствия признака закону нормального распределения проведена при помощи критериев Колмогорова–Смирнова, Пирсона–Мизеса. При нормальном типе распределения использованы параметрический критерий (t) Стьюдента (парный), в случаях асимметричных (негауссовых) распределений – парный критерий Уилкоксона. Описательная статистика количественных признаков представлена с помощью среднего арифметического, стандартной ошибки среднего арифметического (M±m). Анализ распространенности признака в сравниваемых группах (частота альтернативного распределения) проведен по критерию χ² (К. Пирсона) для четырехпольной таблицы. Значение полученного критерия χ2 сравнивали с граничными значениями 3,84 для 5%-ной вероятности и 6,63 для 1%-ной вероятности нуль-гипотезы.
Для всех величин принимался во внимание уровень значимости (р), равный <0,05.
Результаты исследования
Из 23 больных, прошедших рандомизацию и начавших получать лечение экстрамелкодисперсным БДП/ФФ, на этапе завершения исследования (визит 3) досрочно были выведены двое пациентов: один – по причине серьезного нежелательного явления со стороны других органов и систем, второй – вследствие потери контакта с ним.
За предшествовавшие 7 дней до предстоявшего лечения 87% больных имели ежедневные приступы удушья, 96% дополнительно принимали короткодействующие бронхолитики, АСТ составил в среднем 13,8±0,79 балла.
На 2-м визите по истечении 6 недель терапии БДП/ФФ у исследуемых больных, согласно критериям АСТ, выявлено достоверное повышение уровня контроля над болезнью по сравнению с исходным значением (табл. 1). После 6 недель терапии хорошего контроля БА достигли 17 (74%) из 23 больных, плохо контролировали заболевание 6 (26%) пациентов. В последующие 6 недель (визит 3) стабильного дозирования комбинированного препарата положительная динамика контролируемого течения болезни сохранялась. При анкетном опросе во время 3-го визита большинство больных отметили значительное улучшение своего состояния, хороший контроль астмы (20–25 баллов АСТ) наблюдался у 19 человек, лишь у 2 больных выявлен плохой контроль БА (АСТ <19 баллов); эти больные имели ежедневные эпизоды затрудненного дыхания, требовавшего дополнительного использования сальбутамола. Один из них, однако, субъективно отмечал значимое улучшение своего состояния, которое подтверждалось увеличением АСТ с 12 до 19 баллов. У второго больного общее число баллов по АСТ на 1-м и 3-м визитах составило 15 и 16, связанное с зарегистрированным между 2-м и 3-м визитами нежелательным явлением в виде обострения БА и госпитализацией его в клинику, после которой пациент продолжил лечение комбинацией БДП/ФФ в прежнем объеме.
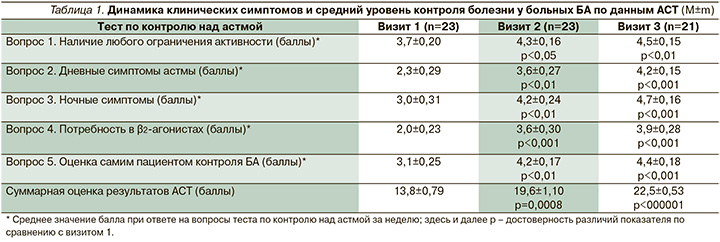
Эффективность влияния назначенной терапии на каждый из клинических симптомов БА оценена при анализе ответов на 5 вопросов, включенных в Asthma Control Test (в баллах), по контрольным точкам наблюдения. Оказалось, что за первые 6 недель терапии большему регрессу подверглись дневные симптомы астмы и потребность в использовании КДБА, в меньшей степени изменилась активность больных, в т.ч. при выполнении физической нагрузки в предшествовавшую неделю до визита в клинику (табл. 1).
К концу лечения (через 12 недель) только у 42% больных имелись редкие эпизоды удушья (χ2=30,1; р<0,001). По данным вопросника АСТ, к 12-й неделе наблюдения большинство больных эффективно контролировали как дневные, так и ночные симптомы астмы, что отражалось на оценке пациентами своего самочувствия: число регистрируемых баллов составило 4–5, за исключением 1 больного. Обращает на себя внимание отсутствие значимой динамики между 2-м и 3-м визитами при ответе на вопрос о приеме КДБА, на момент 3-го визита 52% пациентов продолжали дополнительно использовать 1–2 раза в неделю препарат короткого действия (χ2=8,76; р<0,01), двое больных использовали бронхолитик в ежедневном режиме.
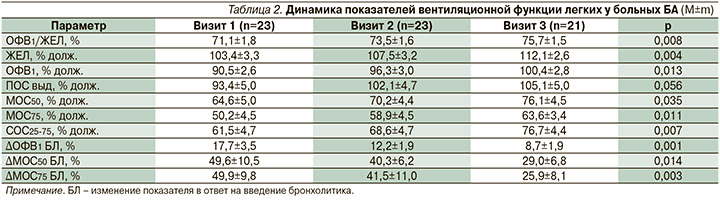
Достижение и поддержание контроля БА у больных сопровождались улучшением бронхиальной проходимости и снижением реакции дыхательных путей на ингаляцию КДБА (табл. 2). Обращает на себя внимание опережение в динамике клинических симптомов болезни над функциональными данными. Если ко второму визиту наблюдалась четкая положительная динамика в клинической картине болезни, происходило угасание основных клинических симптомов заболевания, регистрируемых больными при оценке своего самочувствия (по данным АСТ), то при исследовании спирометрических показателей не было обнаружено значимой разницы по сравнению с результатами исследования на визите 1. Это касалось не только базовых значений ЖЕЛ и параметров кривой поток–объем форсированного выдоха, но и изменений этих показателей после ингаляции 400 мкг сальбутамола. Существенное увеличение параметров вентиляционной функции легких происходило к 12-й неделе лечения экстрамелкодисперсным БДП/ФФ. Признаки уменьшения обструкции дыхательных путей регистрировались в отношении не только центральных, но и периферических воздухоносных путей. В частности, рост показателей МОС50, МОС75, СОС25-75 свидетельствовал об улучшении проходимости дистальных бронхов, в т.ч. и малых дыхательных путей диаметром ≤2 мм. Последние начинаются приблизительно с 8-й генерации, включают проводящие и ацинарные дыхательные пути (мембранозные, терминальные и респираторные бронхиолы 8–24-го порядков) и служат терапевтической мишенью экстрамелкодисперсного БДП/ФФ [1, 11]. Кроме того, к концу лечения происходило значимое уменьшение практически в 2 раза реакции со стороны как крупных, так и малых дыхательных путей в ответ на введение сальбутамола (табл. 2).
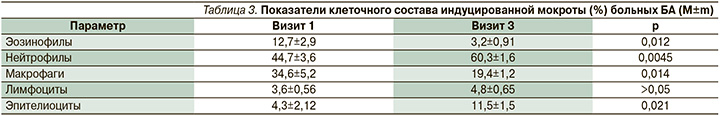
При анализе содержания в дыхательных путях исследуемых больных ведущих клеточных эффекторов воспаления – эозинофильных и нейтрофильных гранулоцитов – обнаружено, что структурной основой повышения бронхиальной проходимости и достижения контроля над БА в ответ на действие комбинации экстрамелкодисперсного БДП/ФФ стало снижение количества эозинофилов в мокроте (табл. 3). На заключительном этапе наблюдения их насчитывалось значительно меньше, чем в начале терапии. Депрессия эозинофильного сегмента воспаления бронхов сопровождалась статистически значимым увеличением числа бронхиальных нейтрофилов (табл. 3).
У двоих больных между визитами зарегистрировано нежелательное явление в виде обострения БА, после купирования симптомов обострения пациенты продолжили участие в исследовании, доза препарата не менялась. У одного пациента на визите 3 зарегистрировано серьезное нежелательное явление – онкологическое заболевание, по поводу которого больной получал комбинированное лечение. Пациент исключен из исследования.
Обсуждение
Оценивая эффективность проведенной терапии при 12-недельном применении БДП/ФФ больными неконтролируемой БА с холодовой и/или осмотической гиперреактивностью дыхательных путей, на завершающем этапе мы наблюдали улучшение функции внешнего дыхания, уменьшение ответа дыхательных путей на β2-агонист, снижение частоты дополнительного использования КДБА и увеличение числа пациентов с хорошим контролем болезни.
Известно, что обструкция легких на уровне малых дыхательных путей, характеризующихся большей, чем бронхи крупного калибра, гиперчувствительностью к неспецифическим раздражителям и активностью воспаления, участвует в развитии бронхиальной гиперреактивности, ухудшает клиническое течение БА, увеличивает частоту и выраженность приступов удушья, стимулирует нарастание симптомов, повышает риск обострений, что приводит к неэффективности контроля болезни у пациентов, получающих стандартную фармакотерапию [11, 12, 17–19]. Механизмы формирования тяжелых форм БА непосредственно связаны с обусловленным воспалением ремоделированием малых дыхательных путей [1].
Имеются сведения о более высокой плотности распределения воспалительных клеток в стенках малых дыхательных путей по сравнению с плотностью воспалительных клеток, инфильтрирующих слизистую оболочку крупных и средних бронхов [11]. В малых дыхательных путях воспаление распространяется из слизистой оболочки на подслизистый слой и мышечную оболочку, характеризуясь значительной инфильтрацией стенок бронхиол лимфоцитами, эозинофилами и нейтрофилами, высоким уровнем экспрессии РНК, медиаторов воспаления – интерлейкинов-4 и -5, хемокинов, эотаксина, а также наиболее высоким количеством активированных эозинофилов [11, 19]. Основополагающая роль активированных эозинофилов в развитии и поддержании бронхиальной обструкции обусловлена экзоцитозом синтезированных в эозинофильных гранулах цистеиниловых лейкотриенов (LTС4, LTD4 и LTE4) [20] и продукцией цитотоксичного эозинофильного катионного протеина (ECP), который не только разрушает эпителий бронхов и регулирует пролиферацию Т- и В-лимфоцитов, но и стимулирует тучноклеточный синтез, секрецию гистамина, простагландина D2, рекрутирующего в свою очередь эозинофильные и нейтрофильные гранулоциты в бронхи, способствуя развитию бронхоспазма [21].
Повышение количества нейтрофилов в мокроте не изменяло принадлежности воспалительного спектра дыхательных путей к эозинофильному клеточному фенотипу и не служило фактором ограничения бронхопротективного влияния экстрамелкодисперсного БДП/ФФ. Успешность взаимодополняющего и синергического воздействия входящих в состав последнего ИГКС и ДДБА на воспалительные клетки, извлеченные из мокроты больных БА, доказана исследованиями in vitro. Так, в результате действия экстрамелкодисперсного БДП/ФФ в супернатанте стимулированных воспалительных клеток помимо увеличения экспрессии β2-адренорецепторов обнаружено выраженное снижение продукции гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF), цитокина A5 (RANTES) и интерлейкина-8 [22]. По сообщениям ряда авторов, с применением БДП/ФФ связано развитие антипролиферативного (применительно к легочным фибробластам) и антиремоделирующего эффектов [3, 23].
Вследствие того, что прерогатива в организации клеточного паттерна, маркирующего бронхиальное воспаление больных БА, отведена эозинофилам, положительный терапевтический эффект экстрамелкодисперсного БДП/ФФ может рассматриваться с позиций первоочередной коррекции препаратом ключевого компонента клеточного воспаления дыхательных путей.
Ограничением исследования следует считать небольшой объем выборки, хотя статистически значимые различия подтверждают гипотезу исследования. Пролонгация наблюдения позволит оценить долговременные эффекты базисной терапии комбинацией экстрамелкодисперсного БДП/ФФ для поддержания достигнутого контроля БА у пациентов с холодовой и/или осмотической гиперреактивностью дыхательных путей.
Заключение
Применение в течение длительного времени комбинации экстрамелкодисперсного БДП/ФФ в стабильной дозе для лечения больных неконтролируемой БА с холодовой и/или осмотической гиперреактивностью дыхательных путей приводит к достижению хорошего контроля над болезнью, улучшению функции внешнего дыхания и проходимости бронхов, включая малые дыхательные пути. Достижение контролируемого течения БА и оптимизация клинико-функциональных параметров болезни у таких пациентов сопряжены с регуляцией экстрамелкодисперсным БДП/ФФ интенсивности бронхиального воспаления за счет снижения количества эозинофилов мокроты.
Выражение признательности
Выражаем благодарность кандидату медицинских наук Ушаковой Елене Владимировне за сотрудничество и помощь в обработке цитологического материала.
Источник финансирования
Исследование выполнено при частичной поддержке ООО «Кьези Фармасьютикалс».
Вклад авторов
Концепция и дизайн исследования – Ю.М. Перельман, А.Г. Приходько.
Сбор и обработка материала – Н.Л. Перельман, Е.Ю. Афанасьева, Е.Ю. Кочегарова, Л.Ю. Ошур.
Статистическая обработка данных – Е.Ю. Афанасьева, А.Г. Приходько.
Написание текста – А.Б. Пирогов, А.Г. Приходько.
Редактирование – Ю.М. Перельман.


