Введение
Современные рекомендации по ведению больных хронической обструктивной болезни легких (ХОБЛ) в качестве ключевых целей указывают на облегчение симптомов и уменьшение риска обострения заболевания. Для достижения этих целей авторы программы GOLD (Global Initiative for Chronic Obstructive Lung Disease) предлагают классифицировать пациентов на четыре категории (A, B, C и D), что может быть полезным при определении первоначальной терапевтической тактики [1, 2]. Однако данный подход оказывается не очень чувствительным в краткосрочной перспективе, поскольку представляется маловероятным, что выраженность одышки, история обострений ХОБЛ и оценка функции легких окажутся способными отражать динамические изменения клинического статуса больного между двумя последовательными визитами к врачу.
Аналогичный «упрек» можно высказать и в отношении Испанского руководства по фармакотерапии больных ХОБЛ GesEPOC (Guía espanola de la enfermedad pulmonar obstructiva crónica) [3], где определение риска обострений основывается на оценке функции легких, выраженности одышки, истории ранее перенесенных обострений и клинических фенотипах заболевания («бронхитический», «эмфизематозный», «ХОБЛ+астма», «неопределенный»).
Концепция контроля ХОБЛ
Очевидно, что с учетом значительной гетерогенности ХОБЛ лечение заболевания следует индивидуализировать [4–6]. Определение фенотипа и степени тяжести ХОБЛ не всегда позволяет выявлять достоверные изменения клинического статуса пациента в ответ на модификацию терапии [7]. Два обострения в текущем году для одного пациента будут означать ухудшение контроля, если в предшествовавшем году обострений не было, а для другого пациента, напротив, – улучшение, поскольку в предшествовавшем году их было четыре. И лечебная тактика при рассмотрении указанных клинических сценариев, вероятнее всего, должна быть различной. Поэтому необходимы четкие критерии, определяющие текущую ситуацию и в то же время оценивающие краткосрочную эволюцию болезни. Этим целям и служит недавно разработанная концепция контроля ХОБЛ [8] (по аналогии с концепцией контроля бронхиальной астмы [9–11]). Концепция контроля ХОБЛ трактуется как поддержание состояния пациента с наименьшим клиническим воздействием симптомов болезни в сочетании со стабильным течением, характеризующимся низким риском обострений на протяжении длительного периода времени, адаптированных к тяжести заболевания. В процессе эволюции концепции контроля ХОБЛ было достигнуто понимание большинством экспертов «составных элементов» панели контроля заболевания (табл. 1).

При этом определено и минимальное временнόе «окно наблюдений» за пациентом – 3 месяцев [13].
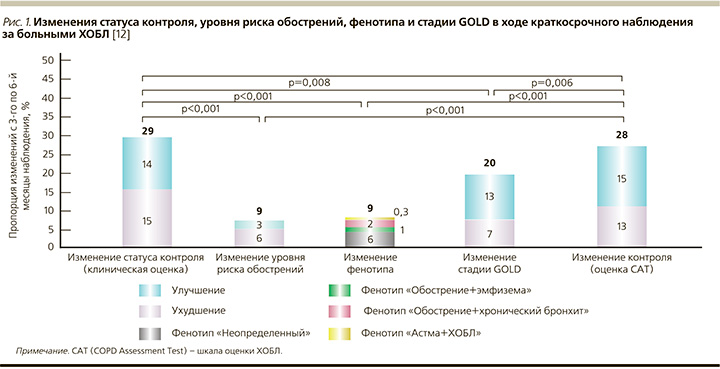
К одним из свидетельств валидности концепции контроля ХОБЛ относятся, в частности, результаты недавно опубликованного исследования J.J. Soler-Cataluña et al. [12], в ходе которого при краткосрочном 3-месячном наблюдении за 354 больными ХОБЛ было установлено, что изменения статуса контроля заболевания наблюдались существенно чаще, нежели таковые «переменных», определяющих выбор терапии (уровень риска обострений, клинический фенотип ХОБЛ или стадия GOLD, рис. 1). Отсюда следуют вполне аргументированные выводы, согласно которым определение уровня контроля ХОБЛ является весьма динамичным и чувствительным «инструментом», могущим использоваться при каждом посещении врача по простым клиническим параметрам без дополнительной функциональной и лабораторной диагностики и дающим дополнительную информацию для определения терапевтической тактики и оценки прогноза.
Место бронходилататоров в лечении ХОБЛ
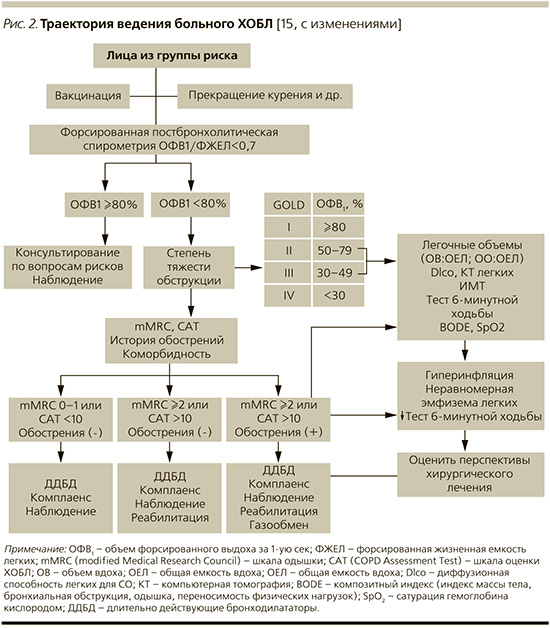
Целям фармакотерапии ХОБЛ (контроль симптомов заболевания, повышение переносимости физических нагрузок, улучшение качества жизни, снижение частоты и тяжести обострений заболевания) [2, 3, 14] наилучшим образом соответствует терапия бронходилататорами длительного действия (рис. 2), возможности которой за последнее время существенно расширились. И связано это в первую очередь с появлением ряда фиксированных комбинаций длительно действующих бронходилататоров (табл. 2).
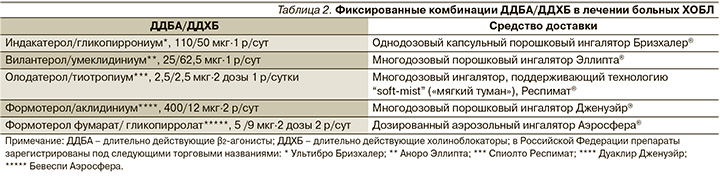
По мнению экспертов программы GOLD, фиксированные комбинации ДДБА/ДДХБ следует рассматривать как препараты «первой линии» у большинства пациентов с симптоматическим течением ХОБЛ и практически у каждого, кто нуждается в регулярной поддерживающей терапии [14]. Более точное определение места фиксированным комбинациям ДДБА/ДДХБ мы находим на страницах Испанских рекомендаций – их назначение приоритетно для всякого больного высокого риска независимо от клинического фенотипа, что определяется тяжелой/крайне тяжелой бронхиальной обструкцией или выраженной одышкой (mMRC≥2) или по крайней мере двумя эпизодами нетяжелого обострения или потребовавшим госпитализации с одним эпизодом тяжелого обострения за истекший год или комбинаций указанных факторов [3].
К настоящему времени накоплен огромный фактический материал по оценке эффективности и безопасности «двойных» комбинаций ДДБА/ДДХБ, полученный в рамках плацебо-контролируемых исследований и исследований с активным контролем (ДДБА, ДДХБ и ингаляционные глюкокортикостероиды – ИГКС/ДДБА) [16, 17]. Так, согласно выводам недавно опубликованного систематического обзора и мета-анализа, включивших 23 исследования (20 185 больных), фиксированные комбинации ДДБА/ДДХБ в ходе рандомизированных контролируемых исследований продолжительностью ≥12 недель превосходят монотерапию ДДХБ и ИГКС/ДДБА по величине прироста «наименьшего» (предбронхолитического) ОФВ1, причем в большинстве случаев прирост этого показатели превышал минимальные клинически значимые величины (>100 мл); достоверным было превосходство комбинированной терапии и во влиянии на выраженность одышки (транзиторный индекс одышки), формализованные критерии качества жизни (вопросник SGRQ1) и частоту ситуационного применения бронходилататоров короткого действия [18].
При этом важно подчеркнуть, что назначение комбинированного бронходилатирующего препарата далеко не всегда следует рассматривать как этап эксалации терапии больного ХОБЛ, «не отвечающего» должным образом на монокомпонентное лечение. Хорошо известно, что значительная часть больных ХОБЛ не получают оптимального лечения [19, 20], тогда как раннее начало потенциально высокоэффективной терапии может обеспечить больному долгосрочные преимущества [21, 22].
С учетом вышеизложенного становится все более обоснованным назначение «двойных» бронходилататоров в качестве терапии «первой линии» у немалой части больных ХОБЛ. В пользу данной лечебной тактики свидетельствуют и результаты недавно проведенного объединенного анализа трех исследований – ARISE [23], SHINE [24] и SPARK [25], показавшего, что комбинация индакатерола/гликопиррониума превосходит монотерапию тиотропиумом и гликопиррониумом во влиянии на функцию легких, выраженность одышки и других симптомов ХОБЛ (рис. 3), качество жизни, частоту ситуационных ингаляций короткодействующих бронходилататоров у «наивных» больных, ранее не получавших регулярного лечения [26].
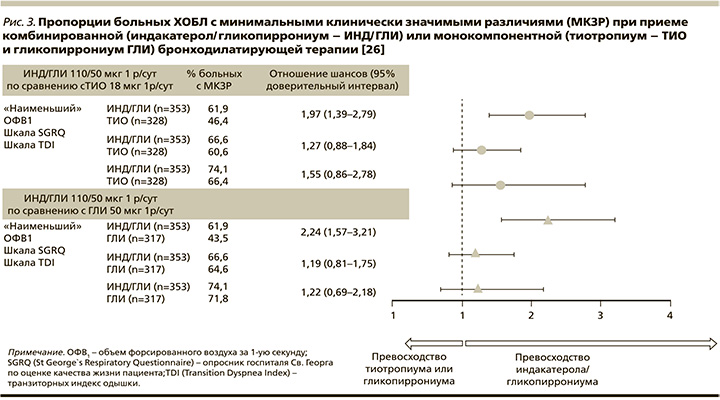
Важнейшим с клинической точки зрения оказалось достоверное преимущество ДДБА/ДДХБ над ИГКС/ДДБА во влиянии на частоту среднетяжелых и тяжелых обострений ХОБЛ (отношение шансов [ОШ]=0,82, 95% доверительный интервал [ДИ]: 0,75–0,91) [18], ярко продемонстрированное при сравнении индакатерола/гликопиррониума и салметерола/флутиказона пропионата в исследовании FLAME [27], независимо от гендерных различий, возраста больных, статуса курения и степени тяжести заболевания [28].
Более привлекательным представлялся и профиль безопасности фиксированных комбинаций ДДБА/ДДХБ, характеризовавшийся по сравнению с ИГКС/ДДБА меньшей вероятностью развития побочных эффектов (ОШ=0,94, 95% ДИ: 0,89–0,99), в т.ч. и ятрогенной пневмонии (ОШ=0,59, 95% ДИ: 0,43–0,81), а также минимальной (по сравнению с ДДХБ) вероятностью прекращения терапии ввиду ее неэффективности (ОШ=0,66, 95% ДИ: 0,51–0,87) или (по сравнению с ИГКС/ДДБА) риском побочных эффектов (ОШ=0,83, 95% ДИ: 0,69–0,99) [18]. Вопрос о балансе пользы (прежде всего уменьшение частоты обострений ХОБЛ) и вреда (риск развития ятрогенной пневмонии) возник с особой остротой при появлении на фармацевтическом ранке «тройных» комбинаций (ИГКС/ДДБА/ДДХБ) и их сравнении с «двойными» бронходилататорами. Имеющиеся на сегодняшний день данные позволяют утверждать, что применение «тройной» терапии целесообразно только в подгруппе пациентов с более высоким исходным риском обострения ХОБЛ (история обострения/обострений ≥1, потребовавших назначения системных антибиотиков и/или ГКС или обусловивших необходимость госпитализации в течение предыдущего года) [29]. Иными словами, ИГКС-содержащая терапия оправданна лишь в случаях повторных обострений ХОБЛ, несмотря на продолжающийся прием ДДБА/ДДХБ, а также у отдельных категорий больных, воспалительный профиль заболевания которых предполагает «ответ» на ИГКС [30, 31].
ХОБЛ и сердечно-сосудистая система
Сердечно-сосудистые заболевания (ССЗ) тесно связаны с ХОБЛ. Согласно эпидемиологическим исследованиям, больные ХОБЛ имеют почти 2,5-кратный риск развития ССЗ по сравнению с лицами контрольной группы, сопоставимыми с ними по возрасту, но не страдающими бронхолегочной патологией [32–34]. Помимо этого пациенты с ХОБЛ и коморбидными ССЗ демонстрируют более выраженную одышку, худшее качество жизни, чаще госпитализируются и характеризуются более высокой смертностью по сравнению с больными «мононозологической» ХОБЛ [35, 36]. Более чем у четверти больных
ХОБЛ в качестве основной причины смерти фигурирует сердечно-сосудистое событие, становясь в 40% случаев ведущим механизмом танатогенеза у пациентов с сочетанием ХОБЛ и ССЗ [36].
Один общий ирритант – табачный дым, и одна общая ответная реакция – воспаление могут лежать в основе многочисленных сопутствующих заболеваний, в т.ч. и ССЗ, наблюдаемых у больных ХОБЛ.
Среди факторов риска, общих для ХОБЛ и ССЗ, курение бесспорно наиболее важный. Курение и ХОБЛ неразрывно связаны, в то время как курение также хорошо известно как основной фактор риска развития атеросклероза. К числу других общих факторы риска следует отнести гиподинамию и загрязнение воздуха (рис. 4).
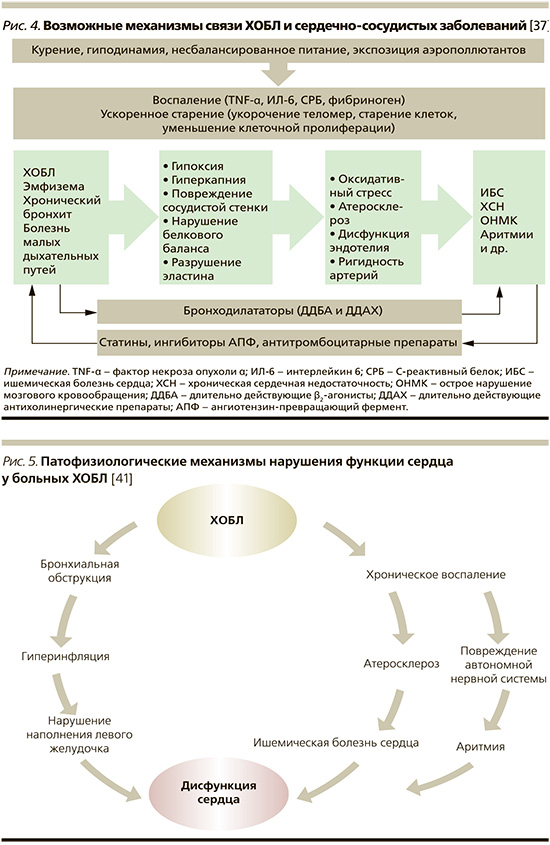
Дополнительные известные факторы риска развития ССЗ, в частности сахарный диабет и артериальная гипертензия, весьма распространены сред больных ХОБЛ, особенно среди пациентов с более тяжелым течением заболевания [38, 39].
В сложном патогенетическом взаимодействии бронхолегочной и сердечно-сосудистой системы у больных ХОБЛ следует особо выделить гиперинфляцию – основное нарушение функции легких, характеризующееся увеличением остаточного и внутригрудного объемов воздуха, а также снижением жизненной емкости легких. Гиперинфляция, обусловливающая ухудшение податливости легких и газообмена, способствует также и нарушению работы сердца. Последнее, в частности, было продемонстрировано в работе R.G. Barr et al. [40], установивших обратно пропорциональную зависимость между выраженностью эмфиземы и бронхиальной обструкции, с одной стороны, и диастолическим наполнением левого желудочка (ЛЖ), ударным объемом и сердечным выбросом, с другой (рис. 5). Позднее P. Alter et al. [42], показав снижение диастолического наполнения правого сердца больных ХОБЛ с эмфиземой легких, предположили, что в основе данного гемодинамического феномена лежит снижение «преднагрузки».
Подтверждение справедливости концепции, связывающей снижение «преднагрузки» с эмфиземой легких, служит тот факт, что время изоволюметрической релаксации ЛЖ, несмотря на наличие гиперинфляции, оставалось неизмененным, тем самым указывая на отсутствие связи с растяжимостью ЛЖ [43].
Следствием негативного влияния ХОБЛ на сердце является и уменьшение размеров его камер. Так, в частности было показано, что по мере утяжеления бронхиальной обструкции наблюдается закономерное уменьшение размеров всех камер сердца [43]. Наиболее сильная корреляционная связь при этом имела место между показателями статической гиперинфляции (соотношение инспираторной и общей емкости легких) и размерами камер.
Еще одним важным аспектом дисфункции легких при ХОБЛ является уменьшение кровотока в микрососудах легких, что связывается C.P. Aaron et al. [44] со сдавлением капиллярного русла вследствие гиперинфляции. Авторы нашли связь между снижением общего объема легочных сосудов и снижением конечно-диастолического объема ЛЖ, ударного объема и сердечного выброса. При этом у обследованных больных ХОБЛ ни расслабление желудочков, ни фракция выброса не были нарушены, что позволяло связать выявленные расстройства внутрисердечной гемодинамики с «легочными» причинами. В возможном ряду последних упоминается и регионарная гипоксическая вазоконстрикция, которая также может приводить к уменьшению возврата крови к левому сердцу [44].
Таким образом, связь между ХОБЛ и нарушениями функции ЛЖ может быть вызвана снижением возврата крови («преднагрузки») вследствие повреждения сосудистой системы легких, повышения внутригрудного давления и компрессии легочных вен. Гиперинфляции в подобных патофизиологических построениях отводится главенствующая роль. А это в свою очередь требует ответа на вполне логичный вопрос: может ли дефляция легких больных ХОБЛ оказать благотворное влияние на функционирование ЛЖ?
Среди способов эффективного воздействия на гиперинфляцию у больных ХОБЛ, очевидно, особое внимание привлекают длительно действующие бронходилататоры, улучшающие «опорожнение» легких и тем самым противодействующие гиперинфляции [45, 46]. Уменьшение гиперинфляции (дефляция) снижает степень сжатия микроциркуляторного русла легких, что приводит к увеличению легочной перфузии и наполнению сердца (рис. 6).

Учитывая то обстоятельство, что «двойные» бронходилататоры оказывают более демонстративное действие на легочную функцию, нежели монокомпонентная терапия [26] или комбинация ИГКС/ДДБА [47], вполне ожидаемой оказалась и последовавшая вскоре попытка оценить жизнеспособность приведенной выше гипотезы.
В исследовании CLAIM при применении индакатерола/гликопиррониума в течение 14 дней показано, что наряду со значительным снижением ограничения воздушного потока и гиперинфляции произошло увеличение конечно-диастолического объема ЛЖ на 10% [48]. Позже были получены и доказательства того, что даже непродолжительная 2-недельная терапия индакатеролом/гликопиррониумом наряду с дефляцией сопровождается существенным улучшением кровотока на уровне микроциркуляторного русла легких [49]. Авторы также предположили, что положительные эффекты данной комбинации ДДБА/ДДХБ, ведущие к улучшению регионарной вентиляции, повлекут за собой снижение паренхиматозой гипоксии, улучшение функции эндотелия и вазодилатацию легочных сосудов.
Полученные в ходе исследования CLAIM данные будут полезными и в долгосрочной перспективе – даже для больных ХОБЛ с гиперинфляцией в отсутствие какого-либо определенного ССЗ.
Однако обсуждение вопроса о «взаимоотношениях» ХОБЛ и сердечно-сосудистой системы не было бы полным, если бы мы не затронула один весьма важный аспект, а именно потенциальную кардиотоксичность бронходилататоров. Стимуляция внелегочных 2-адренорецепторов при ингаляционном применении ДДБА может оказаться причиной неблагоприятных сердечно-сосудистых событий [50]. Известно, что β1- и β2-адренорецепторы представлены в предсердиях и желудочках в примерных соотношениях – 7:3 и 4:1 соответственно [51]. Присутствие β2-адренорецепторов, способствующих высвобождению норадреналина, обнаруживается и в адренергических нервных окончаниях в сердце [52]. Отсюда логичным выглядит предположение, будто, стимулируя β2-адренорецепторы, ДДБА могут вызывать положительные иноторпный и хронотропный эффекты, тем самым способствуя увеличению потребности миокарда в кислороде и развитию таких неблагоприятных сердечно-сосудистых событий, как тахикардия, эктопические нарушения ритма сердца, острая коронарная недостаточность [50, 53]. В дополнении к этому следует упомянуть и периферическую вазодилатацию вследствие стимуляции сосудистых β2-адренорецепторов, что может приводить к рефлекторной тахикардии [50].
Кроме того, ингаляционные β2-агонисты, оказывая стимулирующее воздействие на Na+-, K+-АТФазу, связанную с β2-адренорецепторами скелетных мышц, «перекачивают» ионы калия в клетку и тем самым могут вызывать гипокалиемию, которая в свою очередь ассоциируется с фибрилляцией предсердий и желудочковой тахикардией [54].
Что же касается ДДХБ, то потенциальный сердечно-сосудистый риск при их применении связывают, прежде всего с антагонизмом ко 2-му подтипу мускариновых (М2)-холинорецепторов синоатриального узла, что способно вызывать тахикардию [55]. Помимо этого в ряду механизмов «кардиотоксичности» ДДХБ указывается и ингибирование М3-холинорецепторов. Как известно, стимуляция М3-холинорецепторов защищает сердечную мышцу от ишемического повреждения путем активации антиапоптотических сигнальных веществ, повышения уровня эндогенных антиоксидантов, уменьшения внутриклеточной «перегрузки» Ca++ и др. [56, 57].
Однако, несмотря на указанные выше «предпосылки», результаты многочисленных контролируемых и наблюдательных исследований из реальной практики убеждают нас в обратном – длительно действующие бронходилататоры, в т.ч. и «двойные», не увеличивают риска развития серьезных сердечно-сосудистых событий по сравнению с активным контролем или плацебо [58].
Эта на первый взгляд противоречивая ситуация несоответствия «тревожных ожиданий» и оптимистичных выводов по результатам проведенных исследований может иметь несколько объяснений. Отчасти это связывается с тем, что больные ХОБЛ с сердечно-сосудистым риском часто исключаются из контролируемых исследований, обеспечивая результаты, отклоняющиеся от реальной жизни. Впрочем, в ряде исследований и post-hoc-анализов, дизайн которых предполагал включение пациентов с высоким риском ССЗ, также не удалось выявить существенных различий в профиле сердечно-сосудистой безопасности между группами больных, получавших различную терапию, в т.ч. и «двойные» бронходилататоры [59, 60].
Более реалистичным выглядит следующее объяснение: достигаемое при применении длительно действующих бронходилататоров и их «двойных» комбинаций улучшение дыхательной функции и уменьшение легочной гиперинфляции снижает и, вероятно, уравновешивает сердечно-сосудистые риски бронхолитической терапии больных ХОБЛ [48]. И чтобы аргументировать это предположение, вновь следует вернуться к основным выводам исследования CLAIM, продемонстрировавшего улучшение сердечной деятельности на фоне 14-дневного приема индакатерола/гликопиррониума больными ХОБЛ с умеренной/тяжелой гиперинфляцией [48]. Результаты этого исследования важны потому, что «двойная» бронходилатация, по-видимому, уменьшает известные вредные эффекты гиперинфляции на течение сопутствующих ССЗ у больных данной категории [58].
Таким образом, несмотря на бόльшую эффективность ДДБА/ДДХБ в отношении влияния на легочную функцию по сравнению с монокомпонентной терапией [61], «двойная» бронходилатация не сопровождается повышением риска развития неблагоприятных сердечно-сосудистых событий, а некоторые комбинации (в частности, индакатерол/гликопиррониум) могут играть даже своеобразную «кардиопротективную» роль [62, 63].
ХОБЛ и ингалятор
Очевидно, что ингаляционный путь введения – предпочтительный метод доставки терапевтических аэрозолей в дыхательные пути [64], а эффективность ингаляционной терапии зависит в первую очередь от количества препарата, депонируемого в легкие [65]. Однако здесь следует учитывать известную изменчивость дозы лекарственного средства, достигающего легких, что определяется рецептурой, типом устройства и способностью пациента осуществлять корректный ингаляционный маневр [66–68].
При выборе ингалятора необходимо принимать во внимание простоту и легкость при его использовании, что способствует меньшему количеству ошибок и обеспечивает более высокую приверженность длительной базисной терапии. Не менее важна и такая характеристика ингаляционного устройства, как низкое сопротивление, что дает возможность осуществлять вдох без особых усилий даже при выраженной бронхиальной обструкции [69].
При этом в случае использования дозированных порошковых ингаляторов с низким внутренним сопротивлением (например, Бризхалер®), что предполагает низкий максимальный перепад давления и не требует значительного усилия для создания разницы перепадов давления, мы формально должны рассчитывать на способность больного развить высокую скорость инспираторного потока [67]. Тем не менее, справедливо задаться вопросом: достигается ли оптимальная легочная депозиция, если по каким-то причинам скорость вдоха составляет менее 90 л/мин? На этот вопрос отвечает оригинальное исследование на платформе биофизической модели для изучения лекарственной депозиции с использованием ингалятора Бризхалер® при различных скоростях инспираторного потока, изменяемой анатомии дыхательных путей и углах наклона ингалятора [70]. Авторами было показано, что легочная депозиция индакатерола/гликопиррониума 110/50 мкг сопоставима при скорости инспираторного потока через ингалятор Бризхалер® в диапазоне от 30 до 120 л/мин и составляет до 42% для индакатерола и до 53% для гликопиррониума (рис. 7). Легочная лекарственная депозиция не зависела и от угла наклона ингалятора.
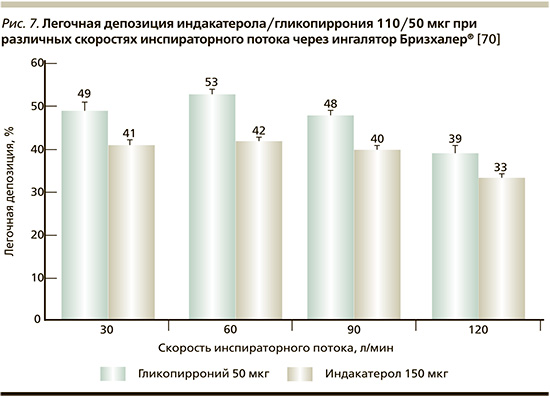
Эти данные совпадают с результатами ранее проведенного исследования, в ходе которого было продемонстрировано, что доставленные дозы индакатерола через ингалятор Бризхалер® имеют минимальные отличия при скоростях инспираторного потоках от 30 до 100 л/мин [71].
Таким образом, легочная депозиция индакатерола и гликопиррония при использовании ингалятора Бризхалер® практически не зависит от скорости инспираторного потока, позволяя применять его у больных разного возраста с различной степенью тяжести ХОБЛ. К этому следует добавить, что при использовании ингалятора Бризхалер® пациентами допускается наименьшее число критических ошибок и они признают это устройство наиболее простым в использовании [72].
Заключение
Современные рекомендации по лечению ХОБЛ указывают в качестве приоритетных целей уменьшение риска повторных обострений и облегчение симптомов заболевания. Для достижения этих целей эксперты инициативы GOLD предлагают классифицировать пациентов на четыре категории (A, B, C и D) [64]. Эта классификация полезна для выбора первоначального терапевтического подхода, однако она не очень чувствительна в краткосрочной перспективе. Руководящие принципы, заложенные в основу Испанского руководства по фармакотерапии больных ХОБЛ (GesEPOC) [3], в которых используется своеобразный «терапевтический график», учитывающий уровень риска обострений, степень выраженности одышки и фенотип заболевания, также не способны достаточно точно отражать динамические изменения клинического статуса больного ХОБЛ. В связи с этим следует признать, что современные рекомендации оказываются недостаточно чувствительными, чтобы обнаруживать изменения в состоянии больного, которые бы свидетельствовали о будущих рисках [12].
Отсюда очевиден интерес к новой концепции контроля ХОБЛ, предполагающей поддержание актуального клинического статуса с наименьшим воздействием симптомов болезни в сочетании со стабильным течением, характеризующимся низким риском обострений на протяжении длительного периода времени, адаптированных к тяжести заболевания [8]. И хотя еще недостаточно очевидны все составляющие этой концепции, но уже сегодня можно представить некую условную формулу успешного достижения контроля ХОБЛ, где ключевая роль справедливо отдается «двойной» бронходилатации:
![]()
X – длительно действующий β2-агонист;
Y – длительно действующий антихолинергический препарат;
Z – ингалятор;
Ссv – сердечно-сосудистая коморбидность.


