Введение
Последние два десятилетия ознаменовались ростом числа вспышек заболеваний, вызванных вновь выявленными коронавирусами, такими как коронавирус ближневосточного респираторного синдрома (MERS-CoV) в Саудовской Аравии, коронавирус тяжелого острого респираторного синдрома (SARS-CoV) [1–4]. Уже более полугода мы живем в условиях распространения по миру новой коронавирусной инфекции COVID-19, вызванной вирусом SARS-CoV-2. Исследования показали, что происхождение SARS-CoV-2 связано с летучими мышами [5], панголинами или циветтами как с возможными промежуточными хозяевами вируса [6]. В конце 2019 г. произошла первая вспышка пневмонии, вызванной SARS-CoV-2 в Ухане, провинции Хубэй [7]. В настоящее время пандемия вызвала заболевание более чем у 26 млн и привела к смерти более 870 тыс. жителей 188 стран. Медицинское и научное сообщества разных стран изучают информацию о механизмах передачи, спектре патологических проявлений заболевания, методах диагностики, профилактики и терапии стремительно распространяющейся инфекции.
Эпидемиология
Инфицированные животные и больные люди остаются основным источником инфекции, угрозу для окружающих представляют также бессимптомные носители [8]. Кроме подтвержденных воздушно-капельного (через аэрозоль при чихании и кашле, при условии близкого контакта, а также через аэрозоль, распространяющуюся в закрытом помещении до нескольких метров) и контактного (при контакте с инфицированными поверхностями) путей заражения не исключается возможность передачи инфекции через мочу и кал, а также вертикальный путь от матери к ребенку [9–12].
Все возрастные группы восприимчивы к вирусу, однако доля детей в структуре заболевших относительно невелика. В возрасте от 30 до 69 лет 77,8% больных COVID-19 с самой высокой долей в возрастной группе от 50 до 60 лет [13, 14].
Последние исследования Всемирной организации здравоохранения (ВОЗ) и Китайского центра по контролю и профилактике заболеваний показывают, что R0 (базовое репродуктивное число, характеризующее скорость передачи инфекции) для SARS-CoV-2 составляет 2,68 [15, 16]. Инкубационный период после заражения в среднем продолжается 4–8 дней, но может длиться до 14 дней [17].
Накоплено достаточно данных, чтобы описать клинические варианты течения COVID-19. Изучение более 70 тыс. случаев инфекции показало, что 80,9% пациентов переносят заболевание в легкой или умеренно тяжелой форме. Тяжелые и крайне тяжелые формы связаны с различными факторами, включающими возраст, коморбидную патологию. Частота летальных исходов может колебаться в широких пределах, но в среднем составляет 2,3%. Причиной неблагоприятных исходов в большинстве случаев служит тяжелая дыхательная недостаточность, но, поскольку инфекция может вовлекать не только респираторную систему, смерть пациентов может быть связана с развитием сердечно-сосудистой, почечной, почечной, полиорганной недостаточности [18].
Особенности патогенеза
В большом семействе коронавирусов новый коронавирус SARS-CoV-2 принадлежит к роду β-коронавирусов, так же как и MERS-CoV и SARS-CoV. Для лучшего понимания патогенеза COVID-19-инфекции нередко проводятся сравнения с вспышкой тяжелого острого респираторного синдрома (ТОРС). Действительно, анализ генома SARS-CoV-2 показал значительное сходство с ранее идентифицированным штаммом коронавируса, вызвавшим вспышку атипичной пневмонии, или ТОРС, в 2003 г. [19]. Так, белок нуклеокапсида SARS-CoV-2 почти на 90% идентичен ТОРС-ассоциированному коронавирусу (SARS-CoV) по аминокислотной последовательности. SARS-CoV имеет определенную последовательность аминокислот, включающую 14 связывающих остатков, которые непосредственно взаимодействуют с человеческим ангиотензинпревращающим ферментом 2-го типа (АПФ2). Из этих аминокислот 8 представлены в SARS-CoV-2. Таким образом, АПФ2 также является рецептором для SARS-CoV-2. После проникновения в клетку эпителия респираторного тракта происходит репликация SARS-CoV-2 и сборка новых вирионов. Быстрое продвижение вируса в нижние дыхательные пути вызывает гибель эпителиальных клеток и обширное повреждение альвеолярного эпителия. Механизм патогенеза COVID-19 представляется сложным многоступенчатым процессом, ответственным за инициацию чрезмерной иммунной реакции со стороны организма больного человека. Уровни провоспалительных цитокинов и хемокинов, включая интерлейкин-6 (ИЛ-6), фактор некроза опухоли-α (ФНО-α) и воспалительные белки макрофагов, повышены и играют важную роль в иммунопатологии пациентов с COVID-19 [20]. Цитопатический эффект и т.н. цитокиновый шторм в свою очередь определяют клиническое течение COVID-19 [21]. Прогрессирующая инфекция приводит также к дисфункции эндотелия, к дефекту целостности сосудов (повышению проницаемости), активации диссеминированного внутрисосудистого свертывания крови (ДВС), легочной ишемии, гипоксимической дыхательной недостаточности и к прогрессирующему повреждению легких, включая острый респираторный дистресс-синдром (ОРДС) и пневмониеподобные симптомы [22].
Особое место в патогенезе инфекции играет развитие гиперкоагуляционного состояния, вызванного системным воспалением и дисфункцией эндотелия. У некоторых пациентов с прогрессирующим COVID-19 может развиваться коагулопатия, которая соответствует установленным лабораторным критериям диссеминированного внутрисосудистого свертывания крови. Накопленные данные свидетельствуют: пациенты с COVID-19 подвергаются значительному риску тромбоэмболических осложнений, в основном поражающих венозную, но также и артериальную сосудистую систему. Для выявления нарушений гемостаза всем госпитализированным пациентам рекомендуется определение в крови уровня D-димера, протромбинового времени, фибриногена и развернутого анализа крови, включающего число тромбоцитов. Большинство актуальных рекомендаций, как и рекомендации Минздрава России, включают назначение антикоагулянтной терапии, по крайней мере в режиме профилактики, большинству пациентов с COVID-19 [23, 24].
Проникновение в кровь через инфицированный эпителий позволяет вирусу распространяться за пределы дыхательных путей в различные ткани, включая головной мозг, желудочно-кишечный тракт, сердце, почки и печень, приводя к грозным осложнениям, таким как геморрагический или ишемический инсульт, неврологические расстройства, повреждение миокарда, повреждение желудочно-кишечного тракта и др. [25]. Кроме того, тяжесть течения заболевания может в значительной степени определяться возрастом и наличием сопутствующих заболеваний, таких как артериальная гипертензия, диабет и заболевания легких. Это может быть отражением повышенной экспрессии рецептора АПФ2 на поверхности внутренних органов, включая легкие, сердце, почки, кишечник [26].
Клинический случай 1
Клинические и лабораторные проявления «цитокинового шторма»
Коронавирусная инфекция COVID-19 (вирус идентифицирован), осложнившаяся двусторонней полисегментарной пневмонией (высокая вероятность пневмонии COVID-19, степень тяжести КТ-3), острой дыхательной недостаточностью.
Пациент Р. 59 лет переведен в COVID-центр ГКБ им С.П. Боткина из гематологического отделения, где находился с диагнозом «острый миелоидный лейкоз, состояние после множественных курсов полихимиотерапии, рецидив». На седьмой день госпитализации (1-е сутки заболевания) у пациента повысилась температура тела до 38,5оС, появилась выраженная слабость, одышка при физической нагрузке, сухой кашель. Проведено исследование мазков из рото- и носоглотки на присутствие рибонуклеиновой кислоты (РНК) SARS-Cov-2 методом полимеразной цепной реакции (ПЦР) (результат положительный).
При осмотре в COVID-отделении (2-е сутки заболевания) состояние средней тяжести, одышка в покое отсутствовала, сухой кашель, температура тела – 38,6оС, частота дыхательных движений (ЧДД) – 18 в минуту, артериальное давление (АД) – 133/84 мм рт.ст., частота сердечных сокращений (ЧСС) – 91 уд/мин, уровень насыщенности периферической крови кислородом (SpO2) – 95% при дыхании атмосферным воздухом. Изменение лабораторных параметров: эритроциты – 3,99×1012/л, гемоглобин – 94 г/л, лейкоциты – 3,78×109/л, сегментоядерные нейтрофилы – 2,67×109/л, лимфоциты – 1,21×109/л, тромбоциты – 19×109/л, СОЭ – 27 мм/ч, С-реактивный белок (СРБ) – 85 мг/л, Д-димер – 851 мкг/мл.
Компьютерная томография (КТ) органов грудной клетки от 04.05.2020: высокая вероятность пневмонии COVID-19, степень тяжести – КТ-2.
Терапия (2–6-е сутки заболевания): гидроксихлорохин (800 мг в 1-е сутки, 400 мг в сутки в последующие 6 суток), азитромицин (500 мг/сут 5 дней), гемотрансфузия концентрата тромбоцитов, меропенем (2 г в/в 3 раза в сутки), амикацин (1,5 г в/в 3 раза в сутки), бисептол (960 мг/сут), дексаметазон (12 мг в/в 1 раз в сутки, 10 и 11.05.2020), дезинтоксикационная терапия, симптоматическая терапия (в т.ч. парацетамол в/в 100 мл при температуре тела более 38,5оС), прон-позиция – 12–16 часов в сутки. На фоне проводимой терапии сохранялась температура до 40оС.
На 7–9-е сутки заболевания сохранялась температура тела до 40оС (более 7 суток), одышка (ЧДД – 25–26 в мин), кашель со скудной мокротой. Изменение лабораторных параметров: лейкоциты – 3,1×109/л, лимфоциты – 0,76×109/л, тромбоциты – 46×109/л, гемоглобин – 96 г/л, прокальцитонин – 0,5 нг/мл, СРБ – 102 мг/мл, ИЛ-6 – 91 пк/мл, SpO2 – 78% при дыхании комнатным воздухом (94% на фоне кислородотерапии через лицевую маску, поток 6–12 л/мин), КТ органов грудной клетки (рис. 1) от 10.05.2020 выявила отрицательную динамику.
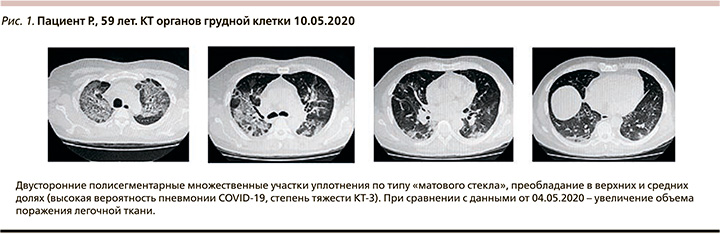
На 10-е сутки заболевания к терапии добавлен тоцилизумаб (400 мг в/в однократно) 12.05.2020. C 12.05.2020 температура тела не превышала 35,8–36,4оС, SpO2 – 94% при дыхании атмосферным воздухом, одышки нет, кашель уменьшился. КТ органов грудной клетки в динамике (рис. 2) – выраженная положительная динамика.
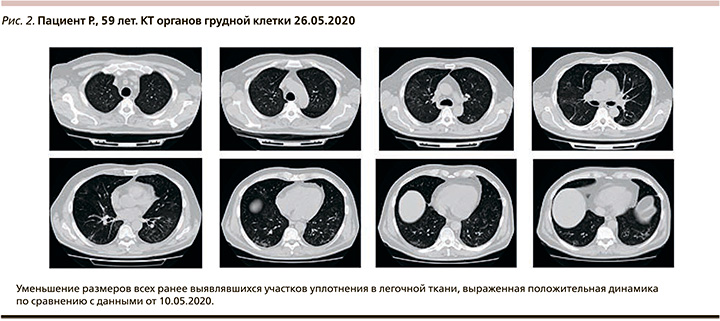
Обсуждение
Большинство исследователей сходятся во мнении, что прогрессирующеее и тяжелое течение COVID-19 тесно связано с массивной продукцией, активацией цитокинов и провоспалительных медиаторов [17, 27, 28]. Термин «цитокиновый шторм» фактически описывает роль иммунной системы в развитии неконтролируемой и генерализованной воспалительной реакции [29]. Впервые термин «цитокиновый шторм» был использован для описания процессов, происходящих при реакции «трансплантат против хозяина» [30]. В дальнейшем выраженный воспалительный ответ изучался при широком спектре инфекционных и неинфекционных заболеваний, включая вспышку птичьего гриппа H5N1 в 2005 г. и пандемию гриппа H1N1 в 2009-м, вспышку SARS-CoV и MERS-CoV [31, 32].
«Цитокиновый шторм», ассоциированный с COVID-19, служит результатом взаимодействия многих иммуноактивных молекул, таких как интерфероны (ИФН), ИЛ, хемокины, колониестимулирующие факторы и ФНО-α (рис. 3). Представляется важным, что «избыточный» воспалительный ответ расценивается как один из основных факторов, приводящих к более тяжелому клиническому течению COVID-19. Наблюдение за пациентами, нуждающимися в госпитализации в отделение реанимации и интенсивной терапии (ОРИТ), показало более высокие концентрации хемокинов CXCL10 и CCL2, ИЛ-2, -7, -10, ФНО-α по сравнению с теми, у кого инфекция была менее тяжелой и не требовала госпитализации в ОРИТ [17, 33].
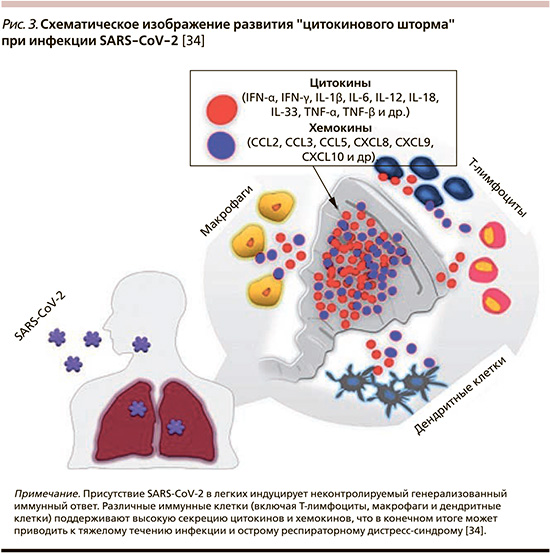
Присутствие SARS-CoV-2 в легких индуцирует неконтролируемый генерализованный иммунный ответ. Различные иммунные клетки (включая Т-лимфоциты, макрофаги и дендритные клетки) поддерживают высокую секрецию цитокинов и хемокинов, что в конечном итоге может приводить к тяжелому течению инфекции и острому респираторному дистресс-синдрому [34].
Интерлейкины – это группа цитокинов, которые участвуют в дифференцировке и активации иммунных клеток, опосредуют хемотаксис, индуцируют усиление острой фазы воспаления, активируют эпителиальные клетки и опосредуют выработку вторичных цитокинов. ИЛ-6, по мнению большинства исследователей, играет ключевую роль в остром воспалении из-за его регулирующей роли [35, 36]. Он продуцируется почти всеми стромальными клетками, В-, Т-лимфоцитами, макрофагами, моноцитами, дендритными, тучными и другими нелимфоцитарными клетками, такими как фибробласты, эндотелиальные клетки, кератиноциты, клубочковые мезангиальные и опухолевые клетки [37, 38]. ИЛ-6 играет ключевую роль в патогенезе «цитокинового шторма» благодаря своим плейотропным (множественным) свойствам.
Различные исследования показали, что сывороточный уровень ИЛ-6 повышен у пациентов с COVID-19 и это коррелирует с тяжестью заболевания [39, 40]. По этой причине высокий уровень ИЛ-6 в сыворотке крови был предложен в качестве предиктора тяжести заболевания [41, 42]. В т.ч. ингибирование фактора транскрипции ИЛ-6 и в результате уменьшение его продукции были связаны со снижением частоты летальных исходов у животных, инфицированных SARS-CoV [43].
С учетом данных об особенностях воспалительной реакции при COVID-19 в международных и отечественных рекомендациях было предложено использовать тоцилизумаб и сарилумаб в качестве компонента патогенетической терапии пациентов с клиническими и лабораторными признаками «цитокинового шторма» [23]. Тоцилизумаб – рекомбинантное гуманизированное моноклональное антитело к человеческому рецептору ИЛ-6 из подкласса иммуноглобулинов IgG, селективно связывается и подавляет как растворимые, так и мембранные рецепторы ИЛ-6, используется в лечении ревматоидного артрита и других хронических воспалительных заболеваний [44].
Показанием к назначению ингибиторов рецепторов ИЛ‑6, согласно рекомендациям Минздрава России, служит сочетание данных КТ органов грудной клетки (значительный объем поражения легочной паренхимы – более 50%, степень тяжести КТ – 3–4) с 2 и более признаками: снижение SpO2; уровень СРБ>60 мг/л или рост уровня СРБ в /3 раза на 8–14-й дни заболевания; лихорадка >38°C в течение 5 дней; число лейкоцитов периферической крови <3,0×109/л; абсолютное число лимфоцитов <1×109/л; уровень ферритина крови >500 нг/мл; уровень ИЛ‑6 >40 пк/мл [23].
Клинические данные свидетельствуют об эффективности однократного или 2-кратного (с интервалом в 12 часов) применения тоцилизумаба при его своевременном назначении, т.е. при наличии признаков «цитокинового шторма» [45] Так, авторы ретроспективного исследования 21 пациента с тяжелым и критическим течением COVID-19 сообщили о стойкой нормализации температуры тела в течение первых суток после однократного внутривенного введения 400 мг тоцилизумаба. В течение пяти дней с момента введения препарата у 75% пациентов исчезла потребность в кислородной терапии. КТ органов грудной клетки показала, что у 90,5% пациентов имело место обратное развитие поражения легких. Кроме того, лабораторный анализ показал, что уровни лимфоцитов крови, СРБ и ИЛ-6 вернулись к нормальным значениям [46]. В другом обсервационном исследовании эффективности тоцилизумаба (в дозах от 80 до 600 мг на введение) в когорте из 15 пациентов с COVID-19 (13,3% пациентов со средней степенью тяжести течения заболевания, 40,0% – с тяжелой и 46,7% – с крайне тяжелой) у всех пациентов уровень СРБ в сыворотке крови был высоким до начала исследования и быстро снижался после введения тоцилизумаба. Динамика уровня ИЛ-6 не была столь однозначной: у 10 пациентов отмечалось снижение уровня ИЛ-6 в сыворотке крови после применения исследуемого препарата, в то время как постоянное повышение наблюдалось у 4 пациентов, что было расценено как клиническая неэффективность [47].
Более поздние данные об эффективности тоцилизумаба в отношении пациентов с COVID-19 получены в итальянском обсервационном исследовании, в котором приняли участие 100 пациентов с COVID-19 и ОРДС, нуждающихся в искусственной вентиляции легких (ИВЛ). Пациенты получали тоцилизумаб в дозе 8 мг/кг в виде двух последовательных внутривенных инфузий с интервалом в 12 часов. Из 100 пролеченных пациентов 43 получали тоцилизумаб в отделении интенсивной терапии, 57 – в общем отделении. Через 10 дней после применения ингибитора рецепторов ИЛ‑6 у 61 (79,2%) было отмечено значительное уменьшение объема поражения легких [48]. Безусловно проведенные исследования имеют ряд ограничений, включающих малое число участников, отсутствие контрольной группы. Вот почему исследования эффективности и безопасности тоцилизумаба продолжаются.
Клинический случай 2
Крайне тяжелое течение COVID-19. Острый респираторный дистресс-синдром
Коронавирусная инфекция COVID-19 (вирус идентифицирован), осложнившаяся двусторонней полисегментарной пневмонией (высокая вероятность пневмонии COVID-19, степень тяжести КТ – 3–4), острой дыхательной недостаточностью, острым респираторным дистресс-синдромом.
Пациентка М. 78 лет переведена в COVID-центр ГКБ им С.П. Боткина из гематологического отделения, где находилась с диагнозом «миелодиспластический синдром/миелопролиферативное заболевание неклассифицируемое». Сопутствовавшие заболевания: ишемическая болезнь сердца – стенокардия напряжения II функционального класса, атеросклеротический кардиосклероз, атеросклероз аорты, коронарных и мозговых артерий, гипертоническая болезнь III стадии (артериальная гипертензия 2-й степени, медикаментозная нормотония, риск сердечно-сосудистых осложнений 4). Нарушение ритма сердца: постоянная форма фибрилляции предсердий, хроническая сердечная недостаточность II Б-ст., III функционального класса (по NYHA), двусторонний гидроторакс.
Госпитализирована по «скорой» с амбулаторного приема в связи с выявлением значительного снижения уровня гемоглобина крови (до 50 г/л) 12.05.2020 в гематологическое отделение (1–12-е сутки заболевания). При поступлении проведено исследование мазков из рото- и носоглотки на присутствие РНК SARS-Cov-2 методом ПЦР (результат положительный), в связи с чем переведена в COVID-центр ГКБ им. С.П. Боткина. При осмотре температура тела – 36,3–36,8оС, умеренный сухой кашель, умеренная одышка при физической нагрузке, SpO2 – 95–96% при дыхании атмосферным воздухом, гемодинамика стабильная. КТ органов грудной клетки в динамике (13.05 и 23.05.2020) – средняя вероятность пневмонии COVID-19, степень тяжести – КТ-1 (рис. 4).
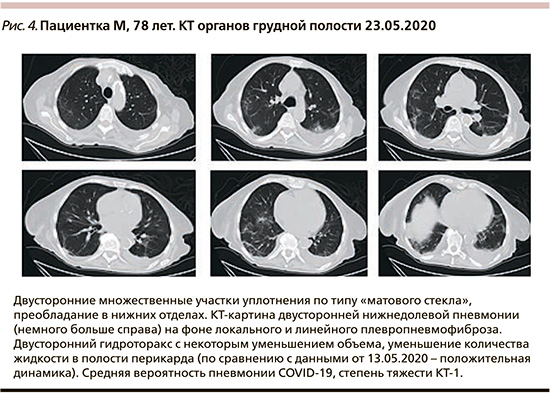
Изменение лабораторных параметров: эритроциты – 2,01×1012/л, гемоглобин – 67 г/л, лейкоциты –25,8–53,7×109/л, сегментоядерные нейтрофилы – 21,5×109/л, лимфоциты – 8,21–7,84×109/л, тромбоциты – 99×109 л, СОЭ – 27 мм/ч, СРБ – 17,1–20,4 мг/л, Д-димер – 673 мкг/мл, ИЛ-6 – 11,2 пк/мл. Терапия: эноксапарин 0,8 мл/сут, бисопролол 5 мг/сут, эналаприл 5 мг/сут, раствор фуросемида 40 мг/сут, спиронолактон 25 мг/сут, амоксациллин/клавулановая кислота 2 г/сут, фамотидин 80 мг/сут, гемотрансфузии взвеси эритроцитов и концентрата тромбоцитов. За период наблюдения была отмечена положительная клинико-инструментальная динамика состояния.
На 13-е сутки заболевания: 24.05.2020 состояние резко ухудшилось, появилась одышка в покое, ЧДД – 35–40 в мин, SpO2 – 75% при дыхании атмосферным воздухом (80–83% на фоне кислородотерапии через лицевую маску, поток – 12 л/мин). КТ органов грудной клетки от 24.05.2020 23:30 (рис. 5) – резкая отрицательная динамика. Изменение лабораторных параметров: прокальцитонин 0,5 нг/мл, СРБ – 92 мг/мл, ИЛ-6 – 98 пк/мл, Д-димер – 754 мкг/мл, тропонин-I – 0,06 нг/мл. Эхокардиография: без отрицательной динамики. Переведена в реанимационное отделение, 25.05.2020 00:30 произведена интубация трахеи, начата ИВЛ. К терапии добавлен левофлоксацин 1 г/сут 25.05.2020.
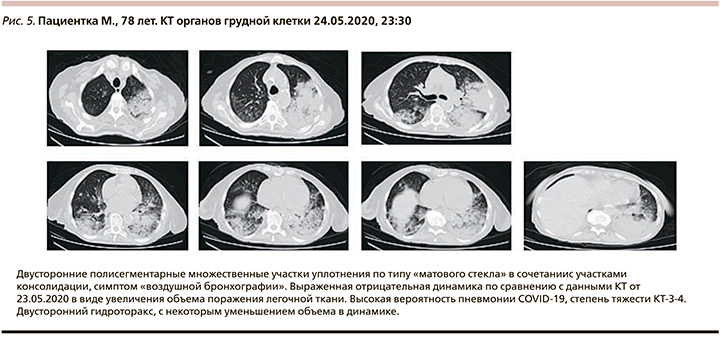
В 05:25 произошла остановка сердечной деятельности, реанимационные мероприятия в течение 30 минут оказались неэффективными.
Обсуждение
Крайне тяжелое течение COVID-19 развивается приблизительно у 5% больных. Летальность колеблется от 1 до 5% (уровень существенно различается в зависимости от страны, возраста, сопутствующих состояний, доступности медицинских ресурсов, уровня охвата населения диагностикой и готовности системы к оказанию помощи большому числу пациентов с тяжелым течением). Доминирующим предиктором тяжелого течения и риска летального исхода является возраст [49, 50]. Действительно, в докладах европейских и китайских специалистов отмечается, что 15–20% случаев смертельных исходов регистрируются в группе пациентов старше 80 лет и <1% – в группе пациентов моложе 50 лет. Причиной смерти в большинстве случаев служит острая дыхательная недостаточность. ОРДС наряду с нарушениями ритма сердца и инфекционно-токсическим шоком остается одним из основных осложнений во время госпитализации и вместе с тем причиной неблагоприятного исхода [33].
ОРДС – гетерогенный клинический синдром, вызываемый различными причинами и характеризующийся острой прогрессирующей дыхательной недостаточностью в результате повреждения и увеличения проницаемости альвеолярно-капиллярной мембраны (синоним – токсический, или некардиогенный, отек легких). Состояние развивается остро (обычно в пределах одной недели от дебюта известной клинической причины) в виде появления и/или быстрого нара-стания степени острой дыхательной недостаточности, которая не полностью объясняется сердечной недостаточностью или перегрузкой объемом [51]. ОРДС может возникать в самых разных клинических ситуациях, включая пневмонию, сепсис, панкреатит, переливание крови. Уровень смертности при этом грозном осложнении достигает 40%.
Вирус-индуцированное поражение респираторных отделов легких называется в числе главных причин ОРДС при инфекции, вызванной SARS-CoV-2, поэтому для объяснения механизмов этого грозного осложнения нередко обращаются к патогенезу ОРДС при пневмонии, вызванной вирусом гриппа А [52, 53]. Согласно этому представлению, присутствие РНК вируса гриппа в цитоплазме клеток респираторного эпителия запускает секрецию ИФН I и III типов и провоспалительных цитокинов, таких как ИЛ-1β и -18, через активацию различных внутриклеточных иммунных механизмов. Это приводит к рекрутированию и активации эффекторных и регуляторных иммунных клеток. Так, альвеолярные макрофаги фагоцитируют инфицированные и апоптотозные эпителиальные клетки, способствуя вирусному клиренсу, секреции большего числа провоспалительных и хемотаксических цитокинов, включая ИЛ-6 и -8, рекрутированию других типов иммунных клеток (нейтрофилов и естественных киллеров) в паренхиму легких и дифференцировке циркулирующих моноцитов в моноцитарные макрофаги и дендритные клетки. Все эти процессы, призванные оказывать защитное действие против гриппозной инфекции и других патогенов, способствуют повреждению легких, которое может стать неконтролируемым [54–56].
Вместе с тем, основываясь на текущем опыте ведения пациентов и принятых т.н. берлинских критериях, некоторые исследователи отмечают, что существует множество клинико-патогенетических различий между ОРДС, связанным с COVID-19, и ОРДС, вызванным другими факторами, что должно влиять на выбор лечебной тактики. Накопленные данные по тяжелому гриппу не вполне объясняют клиническое течение тяжелого COVID-19, дисфункцию эндотелия, а также выраженную лимфопению, связанную с тяжелым заболеванием. Среди клинических различий выделяют более позднее начало с момента развития инфекции – в среднем через 8–12 дней, в некоторых случаях – через 14 дней. При этом на фоне дыхательных нарушений выявляются двусторонние субтотальные уплотнения легочной ткани по типу консолидации и «матового стекла». Объем поражения легочной ткани может увеличиваться стремительно – на 50% за 24–48 часов [57–59].
Несмотря на множество различий, большинство исследователей сходятся во мнении, что респираторная поддержка при ОРДС, связанном с COVID-19, является краеугольным камнем терапии и должна включать неинвазивные и инвазивные методы вентиляции легких. В отсутствие специально разработанного лечение COVID-19-индуцированного ОРДС должно основываться на тех же принципах, что и лечение ОРДС, вызванного другими причинами. Поскольку дыхательная недостаточность может прогрессировать очень быстро, первым шагом должен быть перевод пациента в ОРИТ, применение прон‑позиции не менее 12–16 часов в сутки с высокопоточной оксигенацией потоком 30–60 л/мин или неинвазивной ИВЛ в режиме СРАР (режим искусственной вентиляции легких постоянным положительным давлением) 7–10 см водного столба для поддержания SpO2 92–96%. Далее при сохранении гипоксемии (SpO2<92%), при признаках повышенной работы дыхания (участие вспомогательной мускулатуры, частое глубокое дыхание), усталости пациента, нарушении сознания, нестабильной динамике показана интубация трахеи и инвазивная ИВЛ в сочетании с прон‑позицией [60–62].
Клинический случай 3
COVID-19 и бронхиальная астма (БА)
Коронавирусная инфекция COVID-19 (вирус идентифицирован), осложнившаяся двусторонней полисегментарной пневмонией (высокая вероятность пневмонии COVID-19, степень тяжести – КТ-3), острой дыхательной недостаточностью. Сопутствовавшее заболевание: БА, атопическая форма, частично контролируемая среднетяжелого течения.
Пациентка Я. 56 лет много лет страдает БА, в качестве базисной терапии применяет ингаляции будесонид/формотерол 320/9 мкг/сут, по требованию – фенотерол/ипратропиум. 1–10-е сутки заболевания: 20.06.2020 появились слабость, выраженная одышка при физической нагрузке и в покое, лихорадка до 38,5оС. Самостоятельно применяла цефтриаксон 2 г/сут, азитромицин 500 мг/сут без значимого эффекта. Была госпитализирована в ОРИТ COVID-центра в г. Пскове 25.06.2020. Проводилась терапия гидроксихлорохином в комбинации с азитромицином, вводился тоцилизумаб 400 мг однократно, симптоматическая терапия без значимого эффекта. По согласованию 29.06.2020 переведена в COVID-центр ГКБ им С.П. Боткина в Москве.
На 11–18-е сутки заболевания жалобы на одышку в покое, кашель, преимущественно сухой, выраженную слабость. Дыхание самостоятельное, ЧДД – 20 в минуту, SpO2 – 93% при дыхании атмосферным воздухом (96% на фоне кислородотерапии через лицевую маску, поток – 6 л/мин). Температура тела – 38,5–39,1оС. Гемодинамика стабильная. КТ органов грудной полости от 29.06.2020: многочисленные двусторонние, полисегментарные участки уплотнения по типу матового стекла. Высокая вероятность пневмонии COVID-19, степень тяжести – КТ-3. Изменение лабораторных параметров: гемоглобин – 128 г/л, лейкоциты – 6,3–6,1×109/л, сегментоядерные нейтрофилы – 3,9–3,7×109/л лимфоциты – 2,2–2,3×109/л, тромбоциты – 198–283×109/л, СРБ – 12,69–0,48 мг/л, прокальцитонин <0,5 нг/мл, ИЛ-6 – 5,50 пк/мл, Д-димер – 73–51 мкг/мл. Терапия: прон-позиция 12–16 часов в сутки, инфузионная терапия в/в, аскорбиновая кислота в/в 500 мг/сут, дексаметазон в/в 12 мг/сут, эноксапарин п/к 0,8 мл/сут, амброксол 90 мг/сут, фамотидин 80 мг/сут, будесонид/формотерол 640/18 мкг/сут, беродуал ДАИ 20/50 по 1 вдоху ситуационно. На фоне проводимой терапии отмечена положительная динамика состояния пациентки, дыхательная недостаточность регрессировала, сохранялась субфебрильная температура. При контрольной КТ органов грудной полости 06.07.2020: двусторонние участки уплотнения по типу матового стекла. Двусторонняя полисегментарная пневмония в стадии практически полного обратного развития, положительная динамика по сравнению с исследованием от 29.06.2020. Высокая вероятность пневмонии COVID-19, степень тяжести – КТ-1. Выписана с рекомендацией продолжить базисную терапию БА с применением будесонид/формотерол 640/18 мкг/сут в течение месяца с последующим снижением суточной дозы будесонида при сохранении высокого уровня контроля заболевания.
Обсуждение
Больные БА и аллергическими заболеваниями, как правило, подвержены большему риску тяжелых исходов при респираторных вирусных инфекциях [63]. Кроме того, если БА плохо контролируется, вирус-индуцированное обострение может протекать тяжелее [64]. Это может быть связано с дефицитом врожденных противовирусных иммунных реакций, в т.ч. снижением выработки ИФН-α, -β и -λ клетками респираторной системы, что сопряжено с большей тяжестью обострения БА [65–67].
Однако в последнее время накопились данные, свидетельствующие о том, что распространенность аллергических заболеваний и БА у пациентов с COVID-19 ниже, чем ожидалась, в ряду других сопутствующих заболеваний и факторов риска тяжелых форм COVID-19. Результаты опубликованных исследований показывают: распространенность БА в популяции больных COVID-19 варьировалась от ≤1% в Китае [68, 69] до 7,4–17% в Сое-диненных Штатах Америки [70–72].
Важно отметить, что, несмотря на относительно высокую распространенность БА в некоторых исследованиях, не отмечено существенной разницы в риске госпитализации или смертности из-за COVID-19 у пациентов с БА или без нее. Так, в ретроспективном исследовании 220 (14%) из 1526 пациентов с COVID-19 имели место БА. При этом она не ассоциировалась с повышенным риском госпитализации (относительный риск [ОР]=0,96, 95% доверительный интервал [ДИ]: 0,77–1,19) с учетом возраста, пола и других сопутствовавших заболеваний. Продолжающееся применение ингаляционных глюкокортикостероидов (ИГКС) также не увеличивало риска госпитализации (ОР=1,39, 95% ДИ: 0,90–2,15). Уровень смертности (3,6%) в группе больных COVID-19, страдавших БА, не отличался от такового в популяции COVID-19 без БА (4,9%) [73].
В другом проспективном исследовании с участием 1150 госпитализированных пациентов БА не ассоциировалась с тяжелым течением COVID-19. Из 257 пациентов в крайне тяжелом состоянии только у 21 (8%) в анамнезе фигурировала БА. Для сравнения: 162 (63%) и 92 (36%) пациентов в этой группе страдали артериальной гипертензией и сахарным диабетом соответственно [74].
ИГКС, в т.ч. в комбинации с бронходилататорами, широко используются в лечении БА в качестве базисной терапии [75]. Сомнений в эффективности применения препаратов этой группы на сегодняшний день нет, однако некоторые авторы высказывают опасения относительно их влияния на риск развития инфекций верхних и нижних дыхательных путей у пациентов с хроническими обструктивными заболеваниями. Впрочем, в первую очередь это касается хронической обструктивной болезни легких (ХОБЛ) [76–79].
С другой стороны, появляются данные, свидетельствующие о том, что прием ИГКС может иметь дополнительную пользу в борьбе с вирусными инфекциями, особенно вызванными коронавирусом. Экспериментальные данные in vitro показывают, что будесонид в комбинации с гликопирронием и формотеролом, а также циклесонид могут оказывать ингибирующее действие на репликацию РНК коронавируса и продукцию цитокинов [80–82].
Кроме того, имеются весьма ограниченные данные, что у больных БА, постоянно использующих ИГКС, имеет место более низкая экспрессия АПФ2 и клеточной трансмембранной сериновой протеазы типа 2 (ТСП2) в эпителиальных клетках респираторного тракта. ТСП2 способствует связыванию вируса с АПФ2, активируя его S-протеин, необходимый для проникновения SARS‐CoV‐2 в клетку [83]. Эти данные нуждаются в более весомой доказательной поддержке, поскольку другие исследования показывают, что экспрессия генов АПФ2 и ТСП2 в эпителиальных клетках, выделенных из индуцированной мокроты, не отличалась от таковой у здоровых испытуемых и больных БА [84].
Несомненно, использование ИГКС улучшает контроль и снижает частоту обострений БА. В связи с этим пациенты, отказывающиеся от использования ИГКС из-за опасений по поводу иммуносупрессии, инфицирования SARS-CoV2 и тяжелого течения COVID-19, подвергают себя более значительному риску, связанному с ухудшением течения БА. Эксперты Глобальной стратегии лечения и профилактики бронхиальной астмы (GINA – Global Initiative for Asthma) сформировали дополнительные рекомендации, касающиеся терапии БА в условиях пандемии COVID-19. Согласно этим рекомендациям, больные БА должны продолжать прием базисной терапии, включая ИГКС, как предписано их врачом. При обострении БА может назначаться короткий курс пероральных ГКС, если это определено индивидуальным планом или рекомендовано лечащим врачом, чтобы предотвратить серьезные последствия. При необходимости длительного применения системных ГКС лечение должно быть продолжено в минимально возможной дозе, необходимой для снижения риска тяжелых приступов/обострений БА. Использование биологических препаратов должно быть продолжено больными с тяжелой БА, чтобы максимально ограничить потребность в системных ГКС. По возможности следует избегать использования небулайзеров из-за повышенного риска распространения COVID-19. Предпочтительно использовать дозированные аэрозольные ингаляторы под давлением (pMDI) со спейсером. Поддерживающая ингаляционная терапия БА не должна прекращаться ни амбулаторно, ни во время госпитализации [85].
Клинический случай 4
COVID-19 и ХОБЛ
Коронавирусная инфекция COVID-19 (вирус идентифицирован), осложнившаяся двусторонней полисегментарной пневмонией (высокая вероятность пневмонии COVID-19, степень тяжести – КТ-1), острой дыхательной недостаточностью, кровохарканьем. Сопутствовавшие заболевания: хроническая обструктивная болезнь легких, среднетяжелое течение, обострение. Буллезная эмфизема. Гипертоническая болезнь II стадии (артериальная гипертензия 2-й степени, риск сердечно-сосудистых осложнений 2). Сахарный диабет 2 типа средней тяжести.
Пациент М. 44 лет страдает ХОБЛ около 3 лет, постоянной терапии не получает, ситуационно использует ингаляции фенотерол/ипратропий. Индекс курящего человека 15 пачка/лет. Много лет страдает гипертонической болезнью (постоянной терапии не получает), сахарным диабетом 2 типа (постоянно принимает метформин 2000 мг/сут).
Ухудшение состояния отметил за 3 дня до госпитализации, когда почувствовал усиление одышки при привычной физической нагрузке, сдавление в грудной клетке, усиление кашля с мокротой желтого цвета. Температура тела не повышалась. В связи с усилением одышки и появлением в мокроте прожилок крови пациент госпитализирован «по скорой» в пульмонологическое отделение. При поступлении проведено исследование мазков из рото- и носоглотки на присутствие РНК SARS-Cov-2 методом ПЦР (результат положительный), в связи с чем переведен в COVID-центр ГКБ им. С.П. Боткина.
На 1–10-е сутки заболевания жалобы на одышку в покое, кашель с мокротой желто-зеленого цвета. Дыхание самостоятельное, ЧДД – 21 в минуту, SpO2 – 92% при дыхании атмосферным воздухом (95% на фоне кислородотерапии через лицевую маску, поток – 6 л/мин). Температура тела – 36,5оС. Гемодинамика стабильная. КТ органов грудной клетки от 15.05.2020: данных за интерстициальную пневмонию не получено; выявляются признаки диффузного пневмосклероза; буллезная эмфизема. По результатам проведенного обследования данных за тромбоэмболию легочной артерии не получено. Изменение лабораторных параметров: гемоглобин – 166 г/л, лейкоциты – 7,4×109/л, сегментоядерные нейтрофилы – 4,8×109/л, лимфоциты – 2,9×109/л, тромбоциты – 254×109/л, СОЭ – 27 мм/ч, СРБ – 21,4 мг/л, Д-димер 78 мкг/мл, ИЛ-6 – 14,08 пг/мл.
Эхокардиография с допплеровским анализом от 19.05.2020: уплотнение стенки аорты, аорта не расширена в восходящем отделе, незначительная аортальная регургитация. Уплотнение створок клапанов сердца, незначительная митральная, трикуспидальная и легочная регургитация. Умеренная асимметричная гипертрофия миокарда левого желудочка (ЛЖ), камеры сердца в пределах нормы. Систолическая функция ЛЖ удовлетворительная (фракция выброса – 57%). Нарушение диастолической функции ЛЖ 1-го типа. Не выявлены зоны нарушения локальной сократимости. Незначительная легочная гипертензия (систолическое давление в легочной артерии – 36 мм рт.ст.). В полости перикарда жидкости нет, в плевральных полостях жидкости нет.
Бронхоскопия от 21.05.2020: диффузный двусторонний деформирующий бронхит с признаками атрофии слизистой оболочки, в просвете бронхов вязкий секрет; данные за кровотечение не получены. Терапия: инфузионная, инсулин актрапид п/к при уровне глюкозы крови >10,0 ммоль/л – 4–10 ЕД, фраксипарин – 0,3 МЕ п/к 1 раз в сутки, гидроксихлорохин (800 мг в 1-е сутки, 400 мг/сут в последующие 6 суток), азитромицин (500 мг/сут 5 дней), верапамил 240 мг/сут, омепразол 40 мг/сут, ингаляции через небулайзер (фенотерол/ипратропий 0,5/0,25 мг 3 раза в сутки, амброксол 90 мг/сут), ингаляции тиотропиумом Респимат 5 мкг/сут, прон-позиция – 12–16 часов в сутки.
На 11–20-е сутки заболевания: на фоне проведенного лечения с 24.05.2020 отмечалось повышение температуры тела до 37,8–38,9оС. Одышка в покое не беспокоила, кашель с мокротой желтого цвета, кровохарканье не рецидивировало. Дыхание самостоятельное, ЧДД – 18 в минуту, SpO2 – 94% при дыхании атмосферным воздухом. КТ органов грудной полости от 25.06.2020: немногочисленные, двусторонние, полисегментарные участки уплотнения по типу матового стекла. Высокая вероятность пневмонии COVID-19, степень тяжести – КТ-1 (рис. 6).
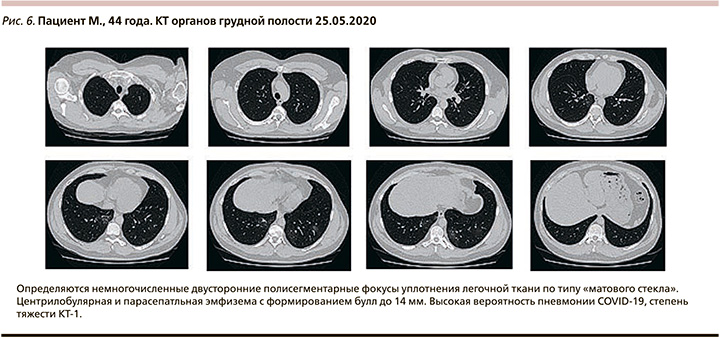
Изменения лабораторных параметров: гемоглобин – 168 г/л, лейкоциты – 13,2×109/л, сегментоядерные нейтрофилы – 9,1×109/л лимфоциты – 3,2×109/л, тромбоциты – 278×109/л, СРБ – 119,4 мг/л, Д-димер – 258 мкг/мл, ИЛ-6 – 32,96 пк/мл. К терапии добавлен левофлоксацин в/в 1000 мг/сут, дезинтоксикационная и симптоматическая терапия (в т.ч. парацетамол в/в 100 мл при температуре тела более 38,0оС).
На фоне проводимой терапии симптомы дыхательной недостаточности регрессировали, одышка, кашель и количество экспекторируемой мокроты уменьшились, температура тела стойко нормализовалась. КТ органов грудной полости от 07.06.2020: уменьшение числа и размеров фокусов уплотнения по типу матового стекла, отмечается замещение и появление зон консолидации. Изменения двусторонние, расположены преимущественно в периферических отделах. Высокая вероятность пневмонии COVID-19, степень тяжести – КТ-2. По сравнению с исследованием от 25.05.2020 – закономерная положительная динамика.
Пациент выписан с рекомендацией продолжить базисную терапию ХОБЛ с применением тиотропиума Респимата 5 мкг/сут.
Обсуждение
ХОБЛ ассоциируется с повышенным риском заболеваемости и смертности от внебольничной пневмонии [86]. Нарушение местной и системной воспалительной реакций, дисбаланс микробной флоры дыхательных путей, продолжающаяся избыточная секреция бронхиальной слизи, структурные повреждения стенки бронхов и применение ИГКС называются в качестве причин такого риска [87, 88]. Кроме того, вирусные инфекции, в т.ч. вызванные вирусом гриппа А, респираторным синцитиальным вирусом и риновирусом, лидируют среди причин госпитализаций пациентов с ХОБЛ [89]. С другой стороны, исследования показывают, что распространенность ХОБЛ у больных COVID-19 была ниже ожидаемой [17, 90]. И это на фоне данных, будто уровень АПФ2-рецептора для прикрепления коронавируса SARS-CoV-2 на поверхности респираторного эпителия может быть повышенным у больных ХОБЛ и курящих людей [91, 92].
В то время как ХОБЛ не обязательно увеличивает риск заражения SARS-CoV-2, воспалительный каскад, развивающийся при COVID-19, может иметь особенно разрушительные последствия для пациента с ХОБЛ. Y. Zhou et al. провели мета-анализ 34 исследований с целью оценки возможной взаимосвязи хронических заболеваний и тяжести течения COVID-19 [93]. Среди пациентов с тяжелым или фатальным COVID-19 наиболее распространенной сопутствовавшей патологией были ожирение (42%; 95% ДИ: 34–49%) и артериальная гипертензия (40%; 95% ДИ: 35–45%). Далее следовали сахарный диабет (17%; 95% ДИ: 15–20%), сердечно-сосудистые заболевания (13%; 95% ДИ: 11–15%), респираторные заболевания (8%; 95% ДИ: 6–10%), болезни сосудов головного мозга (6%; 95% ДИ: 4–8%), злокачественные новообразования (4%; 95% ДИ: 3–6%), хронические заболевания почек (3%; 95% ДИ: 2–4%) и печени (2%; 95% ДИ: 1–3%). Несмотря на то что респираторные заболевания были относительно редки среди сопутствовавших заболеваний, эта группа заболеваний (прежде всего ХОБЛ) вышла на первые позиции по влиянию на уровень относительного риска (ОР) неблагоприятных исходов COVID-19, таких как тяжелые клинические проявления (ОР=4,17, 95% ДИ: 2,67–6,50), перевод в ОРИТ (ОР=3,32, (95% ДИ: 2,55–4,32) и смерть (ОР=4,06, 95% ДИ: 1,77–9,31).
В другом мета-анализе 7 исследований с участием 1592 пациентов с COVID-19, 314 (19,7%) из которых имели тяжелое заболевание, было продемонстрировано, что ХОБЛ связана со значительным, более чем 5-кратным повышением риска тяжелой инфекции COVID-19 [94].
Важно также упомянуть о дискуссии, развернувшейся вокруг влияния курения, повышающего уровень АПФ-2 в клетках респираторного эпителия, на риск инфицирования SARS-CoV2, течение коронавирусной инфекции.
Проведя оценку распространенности курения в 11 сериях случаев COVID-19, K. Farsalinos et al. показали, что популяция курящих людей среди больных оказывается ниже ожидаемой. ВОЗ поспешила выпустить предупреждение от 04.05.2020 о рисках употребления табака во время этой пандемии [95].
В дальнейшем появились убедительные данные, согласно которым, несмотря на невысокую распространенность, исходы заболевания и результаты лечения COVID-19 хуже у курящих пациентов, чем у некурящих. Так, анализ, проведенный M.E. Killerby et al. в отношении 220 госпитализированных и 311 амбулаторных пациентов с COVID-19, продемонстрировал, что курение служит независимым фактором риска госпитализации с коэффициентом вероятности 2,3 (95% ДИ: 1,2–4,5) [96]. Другой мета-анализ подтвердил, что курильщики подвержены более высокому риску тяжелого, рефрактерного или прогрессирующего течения COVID-19 (ОР=1,34, 95% ДИ: 1,07–1,67) [97].
На сегодняшний день в нашем распоряжении имеются дополнительные рекомендации экспертов Глобальной инициативы по хронической обструктивной болезни легких (GOLD – Global Initiative for Chronic Obstructive Lung Disease) по ведению больных ХОБЛ в условиях пандемии, в которых признается, что ХОБЛ является одним из наиболее значимых факторов риска тяжелого течения и неблагоприятного исхода COVID-19 в ряду хронических патологических состояний. GOLD настоятельно рекомендует больным ХОБЛ следовать рекомендациям по ведению заболевания, принятым в своих странах экспертными группами, чтобы попытаться свести к минимуму вероятность заражения.
В настоящее время нет никаких научных доказательств, что ИГКС (или пероральные ГКС) следует отменять/не назначать пациентам с ХОБЛ во время пандемии COVID-19. Пациенты с ХОБЛ должны продолжать регулярную базисную терапию. При необходимости следует проводить кислородную терапию в соответствии со стандартными рекомендациями [98].
Заключение
Уже более полугода мы живем в условиях распространения во всем мире новой коронавирусной инфекции COVID-19, вызванной вирусом SARS-CoV-2. Безусловно, это слишком короткий срок, чтобы прояснить все аспекты этой вирусной инфекции. Многое еще предстоит изучить, и задачи ближайшего будущего состоят в том, чтобы дополнить наше понимание эпидемиологии, патофизиологии, особенностей клинического течения этого нового инфекционного заболевания. Остается много вопросов, касающихся взаимодействия вируса и организма человека. До сих пор не доказана эффективность ни одного из противовирусных препаратов. В настоящей статье освещены лишь некоторые аспекты патогенеза и клинического течения, а также связанные с этими аспектами возможности оптимизации терапии.
Основываясь на современных знаниях, многогранная, порой избыточная и неконтролируемая реакция со стороны иммунной системы определяет чрезвычайно изменчивый спектр клинических проявлений COVID-19, который колеблется от бессимптомного течения до смертельной двусторонней пневмонии и полиорганной недостаточности. «Цитокиновый шторм» представляется одним из наиболее серьезных и потенциально опасных для жизни событий, ассоциирующихся с наиболее тяжелым клиническим течением COVID-19, в т.ч. с развитием ОРДС. Противовоспалительная терапия, включая антитела к рецептору ИЛ-6, а также своевременная и адекватная респираторная поддержка, без сомнения, доказали свою эффективность в лечении этих тяжелых пациентов.
Чрезвычайно важным представляется изучение механизмов влияния факторов, связанных с пациентом, определяющих клиническое течение и исход инфекции. Хронические заболевания и состояния, в первую очередь хронические респираторные заболевания, а именно БА и ХОБЛ, могут драматически влиять на судьбу пациента, инфицированного SARS-CoV-2. Вот почему строго рекомендуются профилактические меры для предотвращения инфицирования и продолжение базисной терапии БА и ХОБЛ, включая ИГКС, для снижения риска обострения хронического заболевания, с одной стороны, и улучшения исходов COVID-19, с другой.
Мы извлекаем уроки из предшествовавших вспышек коронавирусных инфекций SARS-CoV и MERS-CoV.
И многое еще предстоит изучить, чтобы сделать вывод: насколько SARS-CoV-2 похож на своих предшественников и в чем его характерные особенности?


