Введение
Пандемия коронавирусной болезни (COVID-19), вызванная высококонтагиозным короновирусом SARS-CoV-2, все еще находится на пике своей активности, вызывая тысячи смертей каждую неделю. Несмотря на то что в настоящее время проводится несколько крупных рандомизированных испытаний новых лекарств, текущая выживаемость больных COVID-19 с тяжелыми формами болезни полностью зависит от их обеспечения наиболее эффективной на сегодняшний день терапией [1]. Существующие клинические рекомендации по ведению тяжелых случаев COVID-19 в основном руководствуются принципами терапии вирусных пневмоний и сепсиса [2–5]. Однако COVID-19, по-видимому, имеет другую патофизиологию, отличную от привычных вирусных пневмоний и сепсиса. Кроме того, большинство клинических рекомендаций оперирует «богатыми ресурсами» (например, наличием современных аппаратов искусственной вентиляции лeгких [ИВЛ], установками экстракорпоральной мембранной оксигенации крови), которые могут отсутствовать в условиях «бюджетного» здравоохранения. Целью настоящего обзора стал анализ возможных методов эффективной респираторной поддержки пациентов с COVID-19 в реальной клинической практике.
Особенности патофизиологии и гистопатологии COVID-19
Подобно коронавирусу тяжелого острого респираторного синдрома (SARS), вирус SARS-CoV-2 поступает в клетку, используя рецептор ангиотензин-превращающего фермента-2, который присутствует в большинстве тканей человека, включая сосудистый эндотелий (в т.ч. сосудов легких), слизистые оболочки (в т.ч. полости рта и носоглотки), легочную ткань (пневмоциты II типа) [6]. Недавно проведенные исследования пациентов с COVID-19 обнаружили две различные патофизиологические закономерности, способствующие тяжелым легочным повреждениям [7]. Так, у пациентов с постоянной высокой вирусной нагрузкой в верхних и нижних дыхательных путях легочное повреждение сопровождается прямым цитопатическим действием вируса. Альтернативной моделью служит двуфазная эволюция болезни, которая вначале характеризуется умеренными симптомами, за которыми после 7–10 дней болезни следует быстроразвивающаяся «поздняя» дыхательная недостаточность. Это происходит, несмотря на снижение вирусной нагрузки, что означает присутствие иммунного патогенеза повреждения легких. Это хорошо согласуется с обнаружением у таких пациентов высоких концентраций провоспалительных цитокинов в плазме крови на «поздних» стадиях заболевания (через 15–20 дней) [8, 9]. На сегодняшний день опубликовано лишь несколько гистопатологических исследований пациентов с COVID-19. Они описывают быстрое начало заболевания с развитием альвеолярного отека, белкового экссудата, реактивной гиперплазии пневмоцитов при достаточно слабой воспалительной инфильтрации [10]. Более того, в легочной ткани умерших пациентов с COVID-19 обнаруживались обширная белковая и серозная экссудация альвеол, образование гиалиновых мембран, воспалительная инфильтрация многоядерными синцитиальными клетками. В альвеолярном пространстве инфильтрат содержал моно- и лимфоциты. Клетки альвеолярного эпителия II типа имели включения вирусных частиц, характеризовались гиперплазией, а также некрозом и десквамацией. Микрососудистая сеть легких была представлена отеком сосудов и микротромбами. В участках легочной ткани определяли альвеолярную организацию экссудата и интерстициальный фиброз [11]. Признано, что COVID-19 имеет три фазы, которые могут быть описаны следующим образом: «ранний» инфекционный процесс (чаще катаральный), легочная инфекция («матовое стекло»), общее тяжелое инфекционное воспаление (пневмония, сепсис) [12, 13] (рис. 1).
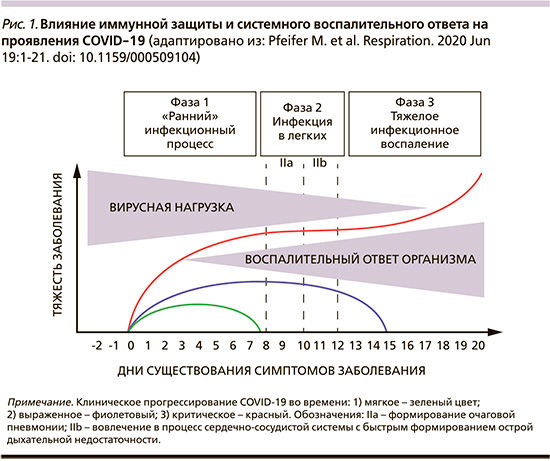
Во время «ранней фазы» инфекции вирус инфильтрирует легочную паренхиму и начинается его репликация. Это вызывает воспалительную реакцию с вовлечением местной вазодилатации, усилением проницаемости эндотелия, рекрутирует в зону воспаления лейкоциты [14]. Фактически это свидетельствует о вирусной «очаговой пневмонии» с формированием тяжелой гипоксемии и сердечно-сосудистой реакции на стресс. У большинства пациентов с COVID-19 наличие микротромбов, повышение уровня D-димеров в плазме ассоциировались с плохим прогнозом, а периферический легочный тромбоз и эмболия были обычным явлением при тяжелой форме COVID-19 с острой дыхательной недостаточностью [15]. С точки зрения патофизиологии дыхательной недостаточности она характеризуется как гипоксическая. Однако в ряде случаев у пациентов с COVID-19 значительно увеличивается парциальное давление углекислого газа (PaCO2), т.е. развивается гиперкапния. Более того, у пациентов, интубированных и вентилируемых, в этой фазе заболевания существенно увеличивается альвеолярно-артериальный кислородный градиент с учетом высокой фракции кислорода (FiO2 >50%) и дыхательным коэффициентом 0,85. Это свидетельствует в пользу особого вида «пневмонии» с острым повреждением легких, существенно отличающейся от бактериальной или пневмонии при септическом шоке, часто вызывающей респираторный дистресс-синдром у взрослых [16].
Особенности респираторной поддержки пациентов с COVID-19
Понимание особенностей патофизиологии и гистопатологии COVID-19 принципиально важно для установления типа и времени начала респираторной поддержки, преследующей цель поддерживать постоянство газообмена у пациентов (жизнь-сберегающая терапия). Респираторная поддержка объединяет методы неинвазивной ИВЛ (НИВЛ) через маски или шлемы, а также варианты кислородотерапии:
- неотложная оксигенотерапия (НОТ; через назальные канюли и/или маски Вентури с потоком 5–15 л/мин);
- высокопоточная назальная оксигенотерапия (ВНОТ; через специальные назальные канюли с FiO2 >30%);
- длительная оксигенотерапия (через назальные канюли потоком 1,5–2,0 л/мин); 4) ингаляционная терапия теплой гелий-кислородной смесью (термический гелий; t-He/O2) через специальный аппаратный комплекс «Гелиокс» [3]. Метод механической инвазивной (интубационной или трахеостомической) ИВЛ относят к вентиляционной поддержке, и далее он рассматриваться нами не будет, поскольку достаточно конкретно и четко изложен в методических рекомендациях 2020 г.
«Анестезиолого-реанимационное обеспечение пациентов с новой коронавирусной инфекцией COVID-19» Общероссийской общественной организации «Федерация анестезиологов и реаниматологов» [5].
Инфекционный контроль при респираторной поддержке
Вирусный агент SARS-CoV-2 имеет диаметр 60140 нм, основным путем его передачи признается аэрогенный (воздушно-капельный). Риск воздействия на медицинского работника выдыхаемого инфицированным человеком аэрозоля считается реальной проблемой терапии пациентов с COVID-19. Критически важно соблюдать санитарные нормы и персональную защиту специалистов в области респираторной медицины. Каждого пациента с COVID-19 при проведении респираторной поддержки следует изолировать: 1) в помещении с отрицательным давлением с 12-кратным воздухообменом в час; 2) в помещении с естественной вентиляцией не менее 160 л/с на пациента. Медицинский персонал должен использовать максимум средств индивидуальной защиты (СИЗ) с фильтрующими респираторами/масками FFP3 N-95 и средствами защиты глаз (защитный щиток или очки защитные). Гигиена рук водой с мылом или дезинфицирующими средствами на спиртовой основе, надевание двух пар перчаток остаются чрезвычайно важным методом защиты и должны быть стандартной практикой во всех медицинских учреждениях. Другие стратегии инфекционного контроля включают сведение к минимуму числа необходимых контактов респираторных специалистов с пациентами COVID-19 с прекращением контактов для лиц, непосредственно не участвующих в уходе за пациентом [17, 18].
Особенности проведения кислородотерапии
Оксигенотерапия в различных ее формах рекомендована в качестве терапии первой линии для лечения респираторного дистресса и гипоксии, вызванных COVID-19. Цель оксигенотерапии – устойчивое поддержание уровня SpO2 >90%. Для беременных пациенток с COVID-19 необходимый показатель SpO2 составляет 93–95% [2–5].
Носовая канюля. Оксигенотерапия, проводимая посредством носовой канюли, позволяет создавать поток кислорода на уровне 5–6 л/мин, что увеличивает фракцию O2 в газовой смеси (FiO2) лишь до 45%. Фактический показатель FiO2 может существенно изменяться в зависимости от скорости пикового потока вдоха больного. Более того, сопротивление системы подачи газовой смеси и регламентированные утечки не позволяют создавать высокие концентрации кислорода при любых настройках оборудования. Важно адекватное увлажнение подаваемого кислорода, необходимое для поддержания мукоцилиарного клиренса [19]. Доставка кислорода может вызывать значительное рассеивание выдыхаемого пациентом «облака» с максимальным расстоянием рассеивания частиц 30 см при скорости потока 1 л/мин и 40 см при скорости в 5 л/мин [20].
Носовая маска. Кислородные маски позволяют создавать поток кислорода с уровнем 5–10 л/мин, что увеличивает фракцию O2 в газовой смеси (FiO2) лишь до 55%. Такая доставка вызывает рассеивание частиц на 40 см при скорости потока 10 л/мин [20].
Маска «Вентури». Кислородные маски «Вентури» обеспечивают доставку кислорода на уровне 24–60% посредством специальных «трубок Вентури», позволяя точно дозировать FiO2. При этом скорость потока кислорода варьируется от 2 до 15 л/мин. Такая доставка вызывает рассеивание частиц на 33 см при FiO2 40% и на 40 см при FiO2 24% [20].
Маска без обратного захвата углекислоты (ребризинговая маска). Ребризинговые кислородные маски (РКМ) создают самый безопасный способ обеспечения кислородом пациентов с COVID-19, практически исключая возможность рассеивания частиц. Они позволяют создавать FiO2 90% при потоках кислорода в 15 л/мин. Для предотвращения возможной гиперкапнии специальный «мешок выдоха» должен быть всегда раздутым, для чего требуется поток не менее 10 л/мин. Такая доставка вызывает рассеивание частиц на минимальное расстояние (<10 см) при скорости потока 10 л/мин [20].
Особенности проведения t-He/O2
Проведение t-He/O2 через специальные аппаратные комплексы (Гелиокс Экстрим) обеспечивает эффективную и безопасную доставку кислорода больным COVID-19 с FiO2 30–70%. Более того, аппарат позволяет создавать однородную гелий-кислородную смесь, многократно изменять и мониторировать процентное содержание гелия и кислорода, температуру ингалируемой газовой смеси во время одной процедуры с целью определения наиболее эффективного режима для каждого пациента, обеспечивать во время процедуры соответствие фактического содержания гелия, кислорода и температуры заданным параметрам, мониторировать во время процедуры необходимые параметры (дыхательный объем, частоту дыхания, сатурацию), формировать равномерный ламинарный поток газовой смеси, подавать необходимые лекарственные средства через небулайзер, встроенный в дыхательный контур. Такая доставка вызывает рассеивание частиц на 30 см при FiO2 30% и на 40 см при FiO2 70% [3, 5].
Особенности проведения ВНОТ
Высокопоточная назальная оксигенотерапия проводится посредством носовой канюли с высоким расходом кислорода и высокоскоростной инсуффляцией газовой смеси. Аппаратные комплексы ВНОТ обеспечивают нагревание, 100%-ное увлажнение обогащенной газовой смеси с FiO2 30–90% с регулировкой скорости потока от 40 до 60 л/мин. Особый механизм действия ВНОТ связан с уменьшением мертвого пространства, низким уровнем конечно-экспираторного давления (PEEP), снижением частоты и работы дыхания. Такая доставка вызывает рассеивание частиц на 17 см при FiO2 60% и скорости потока 60 л/мин [21].
Особенности проведения НИВЛ/СРАР
В реальной клинической практике проведение НИВЛ больным COVID-19 осуществимо в режиме постоянного положительного давления в дыхательных путях (англ. continuous positive airway pressure – CPAP), обеспечивающего поддержание газообменной функции пациентов на всех этапах дыхательного цикла. При этом пациенту необходима способность самостоятельного дыхания и преодоления положительного давления на выдохе. Такие аппаратные вентиляционные комплексы способны обеспечивать FiO2 на уровне 100% в замкнутом вентиляционном контуре. Риск образования и рассеивания аэрозоля таких систем зависит от параметров вентиляции, характеристик назальных масок, использования вирусных фильтров. Уровень рассеивания частиц при СРАР-терапии через назальную маску составляет 40 см при CPAP, равном 10 мбар [22]. Использование вместо маски гарнитуры «ШЛЕМ» уменьшает рассеивание частиц от границы раздела «шлем–шея» до 2,7 см при сохранении требуемых параметров CPAP-терапии [23]. Выбор лицевой гарнитуры CPAP зависит от степени контаминации окружающей среды [4]:
- 1-й выбор – невентилируемая полная лицевая маска с вирусным фильтром на выдохе;
- 2-й выбор – шлем с воздушной подушкой для CPAP;
- 3-й выбор – шлем без воздушной подушки для CPAP;
- 4-й выбор – стандартная маска для лица.
Алгоритм проведения респираторной поддержки
Учтя существующие отечественные и зарубежные клинические рекомендации [3–5], нами выполнен анализ подходов к проведению респираторной поддержки пациентам с COVID-19. Нам удалось стандартизировать основные этапы оказания респираторного пособия, практически по времени и объему идентичные во всех указанных рекомендациях. Ниже представлен ступенчатый алгоритм действий при COVID-19 (рис. 2).
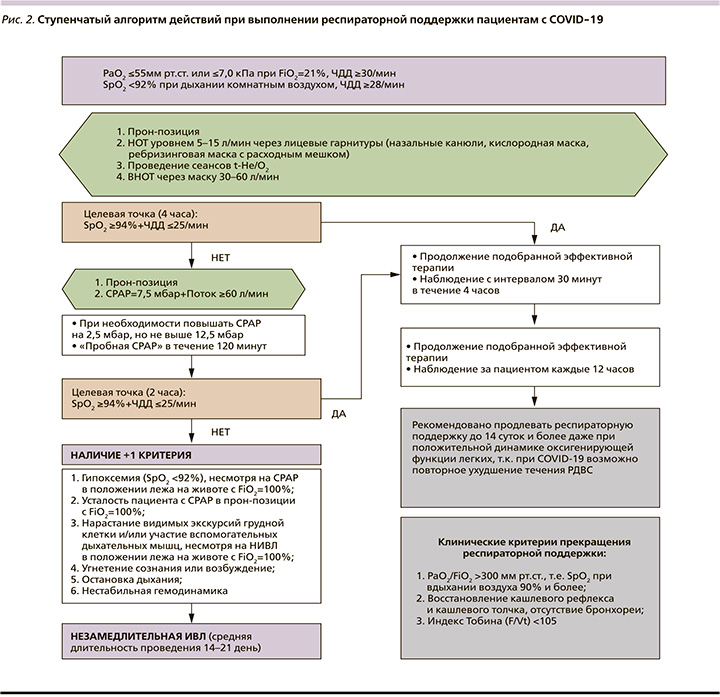
1-я ступень
Всем пациентам с симптомами COVID-19 при определении у них SpO2 <92% при дыхании комнатным воздухом (FiO2 – 21%) или при установлении PaO2 ≤55 мм рт.ст. (≤7,0 кПа) незамедлительно требуется:
1) обеспечить пациенту «прон-позицию» (лежа на животе), в которой он должен находиться не менее 16 часов в сутки; 2) начать НОТ через лицевую маску, назальные канюли, ребризинговую маску со скоростью потока 5,0–15,0 л/мин для достижения целевых значений SpO2 ≥94% и частоты дыхательных движений (ЧДД) ≤28/мин (оптимальные значения SpO2 – 96–98% и ЧДД – 24/мин). Если есть возможность проведения: 3) выполнить сеансы t-He/O2 не менее 4 ингаляций в сутки с индивидуальным подбором уровня FiO2, не допускающим развития гиперкапнии; 4) при невозможности выполнения сеансов t-He/O2 приступить к ВНОТ через «защитную маску» (специализированная гарнитура для высокопоточной оксигенотерапии) с уровнем 30‑60 л/мин.
В случае достижения целевых значений SpO2 ≥94% и ЧДД ≤25/мин подобранный индивидуальный способ респираторной поддержки выполняется базисно до 14 суток даже при сохранении положительной динамики оксигенирующей функции легких. Мониторинг жизненных показателей требуется выполнять первые 4 часа каждые 30 минут, далее каждые 12 часов. Прекращение респираторной поддержки возможно только при достижении следующих устойчивых (не менее пяти последовательных дней) клинических критериев:
- PaO2/FiO2 >300 мм рт.ст., т.е. SpO2 при дыхании комнатным воздухом >90%.
- Восстановление кашлевого рефлекса и кашлевого толчка, отсутствие бронхореи.
- Индекс Тобина (f/Vt) <105.
2-я ступень
Кислородотерапия, не обеспечивающая целевых значений SpO2 ≥94% и ЧДД ≤25/мин через 4 часа, потребует выполнения НИВЛ в режиме CPAP 7,5 мбар с потоком кислорода ≥60 л/мин при сохранении пациента в «прон-позиции». При необходимости проводят титрацию уровня респираторной поддержки: ступенчато повышают СРАР на 2,5 мбар, но не выше 12,5 мбар. При достижении желаемого эффекта (SpO2 ≥94% и ЧДД ≤25/мин) длительность «пробной» СРАР-терапии должна быть не менее 120 минут. Через 2 часа проводится клиническая оценка ответа на проводимую терапию. В случае отсутствия ответа на СРАР и наличия хотя бы одного «критического признака»: 1) гипоксемия (SpO2 <92%), несмотря на СРАР, в положении лежа на животе с FiO2 100%; 2) усталость пациента на СРАР в пронпозиции с FiO2 100%; 3) нарастание видимых экскурсий грудной клетки и/или участие вспомогательных дыхательных мышц, несмотря на СРАР в положении лежа на животе с FiO2 100%; 4) угнетение сознания или возбуждение; 5) остановка дыхания; 6) нестабильная гемодинамика – неотлагательно выполняется интубация или трахеостомия с дальнейшим проведением ИВЛ по жизненным показаниям. При тяжелом течении COVID-19 средняя продолжительность ИВЛ составляла 14–21 день [22, 23]. В случае положительного ответа на СРАР рекомендуется продлевать респираторную поддержку до 14 суток и более даже при положительной динамике оксигенирующей функции легких, т.к. при COVID‑19 возможно повторное ухудшение течения респираторного дистресс-синдрома. Прекращение респираторной поддержки возможно только при достижении устойчивых (не менее 5 последовательных дней) клинических критериев, описанных выше для первой ступени.
Важно знать, что проведение СРАР-терапии не рекомендуется больным COVID-19 со следующими явлениями [3–5]:
- Отсутствие самостоятельного дыхания (апноэ);
- Нестабильная гемодинамика (гипотензия, ишемия или инфаркт миокарда, жизнь-угрожающая аритмия, неконтролируемая артериальная гипертензия);
- Невозможность обеспечить защиту дыхательных путей (нарушение кашля и глотания) и высокий риск аспирации;
- Избыточная бронхиальная секреция;
- Признаки нарушения сознания (возбуждение или угнетение), неспособность пациента к сотрудничеству;
- Травмы или ожоги лица, анатомические дефекты, препятствующие установке маски;
- Неспособность пациента убрать маску с лица в случае рвоты;
- Активное кровотечение из желудочно-кишечного тракта;
- Обструкция верхних дыхательных путей;
- Дискомфорт от маски.
Заключение
Пандемия COVID-19 требует расширенного и всестороннего анализа рисков и пользы от выполнения респираторной поддержки пациентам с этим заболеванием. Ее проведение в необходимый клинический момент современными методами оксигенотерапии и СРАР потребует тщательного контроля за рисками заражения медицинских работников, внутрибольничным распространением инфекции, а также оценки ресурсов здравоохранения и сопутствующих заболеваний у коморбидных пациентов с COVID-19 [3–5].


