Введение
Острые кишечные инфекции (ОКИ) остаются одной из актуальных проблем здравоохранения [1], нанося серьезный экономический ущерб как в нашей стране, так и во всем мире [2, 3]. Уровень заболеваемости ОКИ у детей значительно выше, чем у взрослых, причем наибольшее количество регистрируемых случаев приходится на детей в возрасте до 7 лет [4]. Тенденцией последнего времени все отчетливее становится рост числа постинфекционных гастроэнтерологических заболеваний у реконвалесцентов тяжелых и среднетяжелых форм кишечных инфекций [5]. Функциональные нарушения органов пищеварения (ФНОП) занимают лидирующее положение в структуре заболеваний органов пищеварения у детей различных возрастов. По некоторым данным, распространенность ФНОП в развитых странах среди детей в возрасте от 4 до 18 лет составляет от 14 до 24% [6]. Результаты эпидемиологических исследований в нашей стране свидетельствуют: жалобы, характерные для данной группы заболеваний, предъявляют 6% учащихся средних и 14% старших классов и более 50% детей с рецидивирующим абдоминальным болевым синдромом (АБС) [7].
В Международной классификации болезней ФНОП присвоены номера K58 (Синдром раздраженного кишечника: K58.0. Синдром раздраженного кишечника с диареей, K58.9. Синдром раздраженного кишечника без диареи) и K59 (Другие функциональные кишечные нарушения: K59.0. Запор, K59.1. Функциональная диарея, K59.2. Неврогенная возбудимость кишечника, не классифицированная в других рубриках, и K59.9. Функциональное нарушение кишечника неуточненное).
Общепринятым стандартом диагностики и классификации ФНОП признаны Римские критерии, предложенные Комитетом по изучению функциональных расстройств у детей и Международной рабочей группой.
В соответствии с Римскими критериями IV пересмотра (2016) ФНОП у детей разделяют на две группы в зависимости от возраста ребенка (табл. 1).
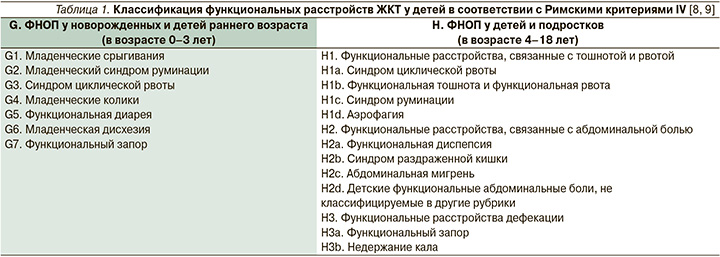
Вместе с накоплением информации посредством катамнестического наблюдения детей после ОКИ значительно расширились представления о возможных механизмах, лежащих в основе генеза ФНОП у этой группы пациентов. В частности, установлено, что у значительной доли взрослых больных с постинфекционными ФНОП имеются стойкие дисбиотические явления, приводящие к гиперреактивности кишечной стенки, а также к нарушениям переваривания и пассажа пищи [10]. У данной группы пациентов выявлены характерные изменения цитокинового профиля, поддерживающие воспалительные изменения слизистой оболочки кишечника и приводящие к повышению висцеральной чувствительности [11].
К факторам риска возникновения данных изменений у реконвалесцентов ОКИ разные авторы относят женский пол, затяжную диарею после перенесенной кишечной инфекции, стрессы, применение антибактериальных препаратов [12]. В целом, по данным проведенного в 2014 г. мета-анализа, относительный риск развития ФНОП в течение года у взрослых пациентов – реконвалесцентов ОКИ вирусной этиологии, в 4,85 раза выше, чем у лиц, не переносивших данных заболеваний [13, 14].
На сегодняшний день лишь в единичных работах освещается проблема профилактики формирования ФНОП у детей, перенесших ОКИ. Отсутствуют наблюдения, в которых проводится сопоставление эпидемиологических, клинико-лабораторных параметров больных ОКИ (включивших исследования иммунологических показателей и оценку состава микробиоты кишечника) с данными длительного катамнестического наблюдения реконвалесцентов. Подобные исследования могут способствовать уточнению механизмов развития ФНОП, в частности роли изменения состава микробиоты тонкой и толстой кишки, а также особенностей взаимодействия рота- и норовирусов с иммунной системой человека, послужить основой для выявления факторов риска и создания моделей прогнозирования гастроэнтерологической патологии у детей после ОКИ.
Цель исследования: изучение симптоматики и частоты формирования постинфекционных функциональных гастроинтестинальных расстройств у реконвалесцентов вирусных гастроэнтеритов детского возраста, а также эффективности их лечения на основе использования пробиотиков.
Методы
В исследование были включены 147 детей, проходивших лечение в отделении кишечных инфекций ДНКЦИБ ФМБА России в связи с тяжелыми формами ОКИ (индекс Кларка не менее 14 баллов), из них 63 (42,8%) мальчика и 84 (57,2%) девочки.
Детей в возрасте от 1 до 3 лет было 98 (66,7%), от 4 до 7 лет – 49 (33,3%). Этиологическую диагностику ОКИ осуществляли по данным результатов исследования фекалий методом полимеразной цепной реакции. В исследование включили детей с острым гастроэнтеритом рота- (РВИ; n=60; 40,8%), норовирусной (НВИ; n=57; 38,8%) и рота-норовирусной (РНВИ; n=30; 20,4%) этиологии. Критерии невключения пациентов в исследование: заболевания органов пищеварения в анамнезе, невыполнение протокола исследования.
Наблюдение реконвалесцентов ОКИ осуществляли 1 раз в 3 месяца амбулаторно в течение 12 месяцев (I период), далее в течение 24 месяцев (II период) методом телефонного анкетирования. Фиксировали появление симптомов ФНОП и оценивали их особенности в соответствии с Римскими критериями IV пересмотра.
Медикаментозное лечение ФНОП осуществлены в пяти группах реконвалесцентов ОКИ, образованных в соответствии с получаемыми препаратами в течение месяца: группа 1 – Тримедат (n=11), группа 2 – Аципол (n=11), группа 3 – Бифиформ (n=10), группа 4 – Энтерол (n=10), группа 5 – Тримедат и Аципол (n=7).
Результаты
Среди жалоб, предъявленных реконвалесцентами ОКИ, АБС оказался ведущим. Особенности проявлений АБС у детей после ОКИ различной этиологии приведены в табл. 2.
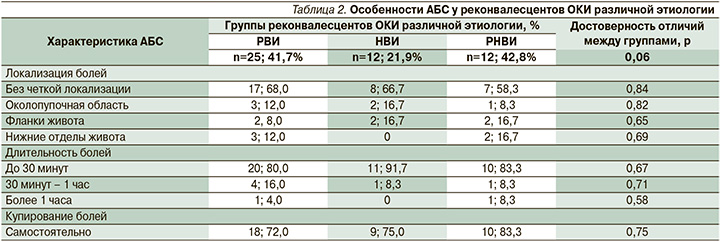
Максимальную частоту выявления дискомфорта и болей в животе отмечали в середине срока катамнестического наблюдения: через 6 месяцев подобные симптомы были положительными у 33 (22,4%) детей. Частота регистрации АБС снижалась в динамике наблюдения и к 12-му месяцу составила 17,2%.
Стоит отметить, что выраженность АБС менялась в течение наблюдения. К первой контрольной точке исследования (через 3 месяца после ОКИ) данный синдром характеризовался умеренной интенсивностью, нестойкими болезненными ощущениями без четкой локализации, не оказывал значительного влияния на поведение ребенка и его социальную активность. К 6-му месяцу наблюдения отмечено повышение интенсивности и длительности болевых ощущений, у части детей (n=6; 4,4%) боли снижали активность ребенка. В ряде случаев (n=12; 8,7%) имела место необходимость проведения комплексной медикаментозной терапии. Период, в который произошло нарастание интенсивности АБС и частоты предъявления жалоб на абдоминальные боли в данном исследовании, соответствовал срокам формирования «биопсихосоциальной матрицы» ФНОП. В соответствии с рекомендациями Римских критериев IV для формирования стойких очагов болевых ощущений в кишечнике при ФНОП требуется не менее 3–6 месяцев с момента триггерного события [15].
В большинстве случаев уменьшение дискомфорта в животе у детей отмечалось после акта дефекации. Выявить наличие связи болей с характером пищи и особенностями стула, а также оценить эффект использованных фармакологических препаратов для купирования болей не удалось.
У 61 (41,5%) ребенка за весь период катамнестического наблюдения каких-либо симптомов ФНОП выявлено не было. По результатам катамнестического наблюдения ФНОП диагностированы у 30 (20,4%) детей. Распространенность различных форм ФНОП убывала в ряду: функциональные запоры (10,9%), синдром раздраженного кишечника (3,4%), функциональная абдоминальная боль (2%), функциональная диарея (1,4%).
У остальных детей длительность симптомов на фоне проводимой терапии оказалась недостаточной для установления диагноза ФНОП на основании Римских критериев IV пересмотра.
У 22 (15,0%) пациентов жалобы на изменения состояния здоровья сохранялись с момента завершения лечения по поводу ОКИ (18–21 сутки с начала болезни; «0» точка катамнестического наблюдения): у 9 (6,1%) детей – с РВИ, у 7 (4,8%) – с НВИ и у 6 (4,1%) – с РНВИ.
Статистически значимых различий в частоте регистрации жалоб у реконвалесцентов ОКИ различной этиологии выявлено не было. Стоит отметить, что после РВИ у значительной части пациентов отмечали сохранение раннего насыщения (n=8; 13,3%), увеличения частоты стула (n=7; 11,7%), дискомфорта и болей в животе во время приема пищи (n=6; 10%), метеоризма (n=7; 11,7%). После НВИ у детей отмечали жалобы на боли в животе во время приема пищи (n=3; 5,5%), метеоризм (n=3; 5,5%), учащенный стул (n=2; 3,6%), снижение аппетита (n=2; 3,6%), запоры (n=1; 1,8%). После РНВИ у детей доминировали метеоризм (n=4; 10,7%), вздутие живота (n=3; 10,7%), снижение аппетита (n=3; 10,7%), умеренный дискомфорт в животе (n=3; 10,7%).
В единичных наблюдениях имели место запоры (n=1; 3,6%), диарея (n=1; 3,6%), несколько чаще (p>0,05) – сочетание жалоб, а именно у детей после РНВИ (n=4; 14,3%), а также после РВИ (n=3; 5%) и НВИ (n=2; 3,6%).
Более частое появление диспептических симптомов отмечали в период с 3-го по 6-й месяц наблюдения. У большинства пациентов в тот период регистрировались запоры (n=33; 22,4%).
На 3-м месяце наблюдения эпизоды длительной задержки стула, уменьшения частоты дефекации до 2 раз в неделю, изменения консистенции стула (плотный, комочками, тип 1–2 по Бристольской шкале оценки) выявлены у 22 (15,0%) детей: у 13 (22,0%) – после РВИ, у 6 (11,9%) – после НВИ и у 3 (10,7%) – после РНВИ (p=0,05). Значительно реже (n=15; 10,2%) отмечалось периодическое учащение дефекации (не менее 3 раз в сутки). Частота выявления диарейного синдрома была максимальной в первые 3 месяца наблюдения (n=13; 8,8%) и имела отчетливую тенденцию к снижению в динамике наблюдения за пациентами. Так, на 9-м месяце наблюдения данный симптом отмечали у 3 (2,0 %) пациентов. Стоит также отметить, что длительность диарейного синдрома только у 2 (1,4%) детей превысила 14 дней (средняя продолжительность – 8±4,8 дня), в клинической картине не было обнаружено признаков интоксикации, появлению симптомов не предшествовали погрешности в питании.
В старшей возрастной группе по итогам 12 месяцев наблюдения ФНОП встречались несколько чаще (26,5%), чем в младшей (17,3%; p=0,32).
В старшей группе диагностированы синдром раздраженного кишечника (n=5; 38,5%), функциональная диспепсия (n=4; 30,8%), функциональная абдоминальная боль (n=4; 30,8%) и функциональные запоры (n=1; 7,7%). В младшей возрастной группе диагностированы функциональные запоры (n=15; 88,2%) и функциональная диарея (n=2; 11,8%).
Кроме того, дети старшей возрастной группы значимо чаще (n=16; 32,7%), чем дети младшей (n=17; 17,3%; p=0,04) жаловались на быстрое насыщение и/или отказывались от приема пищи, что не отражалось в виде диагноза, но, очевидно, проявлялись редуцированной формой функциональной диспепсии. Во II период наблюдения частота проявлений ФНОП снизилась: они отмечались у 17 (11,6%) детей, при этом в младшей возрастной группе чаще (n=13; 13,2%), чем в старшей (n=4; 8,2%; p=0,04). Наиболее часто это были боли в животе (n=10; 6,8%), тошнота (n=7; 4,8%), быстрая насыщаемость (n=5; 3,4%), соответствовавшие редуцированной форме функциональной диспепсии.
У значительной доли реконвалесцентов ОКИ старшей возрастной группы (n=17; 34,7%) отмечалось сочетание АБС с метеоризмом и задержкой стула. Выявить статистически значимые отличия в частоте появления абдоминальных болей после ОКИ различной этиологии не удалось (p=0,06). Следует, однако, отметить меньшую продолжительность сохранения АБС в период динамического наблюдения детей после НВИ, чем после РВИ и РНВИ: только у 5 (9,4%) детей после НВИ отмечались абдоминальные боли в двух эпизодах катамнестического наблюдения по сравнению с 9 (16,7%) – после РВИ и 4 (15,4%) – после РНВИ.
Изменение пищевого поведения в виде частого отказа от пищи впервые выявлено у 20 (13,6%) детей: у 11 (19,0%) – после РВИ, у 4 (7,3%) – после НВИ и у 5 (17,9%) – после РНВИ (p=0,15). У части реконвалесцентов отмечалось появление тошноты (n=40; 27,2%), единичных эпизоды рвоты (n=8; 5,4%).
Полного купирования АБС после курса лечения удалось достичь у 26 (53,0%) детей. В зависимости от выбранной лечебной схемы (табл. 3) отмечались статистически значимые (p=0,034) отличия в частоте купировании симптомов ФНОП: в группе 2 – у 8 (63,7%) из 11, по сравнению с группой 1 – у 3 (36,4%) из 11. Чувство дискомфорта в животе после лечения отмечали 14 (28,6%) детей: в группе 1 – 5 (35,7%) человек из 11, в группе 2 – 3 (30%) из 11, в группе 3 – 6 (53,3%) из 10, в группе 4 – 4 (20%) из 10, в группе 5 – 1 (14,2%) из 7. У 7 (14,3%) из 49 детей боли сохранялись.
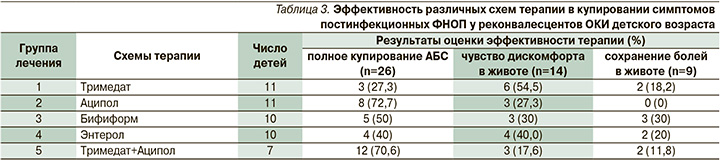
Среди всех лечившихся 49 пациентов с ФНОП после курса терапии (длительностью 1 месяц) явления метеоризма купировались полностью у 26 (53%) детей, сохранялись у 23 (47%). У 3 (6,1%) детей явления метеоризма, несмотря на лечение, оставались выраженными, у 6 (12,2%) – умеренно выраженными и у 14 (28,6,7%) – слабовыраженными. Вздутие живота возникало в вечернее время у 32 (65,3%) детей, в течение дня – у 15 (30,6%). Положительная динамика проявлялась исчезновением ряда жалоб, обусловленного более регулярной дефекацией: вздутие живота исчезло у 24 (49,0%) детей, уменьшилось – у 9 (18,4%). Наибольшую эффективность в устранении АБС имела комбинированная терапия, включившая Тримедат и Аципол. Императивные позывы на дефекацию полностью купировались после курса лечения Энтеролом, Ациполом и комбинацией Тримедата и Аципола; положительная динамика отмечена после приема Бифиформа (в 75,6 %).
Обсуждение
После 6 месяцев наблюдения частота появления диспептических симптомов у детей, не предъявлявших жалоб с момента выздоровления от ОКИ, снижалась. Это согласуется с результатами, полученными итальянскими авторами [16], а также соответствует современным представлениям о механизмах формирования ФНОП. Заметим, что интенсивность клинических проявлений ФНОП у детей может значительно варьироваться. В литературе описаны случаи длительного субклинического течения ФНОП с более поздней, чем 6 месяцев, регистрацией манифестных проявлений [16]. Так, в исследованной нами группе в период с 6-го по 12-й месяц наблюдения выявление симптомов ФНОП у детей, не имевших первоначально жалоб на состояние здоровья, отмечено у 12 (8,2%).
Еще одной особенностью, характерной для исследуемого контингента, была большая вариабельность жалоб пациентов в динамике наблюдения. При повторных осмотрах дети отмечали появление новых симптомов на фоне полного или частичного регресса предшествовавших, что затрудняло выделение ведущего симптома и диагностику ФНОП. Подобного рода особенности отмечены в работах и других исследовательских групп [17]. Данный феномен большинство исследователей связывают с морфофункциональными особенностями органов пищеварения, а также системы ноцицепции и висцероцепции в детском возрасте [18].
Заключение
Таким образом, у детей, перенесших вирусные ОКИ, в значительной доле случаев отмечалось появление симптомов ФНОП, среди которых преобладали абдоминальные боли и нарушение дефекации по типу запоров. несколько реже – симптомы «малой диареи» и быстрое насыщение. Максимальная частота появления симптомов наблюдалась в первые 6 месяцев катамнестического наблюдения. Все это свидетельствует о необходимости выделения групп повышенного риска формирования ФНОП среди детей, перенесших ОКИ с последующим длительным наблюдением за реконвалесцентами, обязательным активным выявлением жалоб и объективной оценкой состояния здоровья ребенка с целью своевременной адекватной терапевтической коррекции для улучшения качества жизни. Наибольшего лечебного эффекта ФНОП удалось достичь в результате курса комбинированной терапии с использованием препаратов Тримедат и Аципол.


