Актуальность
Хронические неспецифические заболевания легких (ХНЗЛ) у детей остается важной медико-социальной проблемой, что связано с высокой инвалидизацией, нарушением качества жизни больных и значительными экономическими затратами, вызванными лечением данной когорты пациентов. ХНЗЛ могут оказаться как изолированным поражением легких вследствие генетической предрасположенности, так и отражением генетических мутаций, вызывающих полиорганную симптоматику с вовлечением респираторных отделов бронхолегочной системы и развитием респираторного синдрома как одного из ведущих в клинической картине [1]. Наследственные заболевания легких в своей основе ассоциированы с теми или иными генетическими мутациями в определенных хромосомных локусах, а их течение и исходы во многом зависят от генетических предикторов, кодирующих систему клеточных протеиназ, цитокинов, сурфактанта, рецепторов витамина D (VDR) и др. [2–4].
Витамин D представляет собой группу биологически активных жирорастворимых соединений, включающую более 50 метаболитов, основной функцией которых служит стимуляция абсорбции кальция и фосфора клетками эпителия тонкого кишечника. Также установлена важная роль витамина D в обеспечении функции иммунной системы. Доказано, что активные форма витамина D оказывают прямое воздействие на недифференцированные и инактивированные Т-хелперы, Т-регуляторы, активированные Т-клетки и дендритные клетки. Дефицит витамина D является одним из факторов развития иммуноопосредованных заболеваний – иммунодефицитных состояний, аллергической и аутоиммунной патологии [3].
В ряде исследований установлено, что уровень витамина D в крови находится под генетическим контролем. Геномные эффекты реализуются через соответствующие ядерные VDR. Продемонстрировано влияние генетических полиморфизмов VDR (BsmI, FokI, TaqI, ApaI) на риск развития и течение хронических аллергических заболеваний легких и хронической обструктивной болезни легких. Результаты исследований свидетельствуют о необходимости проведения дальнейших изысканий в этой области для уточнения патогенетических механизмов и персонифицированного подхода к терапии витамином D [3, 5].
Цель исследования: изучить фенотипическое влияние полиморфизма FokI гена VDR на течение ХНЗЛ у детей.
Методы
Основную когорту составили 98 детей с ХНЗЛ, разделенных на 2 основные группы.
Первую основную группу составили дети в возрасте от 2 до 17 лет 11 месяцев 29 дней (7,67±0,54 заболевания) с ХНЗЛ, сформированными на первоначально здоровой легочной ткани (n=42). В данную группу вошли пациенты с диагнозами «хронический бронхит» (n=30; средний возраст – 8,0±0,67 года) и «облитерирующий бронхит» (n=12; средний возраст – 6,83±0,84 года). Вторая основная группа представлена детьми в возрасте от 1 месяца до 17 лет 11 месяцев 29 дней (8,77±0,75 года) с вторичными ХНЗЛ, а именно муковисцидозом (n=34; 9,0±1,09 года), иммунодефицитами (n=12; 10,67±1,05 года) и пороками развития легких (n=10; 6,60±1,27 года). Контрольная группа для генетического исследования была представлена 93 условно здоровыми детьми, прошедшими плановое обследование, согласно декретированным срокам, в амбулаторно-поликлинических условиях.
Родители или законные представители всех больных и лиц контрольной группы были информированы об условиях исследования, и от них получено добровольное согласие на участие в проводимой работе.
Молекулярно-генетическое исследование FokI гена VDR проводилось методом полимеразной цепной реакции и полиморфизма длин рестрикционных фрагментов. У пациентов с различными аллелями и генотипами анализировались следующие параметры: пол, кратность и тяжесть обострений, характер микробиоты, вариативные изменения показателей функции внешнего дыхания (ФВД), частота и характер коморбидных состояний.
Статистический анализ полученных данных проведен с применением программного обеспечения Data Studio, пакета прикладных программ STATISTICA 6.0. Для анализа сведений о частоте исходов в зависимости от наличия фактора риска в данной работе использован непараметрический метод статистики – критерий χ2 Пирсона. С его помощью оценивалась значимость различий между фактическим количеством исходов, выявленным в результате исследования, и теоретическим количеством, которое можно было ожидать в изучаемых группах при справедливости нулевой гипотезы. Для уменьшения вероятности ошибки первого типа, т.е. обнаружения различий там, где их нет, в случае если при анализе четырехпольных таблиц хотя бы в одной ячейке число ожидаемого явления у нас было меньше 10, рассчитывался критерий хи-квадрата с поправкой Йейтса. Для оценки ассоциации генотипов и аллелей изучаемых генов с патологическим фенотипом вычислялся показатель отношение шансов – статистический показатель (OR), один из основных способов описания в численном выражении того, насколько отсутствие или наличие определенного исхода связано с присутствием или отсутствием определенного фактора в конкретной статистической группе. Отношение шансов позволило оценить связь между определенным исходом и фактором риска. Для оценки значимости отношения шансов рассчитывались границы 95% доверительного интервала.
Результаты
Анализ встречаемости генотипов полиморфизма FokI гена VDR показал, что с наибольшей частотой как в двух основных, так и в контрольной группах определялся гетерозиготный генотип F/f: 22 (52,4%), 30 (57,7%) и 42 (45,2%) пациента соответственно. Гомозиготный генотип F/F определялся у 20 (47,6%), 24 (42,8%) и 37 (39,8%) пациентов в указанных группах соответственно. Редким стал гомозиготный генотип по мутантному аллелю f/f, который в контрольной группе встречался достоверно чаще, чем в основной когорте (χ2=4,808; p=0,029; df=2). Необходимо отметить, что у пациентов с хроническими заболеваниями, сформированными на первоначально интактных легких, генотип f/f не был идентифицирован ни у одного ребенка.
Среди больных второй группы сочетание двух мутантных аллелей полиморфизма FokI гена VDR выявлено лишь у 2 (3,6%) пациентов. Таким образом, согласно данным статистического анализа, выявлены достоверные различия по частоте встречаемости различных полиморфных вариантов FokI гена VDR между основными и контрольной подгруппами. Анализ частоты встречаемости дикого аллеля F и мутантного аллеля f в группах достоверных различий не выявил (табл. 1).
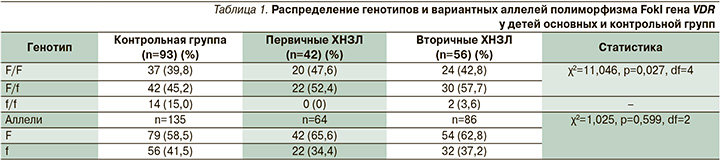
Учитывая низкую частоту встречаемости генотипа f/f в основной когорте (вторичные ХНЗЛ – 3,6%), для проведения статистического анализа фенотипических проявлений как в группах, так и по нозологическим формам проведено объединение генотипов F/f и f/f.
При проведении статистического анализа не выявлено достоверных гендерных различий между пациентами первой и второй групп, как и при анализе по отдельным нозологическим формам (χ2=0,002; p=0,965; df=1 и χ2=0,059; p=0,808; df=1 соответственно).
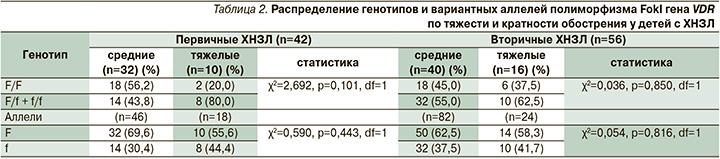
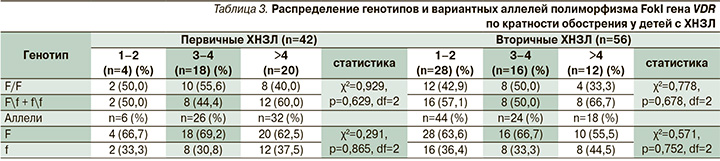
Тяжесть и кратность обострений служат одной из главных фенотипических характеристик хронических заболеваний легких, на основании которых проводится оценка тяжести течения заболевания и его дальнейшего прогноза. Согласно данным, представленным в табл. 2, среди пациентов первой группы тяжелое обострение наблюдалось в 80,0% случаев у больных с сочетанным генотипом F/f+f/f и в 20,0% – с генотипом F/F. У детей с менделирующими заболеваниями и пороками развития легких распределение по генотипам составило 37,5 и 62,5% соответственно (табл. 2). Несмотря на отсутствие статистической достоверности, отмечена тенденция преобладания тяжелых обострений и их высокой кратности у детей с полиморфными вариантами, содержащими в своем составе мутантный аллель f (табл. 3).
Дыхательная недостаточность во время обострения служит основным фактором, обусловливающим тяжесть состояния пациента. Она ассоциирована с расстройством газообмена вследствие выраженного воспаления и нарушения морфологических структур легкого. Согласно полученным данным, наблюдается незначительное превалирование развития тяжелых форм острой дыхательной недостаточности при мутантных генотипах: 63,7% при первичных ХНЗЛ и 75,0% – при вторичных. Достоверных различий по тяжести дыхательной недостаточности между аллелями F и f в подгруппах также не выявлено.
Прогрессирование заболеваний легких в значительной мере обусловлено хронической респираторной инфекцией и воспалением.
Статистический анализ данных показал, что достоверных различий между пациентами с различными генотипами и аллелями по полиморфизму FokI гена VDR с точки зрения микробиологического пейзажа дыхательных путей и частоты встречаемости хронического высева грамотрицательной микрофлоры ни в первой, ни во второй группе не выявлено (χ2=0,648, p=0,724, df=2 и χ2= 0,145; p=0,931; df=2 соответственно).
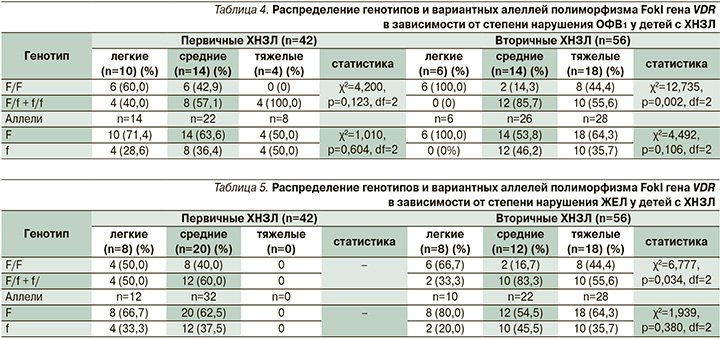
Всем пациентам старше 5 лет была проведена спирография. У всех обследованных больных наблюдался смешанный характер изменений ФВД. Результаты статистического анализа свидетельствуют о достоверном превалировании генотипа F/F у детей с легкими обструктивными и рестриктивными изменениями (не более 80% от нормы) и доминирование генотипов, содержащих мутантный аллель f, у пациентов с умеренными показателями снижения жизненной емкости легких (ЖЕЛ) и объема форсированного выдоха за 1 секунду (ОФВ1) во второй подгруппе (табл. 4, 5). Достоверных ассоциаций между частотой встречаемости дикого и мутантного аллелей полиморфизма FokI гена VDR у детей с различной степенью изменения скоростных показателей по данным спирограммы не выявлено.
Обсуждение
У детей хронические заболевания бронхолегочной системы ассоциируются с иными типами патологических состояний, что может быть обусловлено едиными патогенетическими механизмами (в частности, формированием патологии назофарингиальной зоны при муковисцидозе и первичной цилиарной дискинезии), длительным гипоксическим состоянием и медикаментозной терапией, а также за счет воздействия средовых факторов. В то же время обсуждается роль генетических предикторов в развитии коморбидных состояний. В связи с этим мы проанализировали влияние полиморфизма FokI гена VDR на частоту развития и характер сопутствующих заболеваний у детей с ХНЗЛ. Выявлено достоверное увеличение частоты встречаемости поражения назофарингеальной зоны у детей второй группы. Возможно, полиморфизмы F/f + f/f оказывают синергическое действие на основной генетический дефект, обусловливающий основное заболеваний (χ2=6,838, p=0,009, df=1). Иных статистически значимых сопряжений генотипов с частотой сопутствующих поражений печени, поджелудочной железы, заболеваний щитовидной железы и сахарным диабетом, частотой поражений ЦНС у пациентов с первичными и вторичными ХНЗЛ не выявлено.
Заключение
Таким образом, на основании полученных результатов можно утверждать, что полиморфизм FokI гена VDR не оказывает выраженного фенотипического воздействия на течение ХНЗЛ у детей. Исходя из вышеизложенного, на данном этапе полиморфизм FokI гена VDR не может быть рекомендован для прогнозирования течения хронических бронхолегочных заболеваний и персонифицированного подбора витамина D. Возможно, реализация фенотипического влияния полиморфизма FokI гена VDR происходит в более старшем возрасте, что диктует актуальность продолжения данного исследования у взрослой когорты больных.
Вклад авторов
Концепция и дизайн исследования – Д.Ф. Сергиенко.
Сбор и обработка материала – И.А. Аверина.
Статистическая обработка данных – И.А. Аверина.
Написание текста – Д.Ф. Сергиенко.
Редактирование – Д.Ф. Сергиенко.


