Введение
Врожденный гиперинсулинизм (ВГИ) – наследственное заболевание, обусловленное неадекватной продукцией инсулина β-клетками поджелудочной железы, приводящее к гипогликемии. В настоящее время описаны мутации в 14 генах, отвечающих за развитие ВГИ [1]. В 40% случаев причиной ВГИ служат мутации в генах ABCC8 и KCNJ11 [2]. Помимо этого симптом гиперинсулинемической гипогликемии входит в состав наследственных синдромов, таких как Беквита-Видемана, Кабуки, Сотоса, Ашера, врожденные дефекты гликозилирования [3]. Частота встречаемости ВГИ – 1 на 30000–50000 живых новорожденных [5].
Поздняя диагностика и неадекватная терапия гипогликемии у детей могут приводить к тяжелым неврологическим осложнениям [3, 4, 8].
Манифестация симптомов ВГИ и степень их выраженности зависят от генетической мутации. В подавляющем большинстве случаев ВГИ дебютирует в первые дни жизни и характеризуется тяжелой персистирующей гипогликемией, требующей непрерывной инфузии высококонцентрированных растворов глюкозы [3].
Гистологически различают фокальную, диффузную и атипичную формы ВГИ. При диффузной форме поражаются все β-клетки поджелудочной железы. При фармакорезистентном течении пациентам с диффузной формой ВГИ проводится субтотальная панкреатэктомия, осложнением которой является сахарный диабет.
В случае фокальной формы возможно хирургическое лечение с иссечением пораженных участков поджелудочной железы, что приводит к полному выздоровлению.
Терапией первой линии ВГИ является диазоксид. Препарат активирует АТФ-зависимые калиевые каналы [9], тем самым снижая секрецию инсулина. Однако в ряде случаев лечение даже максимальными дозами диазоксида не дает положительных результатов. Чаще это встречается у пациентов с мутациями в генах ABCC8 и KCNJ11. При диазоксид-резистентном течении ВГИ могут применяться аналоги соматостатина (АС) [6, 12, 13].
Аналоги соматостатина
Октреотид – синтетический АС, подавляет секрецию гормона роста, инсулина, глюкагона, гастрина, серотонина, тиреотропина. Октреотид используется в лечении акромегалии, варикозно расширенных вен пищевода с кровотечением, язв желудка и двенадцатиперстной кишки, фиброза печени, панкреатита. Благодаря своему патогенетическому действию препарат нашел применение в лечении ВГИ. Связываясь с рецепторами соматостатина-2 и -5 (SST2 и SST5), октреотид снижает поступление кальция в β-клетку, вызывает ее гиперполяризацию с последующим снижением выработки инсулина. Препарат вводят подкожно в стартовой дозе 3 мкг/кг/сут 3–4 раза в сутки или инфузионно с использованием инсулиновой помпы. Далее проводят титрование дозы с повышением концентрации не более чем на 5 мкг/кг в день (максимальная доза – 35 мкг/кг/сут) [5].
Несмотря на то что детский возраст служит противопоказанием к применению октреотида, его неоспоримая роль в терапии подчеркивается во многих клинических исследованиях.
С помощью октреотида удается снизить риск тяжелых гипогликемий, предотвратить развитие тяжелых неврологических осложнений. Позже появилось множество работ по успешному применению октреотида у детей с ВГИ [7, 10, 11].
Октреотид является короткодействующим АС, период его полужизни составляет порядка 100 минут. С учетом незначительной продолжительности действия рекомендовано использование препарата в виде дробных инъекций (каждые 4–6 часов) или непрерывной инфузии. Постоянное введение октреотида подкожно или с помощью инсулиновой помпы снижает качество жизни пациента и его семьи. В этой ситуации альтернативным лечением становится применение АС пролонгированного действия, таких как сандостатин ЛАР и ланреотид [6].
Сандостатин ЛАР – синтетический АС длительного действия. Препарат применяется в лечении акромегалии, опухолей желудочно-кишечного тракта (ЖКТ) и нейроэндокринной системы. Благодаря депо-форме концентрация препарата остается стабильной на протяжении 3–4 недель. Препарат вводится внутримышечно 1 раз в 4 недели. Он способен снижать выработку инсулина в течение продолжительного времени, что служит патогенетической основой его применения в лечении ВГИ.
Вторым АС длительного действия является ланреотид. Обладая аналогичными с Сандостатином ЛАР свойствами, он также зарекомендовал себя в терапии ВГИ. Положительное влияние ланреотида на уровень гликемии описано в зарубежной литературе.
Опыт применения пролонгированных форм АС при ВГИ
Kühnen Р. et al. описали применение ланреотида 6 пациентами с диффузной формой и диазоксид-резистентным течением ВГИ в возрасте от 7 месяцев до 4 лет [12]. В качестве стартовой терапии был применен октреотид, однако в связи с частыми гипогликемиями пациенты были переведены на терапию ланреотидом. Во время исследования отмечено снижение частоты гипогликемий у всех детей. На фоне терапии у трех пациентов произошло увеличение среднего уровня гликемии, что еще раз доказывает несомненную эффективность ланреотида в лечении ВГИ (см. таблицу).
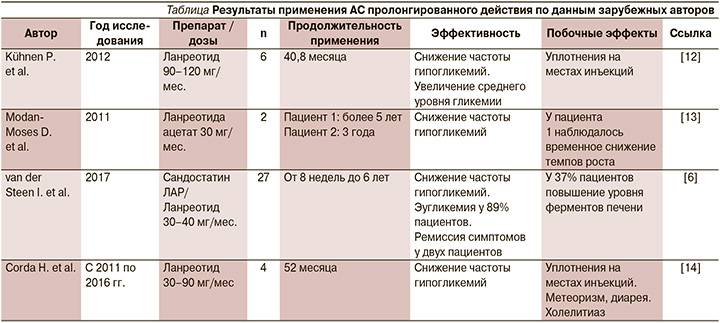
В ранее опубликованной статье Modan-Moses D. et al. приводятся данные об успешном применении ланреотида ацетата 2 пациентами [13]. Симптомы гипогликемии у детей были выявлены через 30 минут после рождения. У первого ребенка диагностирована мутация в гене ABCC8, у второго – не было обнаружено мутаций ни в одном из известных генов. Диазоксид и гидрохлоротиазид являлись стартовой терапией, затем лечение сменилось на помповое введение октреотида. Однако по мере взросления и увеличения двигательной активности детей данная терапия стала затруднительной. В возрасте около 4,5 лет пациенты были переведены на инъекции ланреотида. Значимый эффект от лечения наилучшим образом отразился не только на показателях гликемии, но и на качестве жизни пациентов и их семей (см. таблицу). По мнению авторов, ланреотид является безопасной и эффективной альтернативой помповой терапии октреотидом. Вопрос, в каком возрасте лучше переходить на инъекции ланреотида, решается сугубо индивидуально.
В литературе имеются данные о многоцентровом опыте применения АС пролонгированного действия 27 пациентами из 6 стран Европы [6]. Семь пациентов получали терапию сандостатином ЛАР, остальные использовали ланреотид. Выбор определялся доступностью препарата в стране. По данным авторов исследования, на фоне лечения 89% пациентов удалось достичь эугликемии. У двух пациентов отмечена ремиссия симптомов, в связи с чем терапия была отменена. Стоит отметить, что серьезных побочных эффектов на фоне лечения не наблюдалось, однако у 37% пациентов отмечено повышение уровня печеночных ферментов (см. таблицу). По мнению авторов, АС длительного действия служат эффективным средством лечения ВГИ. Однако не стоит забывать о риске развития побочных эффектов, в связи с чем необходимо проводить мониторинг ферментов печени, ультразвуковое исследование брюшной полости, исследования функции щитовидной железы.
Известны случаи применения ланреотида как альтернативы хирургическому лечению ВГИ [14]. Corda H. et al. представили данные о терапии ланреотидом четырех детей в возрасте 2–3 месяцев. Отмечен положительный эффект в виде снижения частоты гипогликемий и повышения среднего уровня гликемии. Эугликемии удалось достичь одному пациенту после однократного введения ланреотида в дозе 30 мг. Серьезных побочных эффектов от терапии у пациентов не наблюдалось (см. таблицу).
Ланреотид также может применяться в случае плохой переносимости диазоксида. Shah P. et al. описывали случай девочки-подростка, принимавшей в качестве лечения ВГИ диазоксид [16]. Наряду с оптимальными показателями гликемии данное лечение привело к осложнению в виде гипертрихоза, оказавшего серьезное негативное влияние на психическое состояние подростка. В связи с этим пациентка была переведена на терапию ланреотидом. Наряду со стабильными показателями гликемии отмечен и регресс гипертрихоза.
Осложнения терапии АС
Несмотря на в целом положительное влияние АС на симптомы ВГИ, данная терапия обладает рядом побочных эффектов. В первую очередь АС ослабляют моторику ЖКТ. Вследствие этого наблюдаются диспепсические расстройства в виде рвоты, диареи, метеоризма. Нередко отмечаются увеличение уровня печеночных ферментов и желчнокаменная болезнь. Также встречаются тахифилаксия, нарушение темпов роста, абсцессы на месте инъекций [10]. Среди редких, но серьезных осложнений выделяют гепатит, синдром удлиненного интервала QT [1], некротизирующий энтероколит (НЭК) [17, 18].
Патогенез НЭК до конца не изучен. Предположительно причиной его развития служит снижение кровотока в верхней брыжеечной артерии, что негативно сказывается на перфузии стенки кишечника. Имеются данные о летальных исходах НЭК [15, 17].
Описан случай развития реактивного НЭК с летальным исходом у девочки с синдромом Беквита-Видемана, находившейся на терапии октреотидом в дозе 8 мкг/кг/сут. Несмотря на небольшую дозу препарата, осложнение развилось через 2 месяца после начала терапии [17]. В литературе приведено немало данных о ранней манифестации НЭК. Спустя несколько дней от начала терапии АС могут развиваться симптомы НЭК: метеоризм, кровавый стул, диффузный пневматоз кишечника, воздух в портальной системе [18]. Несмотря на риск возникновения такого грозного осложнения, частота развития НЭК не столь высока. На сегодняшний день нет достоверных данных о прямой зависимости применения АС и возникновения НЭК, поскольку недоношенность, аномалии развития и множество других факторов могут также способствовать развитию данного осложнения.
Заключение
На сегодняшний день АС остаются ведущими препаратами в лечении диазоксид-резистентной формы ВГИ.Применение данной терапии снижает риск возникновения тяжелых гипогликемий и как следствие – неврологических осложнений у детей. Несмотря на широкий спектр возможных побочных эффектов, чаще всего терапия АС переносится хорошо. Особое предпочтение научное сообщество отдает пролонгированным формам АС (ланреотид, сандостатин ЛАР), что обусловлено такими их преимуществами, как снижение кратности введения (1 раз в 4 недели), достижение эугликемии, заметное повышение качества жизни пациентов и их семей. Дальнейшее изучение проблемы позволит расширить сферу применения данной терапии, минимизировать риски развития осложнения, в результате – повысить качество жизни пациентов с ВГИ.
Вклад авторов
Сбор и обработка материала – Савкина А.Р., Карева М.А., Меликян М.А.
Написание текста – Савкина А.Р., Меликян М.А.
Редактирование – Меликян М.А., Карева М.А.


