Введение
Функциональные запоры (ФЗ) у детей – весьма актуальная общемировая проблема здравоохранения. Распространенность ФЗ колеблется от 0,7 до 29,6%, а среднее соотношение женщин к мужчинам составляет 2,1:1,0 [1]. Это патологическое состояние характеризуется уреженными дефекациями, уплотненным стулом, нередко имеющим большой диаметр, болезненной дефекацией и недержанием кала; может сопровождаться болями в животе [2]. Такие симптомы часто негативно сказываются на самочувствии ребенка и качестве его жизни [3–7]. По оценкам экспертов, частота запоров у детей в Российской Федерации колеблется в пределах 10–25% [8–9]. При этом у пациентов, страдающих разнообразной патологией желудочно-кишечного тракта, задержка стула имеет место в 70% случаев [10]. Ряд авторов отмечают, что при ФЗ недержание кала встречается у 84% пациентов детского возраста [11–12] и приблизительно 33% имеют поведенческие отклонения [13].
Таким образом, проблема запоров у детей весьма актуальна, требует разработки и внедрения современных методов ранней диагностики, а также эффективного лечения в повседневной педиатрической практике [14]. Этот обзор сфокусирован на применяемых в настоящее время терапевтических подходах к ФЗ у пациентов детского возраста.
Определение
В свете современных представлений о функциональных нарушениях органов пищеварения они определяются как устойчивые комплексы гастроинтестинальных симптомов, развивающихся из-за комбинации нарушений моторики, висцеральной чувствительности и мукозального гомеостаза в определенных социально-средовых условиях и/или при наличии психологических личностных особенностей, семейной предрасположенности [14–15]. До настоящего времени не существует единой точки зрения в отношении определения понятия «запор», наиболее распространенное из них – это редкое, затрудненное, болезненное и неполное опорожнение кишечника каловыми массами различной степени плотности и диаметра, наблюдаемое дольше 2 недель или в течение от 2 недель до 2 месяцев [14]. В Римских критериях-IV (2016) представлены диагностические критерии заболеваний и состояний, связанных с запорами функционального происхождения [16–17].
Патофизиология
Примерно у 95% детей с запорами отсутствует какая-либо органическая причина их возникновения [18]. В этой ситуации речь идет именно о ФЗ, в остальных же случаях запор имеет иную этиологию и связан, например, с нарушением обмена веществ или патологией эндокринной системы, аноректальными аномалиями, нервно-мышечными заболеваниями или болезнью Гиршпрунга [19].
Основные типы ФЗ можно условно разделить на запоры, обусловленные нарушением кишечного транзита, нарушением эвакуации, и на запоры, возникающие в результате сочетанных расстройств [14].
Запоры, обусловленные нарушением кишечного транзита, связаны с несоответствием объема кишечного содержимого и емкости толстой кишки. Наиболее частая причина при таких запорах – это нерациональное питание. Данное состояние характеризуется затруднением продвижения мелкого и твердого кала с дискоординацией, аритмией перистальтических волн кишечника. В результате существует риск развития мегаректум, долихоколон или долихосигмы [14].
Запоры, обусловленные нарушением эвакуации, связаны с невозможностью повышения внутрибрюшного и/или внутриректального давления (вследствие слабости мышечного аппарата передней брюшной стенки, дифарагмы, тазового дна), снижением чувствительности прямой кишки (вследствие систематического подавления рефлекса дефекации, нарушения привычного стереотипа дефекации) и уменьшением способности к релаксации гладких и поперечно-полосатых мышц (при анальных трещинах, сопровождающихся стойким спазмом анального сфинктера) [14]. В итоге на фоне накопления стула в толстой кишке возникает ее постепенная дилатация, приводящая к формированию мегаректум, что влечет за собой потерю ректальных ощущений и позывов на дефекацию.
Следует отметить, что психосоциальные факторы, такие как основные жизненные события (развод родителей, рождение младшего ребенка), могут играть важную роль в патофизиологии ФЗ у детей. Кроме того, поведенческие отклонения (например, расстройства аутистического спектра и синдром дефицита внимания/гиперактивности) связаны с более высоким риском возникновения запоров [20–21]. Наконец, такие факторы, как социально-экономический статус, уровень образования и отношение родителей к воспитанию детей, также были определены как факторы, участвующие в патофизиологии ФЗ у детей [1, 22].
Диагностика
Диагностика ФЗ у детей в основном состоит из подробного изучения анамнеза жизни и заболевания, а также тщательного физического обследования [18]. В большинстве случаев дополнительных исследований не требуется. Специальные методики, позволяющие выявлять органические причины запоров, выходят за рамки данного обзора.
При сборе анамнеза необходимо сфокусироваться на оценке деятельности кишечника. Вопросы должны касаться частоты дефекации, числа эпизодов и длительности недержания кала, консистенции стула, затруднений и болезненных ощущений при опорожнении кишечника [23]. Кроме того, при расспросе необходимо получать информацию о наличии абдоминального болевого синдрома, о характере питания, нарушениях аппетита, о наличии тошноты и/или рвоты и других сопутствующих симптомов.
Физикальное обследование
Помимо оценки массо-ростовых показателей физикальное обследование должно включать обследование брюшной полости, осмотр перианальной и пояснично-крестцовой областей, а также оценку неврологического статуса, что позволяет выявлять т.н. симптомы тревоги и исключать ФЗ [18].
Исследование брюшной полости в основном направлено на пальпаторное выявление каловых масс по ходу кишечника и болезненных ощущений. Во время осмотра области заднего прохода врач может выявлять перианальную фистулу, аномальное положение ануса, наличие каломазания, трещин, рубцов и гиперемию в области ануса.
Пальцевое ректальное исследование дает информацию о наличии избыточного количества каловых масс в прямой кишке, аноректальной чувствительности и тонусе сфинктера заднего прохода [18, 24]. При исследовании пояснично-крестцовой области осмотр должен быть сосредоточен на выявлении косвенных признаков spina bifida (пучка волос над остистым отростком позвонка, впадины в области крестца) или отклонения межъягодичной борозды. Неврологический осмотр может указать на отсутствие анального или кремастерного рефлекса, снижение мышечной силы, тонуса и рефлексов нижних конечностей [24].
Немедикаментозное лечение
Коррекцию ФЗ рекомендуется начинать с нормализации образа жизни путем обучения, коррекции поведения, диетотерапии с повышенным содержанием клетчатки и профилактики гиподинамии.
Обучение
Обучение и демистификация – это первые этапы немедикаментозного лечения ФЗ [25]. Врач предоставляет родителям пациента достоверную информацию о распространенности, причинах, инициирующих и сохраняющих риск запоров, о вариантах лечения и прогнозе. Дети должны активно участвовать в этой беседе, если это допускается их возрастом. Необвинительный подход как врачей, так и родителей имеет ключевое значение [25].
Коррекция поведения ребенка
Необходимо добиваться регулярного опорожнения кишечника ребенка; у детей в возрасте ≥4 лет оно достигается введением адекватного режима посещения туалета. Обучение должно складываться из целесообразности пациенту осуществлять дефекацию в течение 1 часа после еды, что обусловливается гастроилеальным/гастроцекальным рефлексом, лежащим в основе возникновения позыва к дефекации. Кроме того, необходимо проводить в туалете не менее 3–10 минут в расслабленной позе, а именно: обеспечить хороший упор для ног (с помощью подставки), что способствует повышению внутрибрюшного давления и облегчает опорожнение кишечника. Применять систему наказаний в случае неудавшейся дефекации категорически нельзя. Родителям ребенка целесообразно вести дневник ежедневного контроля частоты дефекаций с оценкой формы кала с помощью Бристольской шкалы, который впоследствии может проанализировать педиатр [24].
Диетотерапия, потребление жидкости, физическая активность
Диетотерапия ФЗ основывается на ряде следующих позиций. Во-первых, необходимо удовлетворение физиологических потребностей в пищевых веществах и энергии. Во-вторых, не рекомендуется употребление пищи, богатой жирами и белками, способствующими гипомоторике кишечника. И в-третьих, показано добавление в рацион питания продуктов, обогащенных пищевыми волокнами [24]. Нормальные потребности детей в пищевых волокнах индивидуальны и зависят от возраста; детям старше 2 лет обычно рекомендуется минимальное их потребление из расчета: возраст (годы)+5 г [26–27]. Потребление клетчатки ниже нормальных пределов может приводить к ФЗ [28], что же касается положительного влияния избыточного потребления пищевых волокон, то полноценная доказательная база по этому вопросу отсутствует [29]. Основной источник клетчатки – грубоволокнистая растительная ткань, содержащаяся в отрубях злаковых культур, а также в ряде овощей и фруктов (свекла, морковь, томаты, лиственный салат, кабачки, тыква, цветная капуста, яблоки, сухофрукты). Кроме того, важно соблюдать адекватный питьевой режим в соответствии с физиологическими потребностями ребенка, а именно: 100 мл+50 мл на каждый кг при массе тела свыше 10 кг; 600 мл+20 мл на каждый кг при массе тела свыше 20 кг [30]. При этом было показано, что чрезмерное потребление жидкости у детей с ФЗ не оказывает положительного влияния на симптомы ФЗ [18, 31].
Рекомендуются массаж и регулярные занятия физической культурой. Так, например, масштабное проспективное исследование когорты новорожденных продемонстрировало, что достаточная физическая активность связана со сниженным риском развития ФЗ на дошкольной стадии [32]. Однако рандомизированных клинических исследований по влиянию повышенной физической нагрузки на течение запоров у детей не проводилось [18].
Фармакотерапия ФЗ у детей
В случае неэффективности вышеуказанных мероприятий проводится медикаментозное лечение, которое предусматривает применение слабительных средств, регуляторов моторной функции кишечника и назначение (по показаниям) желчегонных, ферментных препаратов, пеногасителей. Варианты фармакологического лечения будут обсуждаться ниже и суммированы в таблице с указанием рекомендуемых дозировок.
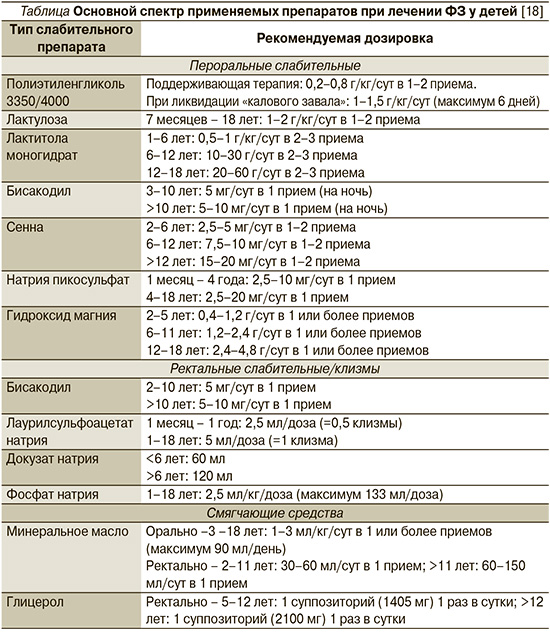
В случае чрезмерного накопления кала в прямой кишке рекомендуется до начала поддерживающей терапии проводить удаление этой фекальной массы для повышения эффективности лечения [33]. Это может быть достигнуто с помощью ректально вводимых клизм или временного применения высоких доз перорального полиэтиленгликоля (ПЭГ): 1–1,5 г/кг/сут в течение 3–6 дней [34–36]. В одном из исследований показано, что по сравнению с клизмами высокая доза ПЭГ может чаще приводить к недержанию кала во время лечения, тем не менее ПЭГ рекомендуется в качестве препарата первого выбора для ликвидации «калового завала», поскольку может вводиться перорально, следовательно, менее инвазивен [18]. После успешного выведения из организма избыточного количества фекальных масс следует начинать поддерживающую терапию, чтобы предотвратить повторное накопление кала [33]. Цель лечения – размягчение стула, способствующее легкой и частой дефекации.
Осмотические слабительные
Применение осмотических слабительных считается основным методом лечения ФЗ. Они плохо поглощаются стенкой кишечника, что приводит к внутрипросветному накоплению гиперосмолярных частиц. Это в свою очередь стимулирует задержку воды в просвете кишечника, размягчает стул и усиливает перистальтику. Кроме того, некоторые осмотические слабительные усиливают перистальтику через снижение внутрипросветного рН [37]. Наиболее часто используемые препараты данной группы обсуждаются ниже.
Полиэтиленгликоль. ПЭГ – это осмотическое слабительное средство перорального применения, линейный полимер, в котором молекулы воды удерживаются посредством водородных связей, вызывая увеличение объема внутрипросветной жидкости. Он не метаболизируется и минимально (<1%) всасывается в кишечнике [38]. Были разработаны различные типы ПЭГ – 3350 и 4000 – с молекулярной массой 3350 и 4000 г/моль соответственно. Доказано, что ПЭГ более эффективен в увеличении частоты стула (≥3 раз в неделю), чем плацебо, лактулоза и магния гидроксид, при лечении запоров [37, 39–41]. Использование ПЭГ безопасно даже для детей в возрасте до 2 лет [24]. Таким образом, ПЭГ является слабительным средством первого выбора для педиатрической когорты пациентов с ФЗ. Рекомендуемая дозировка – 0,2–0,8 г/кг/сут. Первичный эффект обычно наступает через 1–2 дня, но может быть отсрочен до 3 суток. При этом основное действие препарата следует оценивать через 1–2 недели от начала его применения. Курс терапии необходимо продолжать не менее 2 месяцев с последующей оценкой симптомов через 2 месяца после прекращения лечения с целью профилактики рецидивов. Побочные эффекты кроме вышеописанного недержания кала включают метеоризм, боли в животе и тошноту. Пациентам, предрасположенным к нарушениям водного и электролитного балансов (например, страдающих патологией печени, почек или принимающих диуретики), необходим контроль электролитов в крови [24].
Лактулоза и лактитола моногидрат. Лактулоза и лактитола моногидрат являются синтетическими производными лактозы. Эти гиперосмолярные агенты не гидролизуются пищеварительными ферментами в тонкой кишке, поэтому плохо всасываются ее слизистой оболочкой. В толстой кишке эти дисахариды ферментируются внутрипросветными бактериями до гиперосмолярных низкомолекулярных кислот [42], что приводит к задержке внутрипросветной жидкости и снижению рН, вызывает усиление кишечной перистальтики. Бактериальная ферментация этих агентов также приводит к образованию газа, который вызывает дополнительное растяжение кишечника и ведет к гиперперистальтике. Действие лактулозы и лактитола моногидрата обычно наблюдается в течение нескольких дней. Побочные эффекты этих препаратов, как правило, незначительны и включают метеоризм, боли в животе и повышенное газообразование, хотя длительное их использование может приводить к электролитному дисбалансу.
В одном из исследований показано, что лактулоза менее эффективна, чем ПЭГ, в отношении частоты стула в неделю, его консистенции, купирования или уменьшения интенсивности абдоминального болевого синдрома [37, 39]. Не было также обнаружено и статистически значимых различий в успешности лечения между лактулозой и лактитола моногидратом, лактулозой и сенной, лактулозой и пищевыми волокнами [37]. Однако, поскольку лактулоза считается практически безопасной для пациентов всех возрастов, она рекомендуется к использованию в отношении детей при ФЗ, если по каким-либо причинам прием ПЭГ невозможен [24].
Магния гидроксид. Магния гидроксид либо другие его соли (например, магния сульфат и магния цитрат) также оказывают слабительное действие, обусловленное осмотическим градиентом, возникающим за счет плохой всасываемости этих гиперосмолярных агентов. Эффект от применения магния гидроксида наступает через 2–8 часов, тогда как магния сульфат оказывает свое действие уже через 1–3 часа. Побочные эффекты включают диарею, гипотензию, слабость и вялость. Тяжелая почечная недостаточность служит противопоказанием к использования магния гидроксида. При этом по увеличению частоты стула в неделю при ФЗ у детей ПЭГ статистически значимо превосходит препараты магния [37].
Стимулирующие слабительные
Если осмотические слабительные средства оказываются неэффективными при лечении ФЗ у детей, в качестве второй линии терапии могут рассматриваться стимулирующие слабительные, оказывающие действие непосредственно на слизистую оболочку кишечника, стимулируя моторику и/или увеличивая секрецию воды и электролитов. Несмотря на то что боль в животе является распространенным побочным эффектом, переносимость стимулирующих слабительных средств чаще всего хорошая. Они считаются безопасными и эффективными, поэтому могут быть использованы при лечении ФЗ у детей [43], хотя достаточной доказательной базы пока не хватает [42, 44].
Дифенилметаны. К этой группе препаратов относятся бисакодил и натрия пикосульфат – неабсорбируемые вещества, которые в толстой кишке гидролизуются до своих активных метаболитов, оказывающих местное прокинетическое действие и стимулирующих кишечную секрецию [42]. Бисакодил существует в двух лекарственных формах – пероральной и ректальной. Слабительный эффект от приема внутрь обычно наступает через 6–8 часов, а бисакодил, вводимый ректально, вызывает гораздо более быстрый эффект (в течение 30–60 минут). Пикосульфат натрия доступен только в качестве перорального препарата; время его действия сравнимо с таковым при применении пероральной формы бисакодила. К наиболее распространенным побочным эффектам относятся боль в животе, тошнота и диарея. Важно отметить, что ректальное введение бисакодила противопоказано детям с проктитом или трещинами заднего прохода [24].
Антрахиноны. Сенна содержит множество антрахинонов и метаболизируется в фармакологически активную форму кишечными бактериями [42], которая усиливает кишечную моторику, стимулирует секрецию воды и электролитов, в то же время препятствуя их обратному всасыванию из толстой кишки. У маленьких детей сенна может потенциально вызывать выраженные кожные высыпания и шелушение в области подгузника, поэтому ее следует использовать только в отношении детей в возрасте ≥1 года [45]. Кроме того, могут отмечаться серьезные осложнения в виде идиосинкразического гепатита, меланоза толстой кишки, гипертрофической остеоартропатии, анальгетической нефропатии, поэтому активного применения в педиатрии препарат не нашел.
Смазывающие средства
Минеральное масло. Минеральное масло (или жидкий парафин) – смесь различных насыщенных углеводов, образующихся в процессе нефтепереработки. Оно не поглощается кишечником, обладает смазывающим эффектом и в меньшей степени оказывает осмотическое действие [46]. Его можно вводить перорально или ректально; слабительный эффект обычно проявляется в течение 1–2 дней.
Жидкий парафин считается безопасным и эффективным при лечении ФЗ у детей [47]. Было проведено несколько исследований, в которых сравнивали минеральное масло с пероральными слабительными при лечении запоров у детей. В частности, данные мета-анализа показали преимущество первого средства перед лактулозой [48–49]. Жидкий парафин также сравнивали с ПЭГ, однако не было выявлено существенных различий в ответе на лечение (определяемом как усиление перистальтики кишечника и уменьшение частоты недержания кала) в обеих группах детей [50]. Кроме того, было показано, что жидкий парафин значительно увеличивает частоту дефекаций и сокращает число эпизодов недержания кала [51]. Однако во всех этих исследованиях качество доказательной базы оказалось низким [37].
При этом следует учитывать, что минеральное масло может выделяться из заднего прохода, вызывая раздражение или зуд кожи, а также оставлять следы на одежде или мебели, что создает дополнительный дискомфорт для пациента [47]. Имеются единичные сообщения о побочных эффектах при применении жидкого парафина в виде нарушения всасывания жирорастворимых витаминов A, D, E и K, образования гранулем и развития липоидной пневмонии (в случае аспирации детьми раннего возраста) [47, 52].
Глицерол. Слабительный препарат, используемый в виде ректальных суппозиториев, смазывает и размягчает каловые массы, тем самым улучшая их прохождение по толстой кишке. Оказывая раздражающее влияние на стенки слизистой оболочки кишечника, стимулирует моторику рефлекторным образом, облегчая процесс дефекации. Препарат вводят ректально через 15–20 минут после завтрака 1 раз в сутки. После введения суппозитория через 5–10 минут происходит дефекация. Остатки суппозитория выводятся с калом. Детям от 5 до 12 лет назначают по 1 суппозиторию, содержащему 1405 мг глицерола, старше 12 лет назначают по 1 суппозиторию, содержащему 2100 мг глицерола. Среди побочных эффектов отмечены аллергические реакции, зуд и жжение в области ануса, спастические боли в кишечнике, раздражение прямой кишки, нарушение физиологического процесса дефекации (при длительном применении) [24].
Натрия докузат. Это терапевтическое средство главным образом для ректального введения, хотя существуют и пероральные формы. Поверхностно-активные свойства натрия докузата стимулируют задержку воды в кале, тем самым оказывая смазывающее действие [42, 53]. Доказательств эффективности натрия докузата у детей с ФЗ нет. Побочные эффекты достаточно редки, но включают диарею и дискомфорт в области прямой кишки [24].
Новые методы фармакологического лечения
Любипростон, линаклотид и прукалоприд – относительно новые препараты, которые, как было установлено, эффективны при запорах [54]. Тем не менее данные об успешном их применении в отношении детей скудны или отсутствуют.
Как любипростон, так и линаклотид способствуют секреции жидкости, богатой хлоридами, в кишечнике, тем самым размягчая стул и увеличивая его объем. Любипростон – производное простагландина Е1, который активирует хлоридный канал подтипа 2 (ClC-2). В проведенном пилотном педиатрическом исследовании оценивали влияние любипростона на течение ФЗ у детей. Результаты показали, что препарат достаточно эффективен и имеет хорошую переносимость со стороны детей и подростков, страдающих запорами [55]. Побочные эффекты включают тошноту, рвоту, диарею и боль в животе [55].
Линаклотид – это синтетический пептид, который активирует люминальный рецептор гуанилина на энтероцитах и таким оборазом способствует секреции жидкости. До настоящего времени не было опубликовано рандомизированных исследований эффективности линаклотида в отношении детей. У взрослых наиболее частым побочным эффектом линаклотида является диарея [54, 56–57].
Прукалоприд – селективный высокоаффинный агонист 5-гидрокситриптамина (серотонина) рецептора 4, который повышает перистальтическую активность желудочно-кишечного тракта [58]. В открытом неконтролируемом 8-недельном исследовании лечение прукалопридом оказало благоприятное влияние на частоту стула, его консистенцию и частоту недержания кала [59]. Однако результаты недавно опубликованного европейского многоцентрового двойного слепого клинического исследования детей с запорами показали, что прукалоприд был не более эффективен, чем плацебо, в увеличении частоты стула или снижении частоты недержания кала. Отмеченные побочные эффекты включают головную боль, тошноту, боль в животе и диарею [58].
Прогноз и последующее наблюдение
Большинство детей с ФЗ успешно поддаются лечению с использованием вышеупомянутых разнообразных широкодоступных терапевтических средств. Согласно проведенному систематическому обзору проспективных исследований, в течение 6–12 месяцев примерно у 50% детей с ФЗ отмечалась положительная динамика на фоне терапии и примерно столько же пациентов все еще имели симптомы, несмотря на использование слабительных средств [24]. После периода наблюдения, продолжавшегося 5–10 лет, 56,0±11,3% детей больше не страдали запорами и не нуждались в медикаментозной терапии [18]. Тем не менее у остальных симптомы могут сохраняться в подростковом и даже взрослом возрасте, несмотря на применение слабительных средств [60–62].
Заключение
Таким образом, ведение пациента с ФЗ представляет собой многоэтапный алгоритм, включающий обучение, коррекцию пищевого поведения, формирование туалетных навыков и медикаментозное лечение. Максимально раннее начало адекватной терапии играет ключевую роль в ведении детей с ФЗ, поскольку задержка между появлением симптомов запора и первым обращением за медицинской помощью негативно связана с выздоровлением [62].


