Введение
Общеизвестна взаимосвязь обострений атопического дерматита (АтД) с пищевой аллергией, особенно у пациентов молодого возраста. При этом заболевания органов пищеварения служат фактором, поддерживающим хроническое течение АтД и усугубляющим проявления пищевой аллергии [1, 2]. Известно, что поддержание в желудочно-кишечном тракте (ЖКТ) нормофлоры является важным аспектом при ведении пациентов с АтД [3–5]. Поэтому назначение про- и пребиотиков является чаще всего неотъемлемым компонентом комплексного лечения АтД [6]. Однако этот терапевтический прием зачастую не приносит успеха даже в случаях назначения адекватных препаратов пациентам, у которых нарушение нормального состава микрофлоры кишечника подтверждено лабораторными методами. Очевидно, это связано с тем, что в развитии кишечного дисбиоза немаловажную роль играют нарушения гепатоинтестинальной регуляции и процессов детоксикации в печени, однако до последнего времени этому аспекту патогенеза развития АтД были посвящены лишь немногочисленные исследования [7].
Поскольку важное патогенетическое значение патологии органов пищеварения для пациентов АтД молодого возраста, ее своевременное выявление и коррекция позволяют пролонгировать межрецидивный период, уменьшить степень выраженности обострений кожного процесса, а также предотвратить переход кожного процесса в более тяжелую стадию течения. При этом основные проблемы связаны с обнаружением и коррекцией ранней субклинической патологии или стертых форм заболевания того или иного органа пищеварения без явных типичных клинических проявлений. Таким образом, особую важность приобретают высокочувствительные скрининговые методы исследования органов пищеварения.
Цель исследования: оценить наличие и степень выраженности патологических изменений в органах пищеварения, а также контролировать эффективность проводимого лечения путем определения в сыворотке крови пациентов с АтД уровней естественных аутоантител (АТ) к тканевым антигенам органов пищеварения с помощью твердофазного иммуноферментного анализа (ИФА).
Методы
В исследование были включены 102 пациента подросткового и молодого возраста (от 15 до 44 лет) с давностью заболевания от 15 до 44 лет, 55 (54%) женщин и 47 (46%) мужчин с АтД легкого (49 человек) и среднетяжелого (53 человека) течения, без жалоб и анамнестических указаний на патологию органов пищеварения. Пациенты были разделены на две группы, сопоставимые по половозрастному составу и клиническим проявлениям АтД: основную (52 человека) и группу сравнения (50 человек).
В качестве высокочувствительного скринингового метода исследования органов пищеварения был использован твердофазный ИФА для определения в сыворотке крови пациентов с АтД уровней естественных АТ к тканевым антигенам органов пищеварения [8]. Данный метод позволяет судить о наличии и степени выраженности патологических изменений в исследуемых органах и тканях, а также контролировать эффективность проводимого лечения и предназначается для выявления имеющихся или начинающихся заболеваний и мониторинга их динамики. В работе использованы наборы для определения АТ МИЦ «Иммункулус» (Москва). До начала курса лечения и в течение недели после его окончания определяли содержание естественных АТ к ряду тканевых антигенов органов пищеварения:
- АТ – маркеры изменений в стенках желудка и тонкого кишечника (АT к GaM-02 и AT к ItM-07): изменение уровней АТ к ним часто указывает на воспалительные и дегенеративные изменения в стенках желудка и тонкого кишечника;
- АТ – маркеры изменений в ткани печени: АТ к мембранному антигену митохондрий гепатоцитов (АТ к HMMP); изменения уровней АТ к нему часто указывают на патологические изменения в паренхиме печени.
Указанные антигены служат основным антигеном-мишенью, измененный синтез АТ к которым наблюдается при разных формах патологии ЖКТ (язвенная болезнь, гастриты, колиты и др.), а также печени и поджелудочной железы. При разных формах органной патологии наблюдаются изменения сывороточного содержания АТ к одному или нескольким антигенам той или иной органной направленности, зависящей от локализации патологического процесса. Нормальные значения уровней естественных АТ находятся в диапазоне -20 до +10 отн. ед. Если средний индивидуальный уровень иммунореактивности исследуемой сыворотки превышает +10% от среднего уровня реакции контрольной сыворотки с используемыми антигенами, это указывает на поликлональную иммуноактивацию, в большинстве случаев типичную для воспалительных процессов, если, наоборот, средний индивидуальный уровень иммунореактивности исследуемой сыворотки ниже -20% от среднего уровня реакции контрольной сыворотки с используемыми антигенами, то это указывает на поликлональную иммуносупрессию, типичную для массивных латентных внутриклеточных инфекций, хронических интоксикаций, иммунодефицитов любого происхождения.
Лечение пациентов с АтД проведено в соответствии с Федеральными клиническими рекомендациями по ведению пациентов с АтД [9]: пациентам с легким течением АтД с признаками обострения кожного процесса назначили топические глюкокортикостероиды (ГКС) и/или блокаторы кальциневрина по утвержденным схемам; пациентам со среднетяжелым течением АтД дополнительно назначили пероральные антигистаминные препараты в среднетерапевтических дозах и узкополосную средневолновую ультрафиолетовую терапию. Продолжительность курса лечения составила 21 день. Всем пациентам также предписывалось соблюдение гипоаллергенной диеты и применение эмолиентов (в период обострения АтД и вне его).
Дополнительно к стандартному курсу лечения пациентам основной группы также назначались средства метаболической коррекции животного происхождения: восстанавливающие нарушенное кишечное всасывание, нормализующие микробнотканевой обмен и кишечную микрофлору и усиливающие детоксикационную и белоксинтезирующую функции печени, способствующие сорбции и выведению токсинов, согласно инструкции по применению [8]. Дополнительно назначалось энтеросорбирующее средство с детоксикационным и пребиотическим действиями, содержащее лигнин гидролизный и лактулозу по 1 таблетке 2 раза в сутки в течение 3 недель.
Результаты
Исходные значения уровней естественных АТ к антигенам органов пищеварения 102 пациентов с АтД основной группы и группы сравнения в среднем находились в пределах нормальных значений. Однако анализ результатов исследования отдельно пациентов подросткового возраста от 15 до 18 лет с АтД (22 человека в основной группе и 16 в группе сравнения) показал достоверные (р<0,05) изменения уровней естественных АТ к антигенам одного или нескольких органов пищеварения (табл. 1).
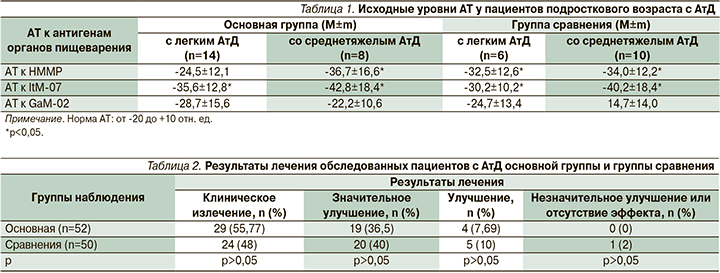
Таким образом, результатом иммунологического исследования стало обнаружение у пациентов подросткового возраста с АтД лабораторных признаков субклинической патологии органов пищеварительной системы.
Поскольку в исследовании принимали участие пациенты с АтД легкой и средней тяжестью течения, курса лечения, состоявшего только из пероральных антигистаминных, наружных ГКС и УФ-терапии, оказалось достаточно для получения клинического эффекта от всех пациентов с АтД. После проведения курса лечения клиническое излечение или значительное улучшение констатировано у 48 (92,3%) пациентов основной группы и 44 (88,0%) – группы сравнения (табл. 2).
У пациентов основной группы индекс SCORAD (SCORing Atopic Dermatitis) уменьшился по M±m до 2±0,145, по медиане до 2 баллов, что сравнимо с результатами лечения в группе сравнения: по M±m – 4±0,48; по медиане – 4 балла; отмечен также быстрый регресс интенсивности зуда. При этом стабильная достигнутая клиническая ремиссия в основной группе отмечена достоверно у большего числа пациентов (p<0,05); (табл. 4).
После проведенной терапии в целом у пациентов обеих групп исследования все значения уровней естественных АТ изменялись в пределах диапазона нормальных значений, достоверных различий не отмечено. У подростков с АтД нарушенные уровни нормализовались, однако в группе сравнения динамика была менее выраженной; изначально измененные уровни АТ к мембранному антигену клеток стенки тонкого кишечника достоверно не изменились (табл. 3).

Нормализация уровней АТ в основной группе после проведенной терапии свидетельствовала о раннем функциональном характере данных нарушений у пациентов подросткового возраста с АтД.
С учетом особенностей течения АтД, а именно: частые обострения кожного процесса под воздействием различных провоцирующих факторов, а также без видимых причин, представлялось важным оценить стабильность достигнутой ремиссии, что также подтвердило бы значимость выявленных функциональных нарушений органов пищеварительной системы в патогенезе АтД и важность их коррекции в составе комплексного лечения. Наблюдение пациентов в течение года с момента окончания лечения показало, что через 6 месяцев после окончания лечения в основной группе сохранялся достигнутый клинический эффект у 71,2% пациентов, через 12 месяцев – у 44,2%; в группе сравнения соответственно у 38,0 и 6,0% (табл. 4).
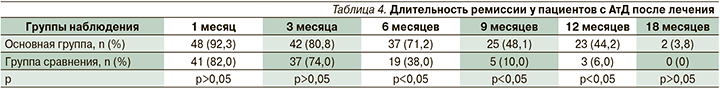
Очевидно, что в основной группе исследования большинство (71,2%) пациентов демонстрировали стабильность достигнутого после лечения клинического эффекта на протяжении 6 месяцев наблюдения; почти половина (48,1%) основной группы не отметили рецидива заболевания в течение 9 месяцев наблюдения, 44,2% – на протяжении 1 года. В то же время в группе сравнения у такого же числа (74,0%) пациентов стабильность достигнутой клинической ремиссии не превышала 3 месяцев, а отсутствие обострения процесса в течение года отмечалось только у 6,0% больных (табл. 4).
Из 28 пациентов основной группы, связавших обострения АтД в основном с нарушением гипоаллергенной диеты, дополнительно получавших средства, направленные на коррекцию выявленных ранних функциональных нарушений в органах пищеварения, у 20 пациентов в течение года наблюдения не было отмечено обострений АтД. В то же время у 25 пациентов группы сравнения, у которых обострения кожного процесса в основном были связаны с нарушениями диеты, стабильного улучшения со стороны кожного процесса отмечено не было, длительность клинической ремиссии после окончания лечения не превышала 3 месяцев.
Обсуждение
Таким образом, после проведения курса лечения клиническое излечение или значительное улучшение (в виде купирования обострения кожного процесса) констатировано у абсолютного большинства (90,2%) обследованных пациентов, при этом скорость регресса воспалительных явлений на коже была одинаковой для пациентов основной и группы сравнения. Главные различия при оценке динамики клинических симптомов в основной группе и в группе сравнения выявлены при сравнении длительности достигнутой клинической ремиссии – в основной группе она была существенно стабильнее.
Выводы
В результате проведенного исследования выявлено, что у пациентов с АтД имеются достоверные отклонения от нормальных значений уровней естественных АТ к мембранным антигенам органов пищеварения (печень, желудок и тонкий кишечник), свидетельствовавшие о вероятном наличии субклинических нарушений метаболического характера, причем у пациентов подросткового возраста (15–18 лет) они выражены в наибольшей степени, что может служить дополнительным фактором прогрессирования кожного процесса.
Выявленные с помощью ИФА нарушения подтверждают целесообразность включения в комплексное лечение пациентов с АтД без клинических проявлений патологии пищеварительной системы энтеросорбирующих препаратов, пищеварительных ферментов, детоксикантов, пребиотиков, а также с учетом патогенетической взаимосвязи нарушений в органах ЖКТ с нарушениями гепатоинтестинальной регуляции и процессов детоксикации в печени – гепатопротекторов и средств метаболической коррекции. Предложенные терапевтические подходы способствуют наступлению более длительной и стойкой клинической ремиссии у пациентов с АтД.


