Обоснование
Герминогенные опухоли (ГО) у мужчин являются одним из наиболее распространенных новообразований в возрастной группе с 15 до 35 лет. Согласно мировой статистике, на долю этой патологии приходится до 1,5% от всех онкологических и до 5% от онкоурологических заболеваний мужчин [1]. Максимальный показатель относительной заболеваемости ГО наблюдается у пациентов в возрасте 25–29 лет и составляет 16,65%. Неуклонный рост числа больных ГО во всем мире на протяжении последних 40–50 лет привел к практически двукратному увеличению заболеваемости. Специфический характер заболеваемости определяет особую социальную значимость этой патологии, необходимость оптимизации существующих и разработку новых диагностических и лечебных методов.
В настоящее время ГО являются одними из наиболее «курабельных» злокачественных новообразований. За последние два десятилетия показатели 5-летней выживаемости выросли с 65 до 95% [2]. При этом клиническую актуальность сохраняют проблемы прогнозирования течения заболевания, ранней и точной оценки эффекта химиотерапии, выбор тактики наблюдения или дальнейшего лечения [3]. Решение этих проблем требует углубленных исследований биологии заболевания и поиска новых диагностических маркеров. В частности, изучение особенностей гистогенеза ГО позволяет разрабатывать новые подходы к оценке риска развития заболевания, прогнозированию характера течения и ответа на химиотерапию [4]. Согласно международным и отечественным клиническим рекомендациям, у всех пациентов с ГО яичка исследуются опухолевые маркеры (а-фетопротеин – АФП, хориогонадотропин – ХГЧ, лактатдегидрогеназа – ЛДГ), и с учетом степени повышения концентрации этих маркеров проводится оценка прогноза и выбор терапии [5]. Но повышение этих показателей наблюдается у 40–80% пациентов, зависит от гистотипа опухоли, наблюдается в очень широком диапазоне, что затрудняет клиническую интерпретацию [6]. Поиск и валидация новых маркеров ГО ведутся активно по разным направлениям, включая тканеспецифические гликопротеины [7], внеклеточную ДНК [8] и циркулирующие опухолевые клетки [9]. Особое внимание привлекают циркулирующие в плазме микро-РНК.
Микро-РНК – это короткие регуляторные молекулы, контролирующие стабильность белок-кодирующих РНК и эффективность белкового синтеза [10]. К настоящему времени описано несколько тысяч молекул этого класса. Для клеток каждой ткани характерен набор, или «профиль», мажорных микро-РНК, который изменяется при развитии патологических состояний, включая неопластическую трансформацию [11]. Поэтому анализ микро-РНК в биопсийном материале рассматривается как перспективный метод диагностики онкологических заболеваний. В дополнение к известным внутриклеточным функциям микро-РНК в составе белковых комплексов или мембранных везикул входят в состав физиологических жидкостей. Определенный «профиль» молекул микро-РНК характерен для циркулирующей плазмы, хотя лишь недавно был описан полный спектр микро-РНК плазмы и нормальный диапазон изменения концентраций «мажорных» молекул [12]. Можно предполагать, что патологическая пролиферация или метаболитическая активность клеток определенной ткани может приводить к появлению в циркулирующей плазме нехарактерных молекул микро-РНК. Это предположение подтверждается многочисленными исследованиями: определенные типы циркулирующих микро-РНК рассматриваются как перспективные маркеры онкологических заболеваний [13], включая колоректальный рак [14], рак молочной железы [15], рак легкого [16]. В целом число «тематических» публикаций исчисляется сотнями и коррелирует c относительными показателями заболеваемости и социальной значимостью онкологических заболеваний.
Но пока нет примеров использования диагностических тестов на основе микро-РНК в клинической практике. Для этого существует ряд причин принципиального (биологического) и методологического характера. Во-первых, диапазон физиологических, качественных и количественных изменений «нормального» пула, циркулирующих в плазме микро-РНК, изучен слабо, а «опухоль-специфичность» отдельных молекул имеет относительный характер. Во-вторых, выделение и количественный анализ микро-РНК из плазмы являются нетривиальной задачей, которая имеет разные (NGS, miRNA-arrays, RT-qPCR) трудоемкие и относительно дорогостоящие решения [17]. Наиболее вероятна разработка диагностических методов на основе реакций обратной транскрипции и последующей ПЦР (ОТ-ПЦР), но принятая для анализа белок-кодирующих РНК техника нормализации результатов ОТ-ПЦР пока не приемлема для микро-РНК [18]. Поэтому многочисленные исследования, основанные на сравнении условных групп «пациентов» и «здоровых доноров», дают обнадеживающие результаты, которые пока трудно использовать для решения конкретных клинических задач.
Активность исследований возможности использования циркулирующих микро-РНК в качестве маркера ГО соответствует социальной значимости заболевания. Так, первая работа, в которой был проведен широкий анализ ГО-ассоциированных изменений «профиля» микро-РНК плазмы, опубликована в 2010 г. [19]. За прошедшие годы проделана большая работа, включая детальное исследование наиболее перспективного маркера miR-371-3p [20], разработку методов корректной интерпретации данных ОТ-ПЦР анализа этой молекулы [21, 22]. Последнее многоцентровое исследование, организованное авторами первых работ и включившее более 500 пациентов, показало высокие показатели диагностической значимости анализа miR-371-3p в плазме (M371TEST): чувствительность 90,1% и специфичность 94,0% [23].
Очевидно, что анализ ГО-специфических микро-РНК в плазме может иметь высокие показатели диагностической значимости и перспективы использования в клинической практике. Но известные методологические сложности анализа циркулирующих микрРНК и десятилетняя история разработки такого теста указывают на проблематичность вопроса.
Цель исследования. Представленное исследование было проведено с целью предварительной оценки диагностической значимости метода анализа миР-371-3 (miR-371-3p) в плазме пациентов с ГО и определения возможностей его оптимизации.
Методы
В исследование были включены пациенты с гистологически верифицированным диагнозом ГО яичка I стадии (n=13). Все пациенты проходили стационарное лечение в отделении онкоурологии и перенесли операцию (одностороннюю орхфуникулэктомию) с последующей гистологической верификацией диагноза. Группа сравнения была сформирована из доноров соответствовавшей возрастной группы (n=15), сдававших кровь в отделении переливания крови «НМИЦ онкологии им. Н.Н. Петрова». Характеристики пациентов, включая возраст и стадию заболевания по системе TNM, представлены в табл. 1.

 Исследование состояло из трех этапов, схематично представленных на рис. 1. Первый этап включал разработку и оценку аналитических характеристик метода ОТ-ПЦР анализа миР-371-3. Второй этап предполагал анализ диагностической значимости разработанного метода с использованием клинического материала: плазмы пациентов с ГО и здоровых доноров. В рамках третьего этапа была разработана и протестирована технология специфического выделения из плазмы молекулы миР-371-3. Работа по созданию метода диагностики и мониторинга течения ГО на основе анализа циркулирующей миР-371-1 не завершена, в данной статье представлены текущие результаты и рассмотрены перспективы оптимизации технологии.
Исследование состояло из трех этапов, схематично представленных на рис. 1. Первый этап включал разработку и оценку аналитических характеристик метода ОТ-ПЦР анализа миР-371-3. Второй этап предполагал анализ диагностической значимости разработанного метода с использованием клинического материала: плазмы пациентов с ГО и здоровых доноров. В рамках третьего этапа была разработана и протестирована технология специфического выделения из плазмы молекулы миР-371-3. Работа по созданию метода диагностики и мониторинга течения ГО на основе анализа циркулирующей миР-371-1 не завершена, в данной статье представлены текущие результаты и рассмотрены перспективы оптимизации технологии.
Венозную кровь для анализа концентрации миР-371-3 собирали до начала лечения в вакутейнеры с ЭДТА (этилендиаминтетрауксусная кислота), центрифугировали (2000 хG, 15 минут, +4°С) и отделяли плазму. Образцы плазмы хранили при температуре -80°С.
Выделение тотальной РНК (традиционный метод). Для разрушения комплексов белков плазмы и РНК к 200 мкл плазмы добавляли 600 мкл лизис-буфера (5 М гуанидинтиоцианат, 1 М смесь цитрата натрия и лимонной кислоты, 10%-ный лаурилсаркозинат натрия) и инкубировали на шейкере при 65°С в течение 15 минут. Центрифугировали и прозрачный супернатант переносили в новую пробирку. Затем добавляли изопропанол (600 мкл) и 10 мкл суперпарамагнитных наночастиц (СПМЧ), покрытых диоксидом кремния (ООО «Силекс», Москва), на поверхности которых сорбирoвалась РНК. После концентрации СПМЧ с помощью магнитного штатива супернатант сливали, а частицы с адсорбированной РНК промывали дважды 70%-ным этанолом (500 мкл), ацетоном (300 мкл) и высушивали. Для элюирования РНК частицы смешивали с 10 mМ Трис-HCl, рН 8,5 (300 мкл), инкубировали в течение 5 минут на шейкере при 65°С. Элюирующий буфер, содержащий РНК, отделяли от СПМЧ и хранили при -80°С. Концентрацию и чистоту экстрагированной РНК анализировали на спектрофотометре Implen NanoPhotometr N60 (Implen Gmb, Munchen). Концентрация РНК составляла от 100 до 900 нг/мкл. Препараты считали чистыми при показателе поглощения A260/A280 выше 1,8.
Выделение миР-371-3 (новый метод). Для специфического выделения из плазмы молекулы микро-РНК (миР-371-3) использовали комплементарный зонд, меченный по 5’-концу биотином. Зонд добавляли к образцу после процедуры лизиса при 65°С, инкубировали при комнатной температуре для образования «дуплексов» в течение 30 минут. Затем к образцу добавляли СПМЧ, покрытые стрептавидином (ООО «Синтол», Москва).
В ходе 30-минутной инкубации происходило аффинное взаимодействие биотин-стрептавидин, в результате которого происходила фиксация дуплекса миР-371-3/зонд к СПМЧ. После серии отмывок миР-371-3 отделяли от комплекса нагреванием.
Обратная транскрипция и ПЦР (ttRT-PCR). Дизайн системы ttRT-PCR и оценка экспрессии молекул микро-РНК были проведены в соответствии с рекомендацией авторов (Androvic et al., 2017). Последовательности синтетических микро-РНК, праймеры и зонды представлены в табл. 2.
Все реакции ОТ-ПЦР проводили на CFX96 Touch™ (Bio-Rad, США). Реакцию обратной транскрипции (ОT) проводили с использованием 2 мкл РНК и 1 мкМ ОТ-праймера и реагентами для обратной транскрипции M-MuLV-RH (ООО «Алгимед-Техно», Минск) в реакционном объеме 20 мкл. Реакцию проводили при 25°С в течение 45 минут с последующей инкубацией при 85°С в течение 5 минут для инактивации обратной транскриптазы. Количественную ПЦР проводили в объеме 20 мкл, используя 2 мкл ревертазной смеси, 2 мкл праймеров для ПЦР (6 мкМ), 2 мкл FAM-меченого зонда (4 мкМ), ферментную смесь для ПЦР (ООО «Алгимед-Техно», Минск). Условия для ПЦР были следующими: 95°С в течение 10 минут и 45 циклов: 95°С – 5 секунд, 65°С – 15 секунд. ОТ-ПЦР для каждого образца повторяли дважды, результаты усредняли.
Протокол исследования был одобрен локальным этическим комитетом «НМИЦ онкологии им. Н.Н. Петрова» в рамках утверждения плана инициативной НИР NАААА-А18-118012390157-2. Перед включением в исследование пациенты и доноры подписали форму информированного согласия на участие в работе.
Анализ данных ПЦР проводили с помощью программ CFX Manager Software, Excel 10.0, Sigma Plot 11,0 GraphPad Prizm 12,0. Оценка статистической значимости разницы исследуемого параметра между клиническими группами проводилась методом Манна–Уитни.
Результаты
Разработка и оценка аналитической ценности метода ОТ-ПЦР анализа миР-371-3. Размер молекулы микроРНК сопоставим с размером праймеров для ПЦР. Поэтому перед проведением обычной ПЦР, необходимо не только провести реакцию обратной транскрипции (ОТ), или синтеза комплементарной ДНК (кДНК), но и каким-то образом «удлинить» эту кДНК. Существует несколько методов проведения таких реакций [24], каждый из которых отличается определенным сочетанием показателей чувствительности и специфичности анализа. В 2017 г. P. Androvic et al. разработали оригинальный метод ОТ, в ходе которого «хвосты» молекулы – праймера взаимодействуют с анализируемой микроРНК, инициируя синтез молекулы кДНК, имеющей достаточную длину и содержащую два участка, комплементарных детектируемой микро-РНК (рис. 2). Эти участки используются для инициации ПЦР с помощью комплементарных ПЦР-праймеров. Такая особенность обеспечивает высокую специфичность технологии по сравнению с другими методами, в которых ПЦР является универсальной либо полуспецифичной (используется только один праймер, комплементарный детектируемой молекуле). Высокие аналитические характеристики системы (two-tailed/ttRT-PCR) показаны в работах авторов технологии [25] и подтверждены в наших исследованиях [26].
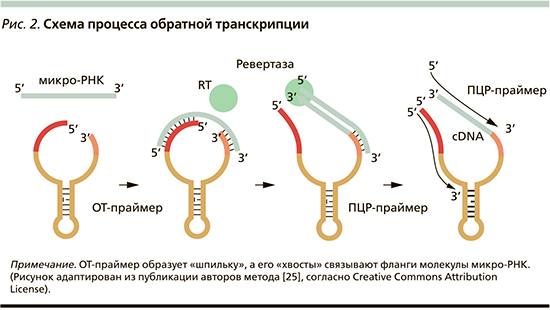
В рамках данного проекта был сделан дизайн системы ttRT-PCR для количественного анализа молекулы миР-371-3. Оценка аналитической эффективности системы была проведена с использованием «линейки» разведений синтетического аналога детектируемой молекулы, т.н. мимика. На рис. 3 показаны результаты: система позволяет проводить детекцию молекулы миР-371-3 в диапазоне концентраций 10^5 – 10^13 молекул/реакции. Эта система была признана пригодной для решения задачи данного исследования и работы с клиническими образцами.
Сравнительный анализ концентрации миР-371-3 в плазме пациентов с ГО яичка и здоровых доноров. Используя описанную выше систему, мы провели анализ концентрации миР-371-3 в плазме пациентов с верифицированным диагнозом ГО (n=13) и здоровых доноров (n=15). При этом детекция миР-351-3 в плазме происходила на границе линейного диапазона зависимости значения Ct от концентрации миР-351-3, т.е. в области минимальных измеряемых концентраций (рис. 3). Детектируемые значения Ct колебались в диапазоне 30–35, что теоретически соответствует амплитуде изменений концентрации молекулы миР-371-3 в 32 раза (2^5).
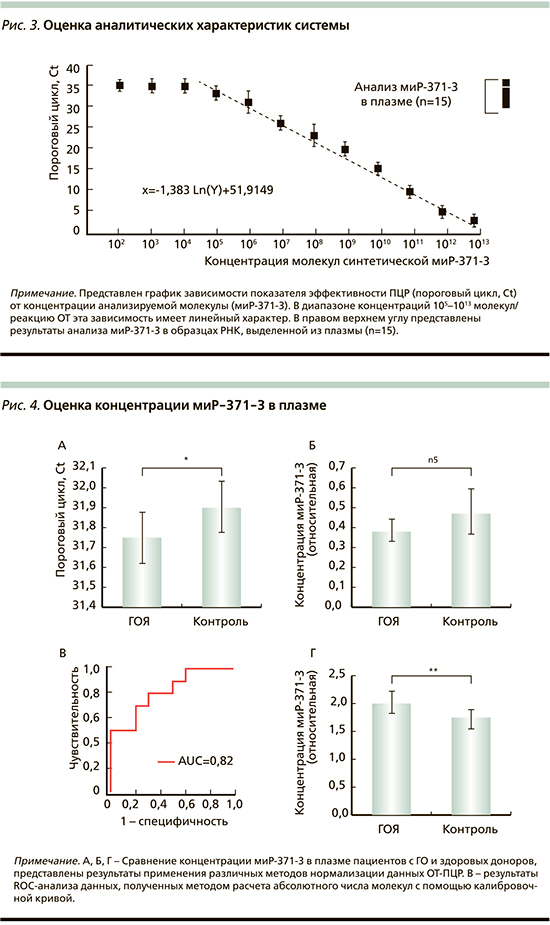
Для оценки возможной связи уровня миР-371-3 в плазме с развитием ГО необходимо было выбрать стратегию анализа результатов ОТ-ПЦР. Традиционно первым шагом анализа экспрессионных данных является нормализация относительно т.н. референсных (house-keeping) молекул, т.е. молекул, концентрация которых является постоянной. Как отмечалось ранее, отсутствие надежных «референсных» микро-РНК является одной из основных проблем практического использования технологий анализа этих молекул. В статье M. Spiekermann et al. было предложено не проводить нормалзации уровня миР-371-3 вовсе, а оценивать непосредственно значение порогового цикла (Ct) [22]. Авторы этой работы сделали аккуратное заключение о том, что такой метод можно использовать лишь в случае стандартизованной процедуры подготовки и анализа каждого образца. Сделав такое допущение, мы посчитали средние значения Ct (миР-371-3) для двух клинических групп (ГО и норма). На pис. 4А представлены полученные результаты: среднее значение порогового цикла (Ct) в группе ГО оказалось ниже, чем в контроле. То есть в плазме пациентов с ГО концентрация молекул миР-371-3 была выше, чем в норме (p<0,5). Мы попытались применить традиционный метод нормализации (dCt), использовав в качестве нормализатора комплементарное плечо «шпильки» премикро-РНК, которое отделяется или деградирует в процессе созревания молекулы. Если предполагать, что миР-371-3 активно секретируется клетками ГО, то поступление миР-371-5 в плазму может отражать фоновый уровень концентрации микро-РНК. Результаты показаны на pис. 3Б: при таком подходе мы получили обратную картину. Третий вариант обработки результатов предполагал математический расчет числа молекул в исходных образцах с помощью функции, обратной той, что представлена на pис. 3: Y=2*10^(-16)*EXP(-0,723X). Расчитанные таким образом и усредненные данные представлены на pис. 4Г. В этом случае концентрация маркерной молекулы миР-371-3 была выше в плазме пациентов (p>0,05). Используя полученные последним методом данные, мы оценили диагностическую значимость метода с помощью ROC (receiver operating characteristic)-анализа (pис. 3В), получив относительно высокие значения AUC (Area Under Curve) – 0,82. Представленные результаты выявили репроблематичность использования существующей методики, которая определяется низкой концентрацией детектируемой молекулы в плазме. Даже использование высокочувствительного метода детекции не позволяет получать уверенные результаты, а их интерпретация зависит от метода анализа.
Определение путей повышения чувствительности анализа. Полученные результаты указывают на необходимость поиска путей оптимизации метода. Теоретически можно предполагать несколько вариантов:
- разработка метода специфичекого выделения (обогащения) маркерной молекулы из плазмы, что позволит повысить аналитическую чувствительность метода;
- идентификация и одновременная детекция некольких родственных молекул [19], что позволит повысить диагностическую чувствительность метода ценой снижения специфичности.
Так, например, в цитируемой работе R.D. Palmer et al. [19] было показано ГО-ассоциированное одновременное повышение концентрации нескольких родственных микро-РНК (miR-371-373, miR-302 кластер), имеющих идентичный регион: GCACTT. Разработка технологии детекции этого региона, т.е. всего набора ГО-ассоциированных молекул микро-РНК, могла бы существенно повысить диагностическую чувствительность метода.
В рамках данного исследования мы попытались реализовать первый подход. Принцип метода выделения маркерной молекулы из плазмы представлен на pис. 5. После лизиса белковых компонентов плазмы и высвобождения всех мирко-РНК из состава белковых комплексов и везикул (pис. 5А) к раствору добавляются т.н. зонды – молекулы ДНК, комплементарные маркерной миР-371-3 и меченные биотином (pис. 5В). Короткая инкубация приводит к образованию дуплексов миР-371-3/зонд. После этого в раствор добавляются суперпарамагнитные микрочастицы (СПМЧ), поверхность которых «декорирована» стрептавидином. Аффинное взаимодействие стрептавидина на поверхности СПМЧа биотина на зондах приводит к концентрации маркерных молекул на поверхности СПМЧ (pис. 5В). После отмывания СПМЧ от компонентов плазмы и нецелевых мирко-РНК (pис. 4Г) маркерные молекулы миР-371-3 отделяются от комплекса нагреванием, которое разрушает комплементарную связь миР-371-3/зонд (pис. 5Д).
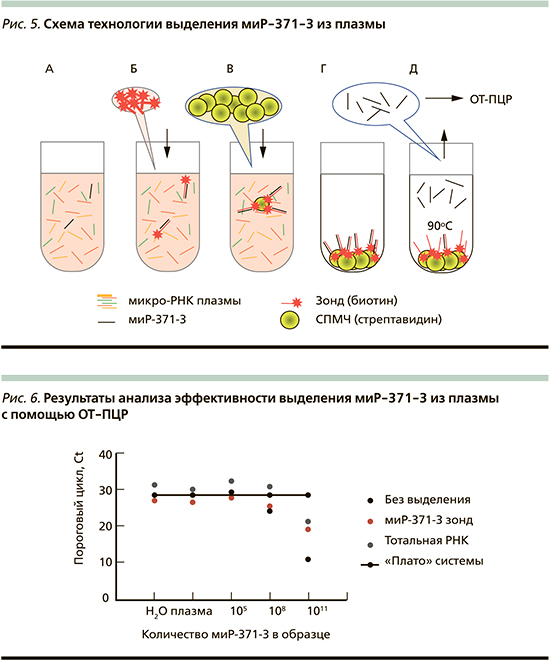
Оценка эффективности метода спе-цифического выделения (обогащения) миР-371-3 из плазмы перед ОТ-ПЦР.
В рамках представленной работы была реализована описанная технология и проведена оценка ее эффективности. Для этого мы использовали 3 образца с известной концентрацией синтетической молекулы миР-371-3 (10^5, 10^8 и 10^11 молекул в реакции), образец донорской плазмы и воду в качестве контроля «нулевой концентрации». Выделения РНК проводили параллельно двумя методами: выделение тотальной РНК с помощью СПМЧ, покрытых диоксидом кремния (стандартный метод) и выделения миР-371-3 с помощью комплементарных зондов и СПМЧ, покрытых стрептавидином. Оценка эффективности выделения была проведена путем ОТ-ПЦР. На pис. 6 представлены результаты. При сравнении данных по трем образцам с известной концентрацией максимальная эффективность ПЦР (минимальное значение Ct) наблюдалось при непосредственном анализе образца без процедуры выделения (черные точки). При использовании нового метода специфической изоляции миР-371-3 наблюдалась закономерная потеря части молекул и значение пороговых циклов ПЦР было несколько выше (красные точки). Выделение традиционным методом приводило к еще более существенным потерям и более высоким значениям Ct. Полученные результаты демонстрируют эффективность технологии выделения. Но применение этой технологии будет иметь смысл только в случае, если она позволит добиться миР-371-3 как минимум 100 тыс. молекул/реакции. Сомнительность получения достоверных результатов при низких концентрациях (или отсутствии) детектируемых молекул будет определяться порогом аналитической чувствительности ОТ-ПЦР. На графике черной линией показано «плато» системы – значение пороговых циклов ПЦР, которые наблюдаются в отсутствие аналита. На уровне этого «плато» детектируется сигнал ПЦР при анализе воды или плазмы, полученной от здорового донора.
Обсуждение
В рамках представленного исследования была разработана технология ОТ-ПЦР-анализа концентрации молекулы миР-371-3 в плазме, но концентрация этой молекулы в плазме оказалась близкой к порогу аналитической чувствительности метода. С помощью разработанной технологии был проведен сравнительный анализа концентрации миР-371-3 в плазме пациентов с ГО и здоровых доноров. Результат сравнения оказался зависимым от метода обработки данных ПЦР. Используя абсолютную концентрацию миР-371-3 в качестве диагностического маркера, удалось показать статистически значимую разницу между группами «ГО» и «здоровые доноры». Оценка диагностической значимости такого маркера с помощью ROC выявила относительно высокий показатель AUC=0,82. Но чувствительность метода была признана недостаточной для использования в клинической практике. С целью повышения чувствительности методики разработана технология специфического выделения молекулы миР-371-3 из плазмы. Эффективность выделения миР-371-3 с помощью этой технологии была подтверждена экспериментально с помощью экспериментальных выделений синтетического аналога молекулы из растворов различной концентрации. Для оценки совокупной эффективности двух разработанных технологий необходимо провести анализ с привлечением большего объема клинического материала.
В целом полученные результаты показали эффективность разработанных технологий и теоретическую возможность использования циркулирующей молекулы миР-371-3 в качестве маркера для диагностики и/или мониторинга терапии ГО. В то же время представленные данные пока не позволяют рекомендовать метод диагностики и мониторинга ГО с помощью ОТ-ПЦР для внедрения в клиническую практику.
В силу технологических ограничений метода ОТ-ПЦР анализа микро-РНК и низкой концентрации молекулы миР-371-3 в плазме пациентов с герминогенной опухолью на первой стадии развития заболевания (без признаков диссеминации за пределы яичка) чувствительность предложенного метода оказалась неудовлетворительной. Кроме того, не определен оптимальный алгоритм анализа (нормализации) полученных данных, что может быть некритично при решении исследовательских задач, но представляется необходимым при использовании метода в рамках решения индивидуальных клинических вопросов. Возможным подходом к повышению чувствительности метода является разработка технологии параллельного (одновременного) анализа нескольких родственных молекул микро-РНК, появление которых в плазме ассоциировано с ГО.
Основным ограничением данного исследования был ограниченный объем клинического материала и отсутствие материала от пациентов с распространенными формами заболевания. Кроме того, включение в исследование пациентов с другими онкологическими заболеваниями дало бы возможность оценить специфичность метода, которая в рамках данного исследования не могла быть определена.
Заключение
Оптимизация методов мониторинга пациентов с ГО яичка является актуальной научной задачей, ее решение может улучшить результаты лечения и качества жизни пациентов, большинство из которых относятся к людям молодого и среднего возраста. На основе анализа научной литературы [23] было сделано предположение о возможности использования циркулирующей молекулы микро-РНК, миР-371-3 (HSA-miR-371-3p) в качестве маркера этого заболевания. В рамках представленной работы были созданы система для ОТ-ПЦР-анализа этой молекулы и метод для ее специфического выделения из плазмы. Кроме того, проведена пилотная оценка диагностической значимости методики и определены возможности ее оптимизации. Для рекомендации внедрения метода в клиническую практику оптимизированная технология должна быть испытана в рамках масштабных клинических испытаний и ее эффективность сопоставлена с эффективностью существующих маркеров (АФП, ХГЧ, ЛДГ).


