Обоснование
Адъювантная терапия при раке желудка подразумевает лекарственное лечение после проведения потенциально радикальной резекции. Однако поскольку восстановление после гастрэктомии может быть длительным, адъювантная терапия часто откладывается или ее проведение отменяется вовсе. В исследовании адъювантной химиотерапии (АХТ) TS-1 при раке желудка (ACTS-GC) в Японии изучался пероральный фторпиримидин S-1 в группе из 1059 пациентов (стадии II–IIIB). S-1 назначался в течение 12 месяцев (4 недели приема/2 недели перерыва). В общей сложности 529 пациентов перенесли операцию плюс S-1, 530 пациентов – только операцию. Трехлетняя ОВ составила 80,1 и 70,1% соответственно (отношение рисков [ОР]=0,68), и это преимущество показателя выживаемости сохранялось в течение 5 лет: 71,7% с адъювантом S-1 по сравнению с 61,1% только с хирургическим вмешательством (ОР=0,669, 95% доверительный интервал [ДИ] от 0,540 до 0,828) [1]. Кроме того, в исследовании CLASSIC, проведенном в Азии, сообщалось о результатах применения адъювантного режима XELOX (капецитабин+оксалиплатин). В этом исследовании все пациенты перенесли резекцию желудка с лимфодиссекцией D2, пациенты со стадиями от II до IIIB были рандомизированы для получения 6 месяцев (8 циклов) капецитабина/оксалиплатина или в группу наблюдения [2]. Это было большое исследование, в котором 520 пациентов были рандомизированы для получения АХТ и 515 только на операцию. Исследование достигло своей первичной конечной точки: 3-летняя безрецидивная выживаемость (БРВ) составила в группе с ХТ 74% (95% ДИ – 69–79%) по сравнению с 59% (95% ДИ – 53–64%) среди пациентов с одной только хирургией (р<0,0001). Предполагаемая 5-летняя ОВ составила 78% (95% ДИ от 74 до 82%) в группе адъюванта XELOX против 69% (95% ДИ от 64 до 73%) в группе наблюдения [3]. В отличие от этих положительных исследований, проведенных в Азии, ряд более старых исследований дали отрицательные результаты [4–9]. Например, в итальянском исследовании (GOIRC) 128 пациентов были рандомизированы в одну хирургическую тактику по сравнению со 130 пациентами, получавшими ХТ в режиме цисплатин, эпирубицин, лейковорин и 5-фторурацил (5-ФУ) в качестве адъювантной терапии. Не было никакой разницы в 5-летней БРВ (42 против 43%) или 5-летней ОВ (49 против 48%) соответственно [8].
Имеются результаты нескольких мета-анализов АХТ при раке желудка. Мета-анализ M.E. Buyse et al., включивший 16 исследований с участием 3710 пациентов, продемонстрировал улучшение показателя ОВ в пользу АХТ (ОР=0,83; 95% ДИ – 0,76–0,91; р<0,0001). Абсолютная выгода составила 6,3% за 5 лет [10]. Группа GASTRIC провела мета-анализ, включивший 3838 пациентов из 17 исследований. Они также подтвердили улучшение ОВ в пользу АХТ (ОР=0,82, 95% ДИ – 0,75–0,90; р>0,001). Абсолютная выгода составила 5,9% за 5 лет [11].
Пять более поздних исследований указывают на то, что адъювантная терапия снижает риск рецидива примерно на 10%, причем степень лимфодиссекции значительно варьировалась в этих исследованиях. Подводя итог, можно сказать, что польза от АХТ была продемонстрирована только в рандомизированных исследованиях после проведенной диссекции лимфатических узлов в объеме D2.
Современные российские рекомендации по адъювантной терапии больных раком желудка подкреплены результатами клинических исследований, проведенных среди пациентов азиатской популяции [2, 11]. С учетом расхождений в показателях ОВ у пациентов разных этнических групп можно предположить принципиально отличные особенности биологии их опухолей [12, 13].
Цель исследования: оценить показатели выживаемости и результаты лечения пациентов с диагнозом «местнораспространенный рак желудка», получавших АХТ.
Методы
Для ретроспективного анализа выбраны 45 пациентов с диагнозом «рак желудка II–III стадий», получавших лечение в СПбГБУЗ «Городской клинический онкологический диспансер» с 2009 по 2010 г. Обязательным критерием включения пациентов в исследование было проведенное хирургическое лечение в рамках 1-го этапа комплексного лечения, объем хирургического пособия: резекция желудка или гастрэктомия.
В исследуемую группу вошли 44,4% (20) мужчин и 45,6% (25) женщин. Возраст пациентов варьировался от 39 до 70 лет, медиана возраста составила 58,0 лет (95% ДИ – 56,0–59,0).
При первичном обращении в поликлинику ГКОД пациентов все представленные образцы опухолевой ткани подвергались повторному морфологическому исследованию с целью уточнения гистологической структуры опухоли. После хирургического лечения всем пациентам проведена АХТ в режиме PF: цисплатин 80 мг/м2 внутривенно капельно в 1-й день (на фоне гидратации)+5-ФУ 1000 мг/м2 внутривенно капельно в виде 24-часовых инфузий с 1-го по 4-й день каждого цикла (учитывая стандарты на момент начала лечения); интервал между циклами – 21–28 дней. Всем пациентам 1-й цикл АХТ был начат в сроки от 4 до 10 недель после хирургического вмешательства; медиана времен начала АХТ составила 7 недель (95% ДИ – 6,0–7,0). Все пациенты получили от 1 до 6 циклов АХТ, среднее число циклов – 3,51±0,15 (95% ДИ – 3,21–3,81).
Показатели ОВ и выживаемости без прогрессирования оценены по состоянию на 01.09.2019.
Результаты
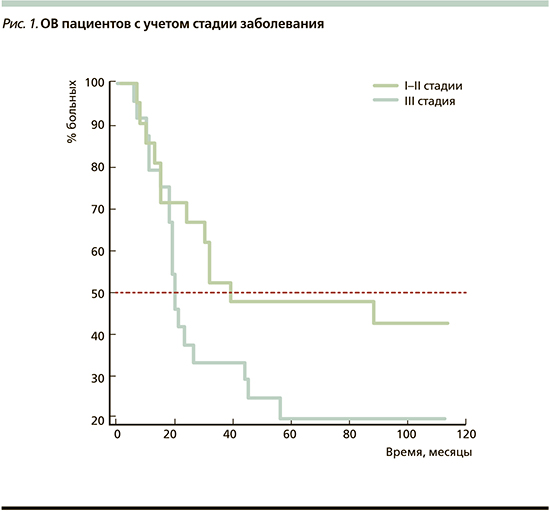
Медиана ОВ общей когорты больных, включенных в исследование, составила 26 месяцев (95% ДИ – 19,0–45,0). ОВ пациентов в зависимости от стадии развития заболевания (I–II и III стадий) достоверно не различалась, несмотря на тот факт, что ОВ пациентов с I–II стадиями составила 39 месяцев (95% ДИ – 15–88) и на 19 месяцев превышала медиану ОВ пациентов с III стадией заболевания, где она составила 20 месяцев ((95% ДИ – 18–44; log-rank test: p=0,0994). Однако следует говорить о наличии уверенной тенденции к увеличению ОВ в группе пациентов с ранними стадиями заболевания (ОР=0,5448, 95% ДИ – 0,26–1,12) (рис. 1).
Медиана ОВ пациентов, получавших 1 цикл АХТ, составила 7 месяцев (95% ДИ – 6–18), 3 цикла АХТ – 26 месяцев (95% ДИ – 8–32), 4 цикла АХТ – 32 месяца (95% ДИ – 19–88). Медиану ОВ пациентов, получивших 2 и 6 циклов терапии, оценить невозможно в связи с малым числом пациентов в данных группах. Следует отметить, что ОВ пациентов, получивших 3 и 4 цикла АХТ, достоверно отличалась от ОВ пациентов, получивших только 1 цикл АХТ (увеличение ОВ составило при 3 циклах 19 месяцев, при 4 циклах – 25 месяцев) (log-rank test p<0,0001; ОР=0,1276 – 3 цикла, 95% ДИ – 0,008–2,13; ОР=0,1226 – 4 цикла, 95% ДИ – 0,008–1,92).
В группе пациентов, получавших АХТ, проведен анализ влияния морфологической картины опухоли на ОВ. На первом этапе выделена группа пациентов с перстневидноклеточной структурой опухоли и проведено сравнение кривых выживаемости данных пациентов с пациентами, морфологическая структура опухоли которых была иной.
Медианы ОВ пациентов с различными гистологическими типами аденокарциномы желудка были следующими:
- медиана ОВ пациентов с низкодифференцированной аденокарциномой составила 44 месяца (95% ДИ – 20–88);
- медиана ОВ пациентов с умеренно дифференцированной аденокарциномой составила 32 месяца (95% ДИ – 10–56);
- медиана ОВ пациентов с высокодифференцированной аденокарциномой составила 11,0 месяцев (95% ДИ – 8,0 – 39,0);
- медиана ОВ пациентов с недифференцированной аденокарциномой составила 19 месяцев (95% ДИ – 7–19);
- медиана ОВ пациентов со скиррозной аденокарциномой составила 26 месяцев (95% ДИ –20–45);
- медиана ОВ пациентов с перстневидноклеточной аденокарциномой составила 15 месяцев (95% ДИ –11–19).
Полученные данные говорят о том, что «выигрыш» от применения АХТ по ОВ получили пациенты с низкодифференцированной аденокарциномой (18 месяцев по сравнению с общим показателем ОВ в группе) и умеренно дифференцированной аденокарциномой (6 месяцев по сравнению с общим показателем ОВ в группе), и несмотря на тот факт, что данные различия не достоверны (log-rank test p=0,11; ОР=0,5574 – низкодифференцированная аденокарцинома, 95% ДИ – 0,27–1,14; ОР=0,9798 – умеренно дифференцированная аденокарцинома, 95% ДИ – 0,34–2,82), следует говорить о тенденции к улучшению показателя ОВ у пациентов с низко- и умеренно дифференцированной аденокарциномой желудка при проведении АХТ (рис. 2).
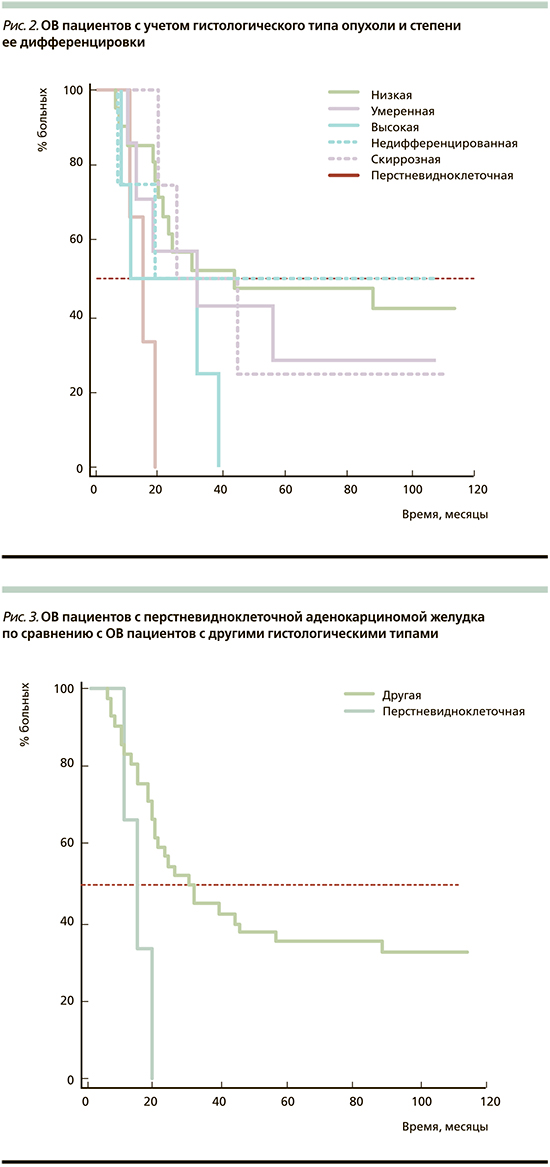
А наименьший выигрыш по показателю ОВ при применении АХТ получили пациенты, у которых дифференцировка опухоли была высокой (Grade 1), и пациенты с перстневидноклеточной дифференцировкой.
В группе пациентов с высокой дифференцировкой опухоли медиана ОВ составила 11 месяцев (что на 15 месяцев меньше, чем показатель ОВ в общей группе), и хотя данная разность недостоверна (log-rank test: p=0,1374), можно говорить о наличии уверенной тенденции к неэффективности АХТ у пациентов с высокодифференцированной аденокарциномой желудка (ОР=3,0238, 95% ДИ – 0,70–13,02) (рис. 3).
А вот число недель от момента хирургического вмешательства до начала АХТ значимого влияния на ОВ не оказало (при условии, что начало АХТ укладывается в допустимые сроки). При условии раннего начала АХТ в срок до 6 недель медиана ОВ составила 19 месяцев (95% ДИ – 15–6). При начале АХТ после 6 недель от момента хирургического вмешательства медиана ОВ составила 30 месяцев (95% ДИ – 19–88). Начало АХТ в срок до 6 недель ухудшало ОВ на 11 месяцев по сравнению с ее началом после 6-й недели от хирургического вмешательства, однако полученная разность недостоверна (log-rank test p=0,9058).
Начало АХТ в срок до 4 недель достоверно также не изменяло показателей выживаемости: медиана ОВ составила 21 месяц (95% ДИ – 19–21), при начале после 4 недель медиана ОВ составила 26 месяцев (95% ДИ – 19–45). Начало АХТ в срок до 4 недель ухудшало ОВ на 5 месяцев по сравнению с ее началом после 4-й недели от хирургического вмешательства, однако полученная разность недостоверна (log-rank test p=0,9040).
Обсуждение
Результаты ретроспективного исследования пациентов ГКОД сопоставимы с таковыми ключевых международных исследований и их мета-анализов. Нет сомнений, что проведение комплексного лечения оправданно более длительными безрецидивным периодом и ОВ по сравнению с этими показателями у тех, кто перенес только хирургическое лечение. Задача исследователя лежит не только в получении результатов, но и в поиске путей их совершенствования в реальной клинической практике. Что касается проблемы, исследованной нами, то скорее всего поиск продолжится в оптимизации применения периоперационной терапии, принятой в качестве стандарта на сегодняшний день. При этом адъювантная терапия остается актуальной для пациентов, у которых первым этапом лечения был хирургический в связи с осложненным течением заболевания или по иным причинам.
Заключение
Медиана выживаемости пациентов, перенесших хирургическое лечение и АХТ, составила 26 месяцев. Проведение более 3 циклов АХТ достоверно увеличивает ОВ.
Число недель от начала хирургического лечения до начала АХТ значимого влияния на ОВ не оказало. Перстневидноклеточный гистологический типа рака желудка можно расценивать как фактор неблагоприятного прогноза.


