Введение
Плоскоклеточный рак органов головы и шеи (ПРГШ) занимает шестое место в структуре заболеваемости и восьмое место в структуре смертности больных злокачественными новообразованиями во всем мире. Ежегодно в мире 550 тыс. случаев первичных опухолей приходится на опухоли головы и шеи (ОГШ), также зарегистрировано 380 тыс. случаев смерти от рака данной локализации [1]. В России за 2018 г. впервые выявлено около 23 тыс. случаев ОГШ [2].
Злокачественные ОГШ по гистологическому варианту представлены в основном плоскоклеточным раком (95%), чаще всего возникают они в полости рта и глотке. Злоупотребление алкоголем, курение табака и инфицирование вирусом папилломы человека (ВПЧ) – основные факторы риска развития ПРГШ [3–5]. Нарушение в работе иммунной системы является одним из важнейших факторов развития и увеличения частоты заболеваемости ОГШ [6].
Цель лечения больных рецидивирующим и/или метастатическим (р/м) ПРГШ в основном направлена на поддержание качества жизни. Медиана общей выживаемости (ОВ) больных р/мПРГШ обычно не превышает одного года [7, 8]. Возможность хирургического лечения и повторной лучевой терапии рассматривается лишь у ограниченного числа больных рецидивирующим местнораспространенным ПРГШ. Платиносодержащая полихимиотерапия, таргетная терапия цетуксимабом в настоящий момент являются стандартом первой линии лекарственной терапии р/мПРГШ [9].
Потенциально новым терапевтическим подходом к лечению ПРГШ является иммунотерапия, нацеленная на иммунные контрольные точки, такие как рецептор программируемой смерти 1-го типа (Programmed cell death, PD-1) [10]. В нормальных условиях иммунная система использует пути ингибирования контрольных точек PD-1, чтобы регулировать целевую активацию T-лимфоцитов и иммунный ответ против патогенов, одновременно предотвращая развитие аутоиммунных реакций. Опухолевые клетки (ОК) используют эти пути для создания иммуносупрессивной микросреды, в которой они могут «скрываться» от иммунной системы [11]. Для ухода от надзора иммунной системы ОК используют механизмы, которые в норме контролируют выраженность и длительность иммунного ответа [12]. Блокирование иммуносупрессивного эффекта PD-1 и -L1 заново «обучает» иммунную систему организма бороться со злокачественной опухолью, лишая возможности ОК «ускользать» от иммунного надзора, что приводит к потенциальной гибели опухоли [13].
Пембролизумаб
Одним из перспективных препаратов в области иммунотерапии является пембролизумаб – человеческое моноклональное антитело, селективно блокирующее взаимодействие между PD-1 и его лигандами PD-L1 и -L2.
В 2016 г. T.Y. Seiwert et al. представили результаты Ib-фазы многокогортного многоцентрового открытого исследования KEYNOTE-012 по оценке безопасности и эффективности пембролизумаба, назначаемого в дозе 10 мг/кг каждые 2 недели больным р/мПРГШ [14]. Представлены данные о больных позитивным PD-L-статусом опухоли р/мПРГШ (n=60), из которых 23 (38%) были ВПЧ-позитивными и 37 (62%) ВПЧ-негативными. Необходимо отметить, что в данном исследовании экспрессию PD-L1 определяли как на опухолевых, так и на иммунных клетках (показатель CPS), что является важным именно при ОГШ, т.к. ранее было продемонстрировано, что экспрессия PD-L1 на иммунных клетках имеет большее прогностическое значение в отношении ОВ и выживаемости без прогрессирования (ВБП), чем на опухолевых. Объективный ответ (ОО) опухоли (по критериям RECIST 1.1 по оценке независимых экспертов; n=45) на лечение у всей популяции больных составил 18% (8 из 45 пациентов; 95% доверительный интервал [ДИ] – 8–32), 25% у пациентов с ВПЧ+ статусом (4 из 16; 95% ДИ – 7–52) и 14% с ВПЧ- статусом (4 из 29; 95% ДИ: 4–32) [14]. В расширенной когорте больных исследования KEYNOTE-012 132 пациента получали фиксированную дозу пембролизумаба 200 мг каждые 3 недели независимо от статуса CPS. Частота ОО составила 18% (95% ДИ: 12–26) по данным исследователей и 20% по оценке независимых экспертов (95% ДИ: 13–28). Медиана продолжительности ответа не была достигнута (диапазон ≥2–11 месяцев). Шестимесячные ВБП и ОВ составили 23 и 59% соответственно. У пациентов с положительным CPS-статусом наблюдалось статистически значимое увеличение частоты ОО (22 против 4%; p=0,021) [15] (см. таблицу). Также в одной из когорт исследования KEYNOTE-012 сообщается о результатах из Азиатско-Тихоокеанского региона. Частота ОО составила 19% (95% ДИ: 7–39). При медиане наблюдения 12 месяцев (диапазон от 2 до 21 месяца) медиана длительности ответа не достигнута (диапазон от 6 до 17+ месяцев) [16].
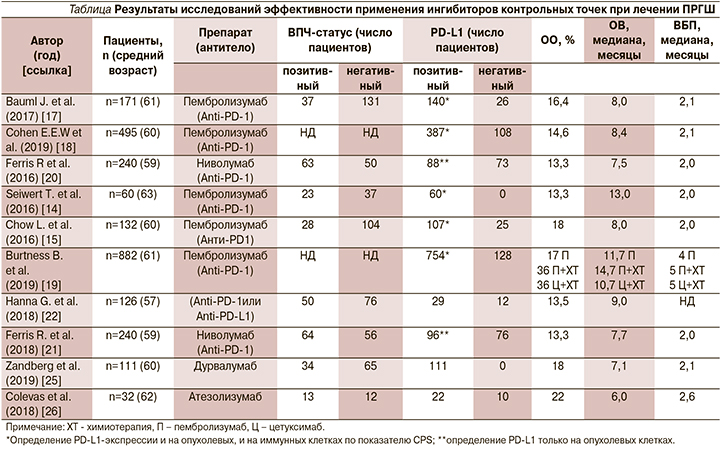
В 2017 г. представлены результаты многоцентрового исследования II фазы (KEYNOTE-055), проведенного J. Bauml et al., в которое включались пациенты с резистентностью к препаратам платины и цетуксимабу. Из 171 пациента 75% получили не менее двух линий терапии, у 82% обнаружен PD-L1-положительный статус опухоли (по показателю CPS); 22% пациентов имели положительный ВПЧ-статус. Частота ОО составила 16% (95% ДИ: 11–23), медиана продолжительности ответа – 8 месяцев (от 2+ до 12+ месяцев). Медиана ВБП составила 2,1, медиана ОВ – 8 месяцев. Шестимесячная ВБП в группах ВПЧ+ и ВПЧ- составила 25 и 21 % соответственно, медиана ОВ не зависела от ВПЧ-статуса. Частота нежелательных явлений (НЯ) любой степени, связанных с терапией, составила 64%; 3–5-я степени НЯ установлены 15% пациентов. В этом исследовании пембролизумаб продемонстрировал клинически значимую противоопухолевую активность и приемлемый профиль безопасности при р/мПРГШ у пациентов, которые уже получили платиносодержащую терапию или цетуксимаб [17].
В 2019 г. E.E.W. Cohen et al. представили результаты рандомизированного открытого исследования III фазы (KEYNOTE-040) по изучению эффективности применения пембролизумаба во второй линии терапии по сравнению со стандартной терапией одним из препаратов на выбор исследователя (метотрексат, доцетаксел или цетуксимаб) пациентов с р/мПРГШ. В исследование были включены 495 пациентов, которые ранее получали платиносодержащую терапию. В группе пембролизумаба медиана ОВ составила 8,4 месяца (95% ДИ: 6,4–4,9), в группе стандартной терапии – 6,9 (95% ДИ: 5,9–9,0) месяца (отношение рисков [ОР]=0,80; 95% ДИ: 0,65–0,98; p=0,0161); одногодичная ОВ в группе пациентов, получавших пембролизумаб, составила 37%, в группе сравнения – 26%. Уровень CPS ≥1 наблюдался у 196 (79%) из 247 пациентов в группе пембролизумаба и 191 (77%) из 248 пациентов в группе стандартной терапии. При анализе эффективности терапии в зависимости от уровня CPS 12-месячная ОВ составила 40,1% на терапии пембролизумабом и 26,1% в группе сравнения (р=0,0049). Частота ОО в общей кагорте составила 14,6% при лечении пембролизумабом (95% ДИ: 10,4–19,6) и 10,1% в группе сравнения (95% ДИ: 6,6–14,5), четырем пациентам лечение пембролизумабом позволило получить полный ответ. Необходимо отметить, что частота ОО зависит от уровня CPS и в группе пациентов, получавших пембролизумаб, она составила 17,3% по сравнению с 9,9% в группе сравнения (р=0,0171).
В группе пембролизумаба медиана продолжительности ответа составила 18,4 месяца (95% ДИ: 5,8–18,4) против 5,0 (ДИ: 3,6–18,8) в группе стандартной терапии. Медиана ВБП составила 2,1 месяца (95% ДИ: 2,1–2,3) в группе пембролизумаба и 2,3 месяца (95%ДИ: 2,1–2,8) в группе сравнения. НЯ 3–5-й степеней, связанные с лечением, возникли у 13% пациентов в группе пембролизумаба по сравнению с 36% в группе стандартной терапии [18].
В 2019 г. B. Burtness et al. представили результаты рандомизированного открытого исследования III фазы (KEYNOTE-048) по изучению эффективности применения пембролизумаба в монотерапии и в комбинации с химиотерапией в первой линии лечения р/мПРГШ, в которое были включены 882 пациента. В этом исследовании пациентов рандомизировали в три группы. В первую группу входили пациенты, которые получали пембролизумаб в дозе 200 мг каждые 3 недели в монорежиме, во вторую – получавшие комбинацию пембролизумаба с химиотерапий (карбоплатин AUC 5/цисплатин 100 мг/м2+5-фторурацил 1000 мг/м2/день), в третьей группе проводилась терапия цетуксимабом в сочетании с химиотерапией (EXTREME). У пациентов с положительным CPS, получавших пембролизумаб в монорежиме, терапия была достоверно эффективнее по показателю ОВ по сравнению с EXTREME: 2-летняя ОВ составила 30,2 и 18,6% соответственно (ОР=0,78). Медиана ОВ составила 11,5 против 10,7 месяца (p=0,019). Комбинация пембролизумаба с химиотерапией значительно увеличила ОВ в общей популяции по сравнению с комбинацией цетуксимаба и химиотерапии. Двухлетняя ОВ в группе пембролизумаба и химиотерапии составила 29 против 18,7% в группе пациентов, получавших режим EXTREM (ОР=0,77; p=0,0034). Эти данные подтверждают, что пембролизумаб и режим «пембролизумаб+цисплатин+5-фторурацил» являются новым стандартом первой линии терапии р/мПРГШ [19].
Ниволумаб
Недавно было продемонстрировано, что ниволумаб – моноклональное антитело, относящееся к иммуноглобулинам класса G (IgG), блокирующее взаимодействие между PD-1 и его лигандами (PD-L1 и PD-L2), активен в отношении р/мПРГШ и был зарегистрирован FDA после публикации результатов открытого рандомизированного исследования III фазы CheckMate 141 [20]. В исследование был включен 361 пациент с рецидивом ПРГШ, возникшим в течение 6 месяцев после применения платиносодержащей химиотерапии. В первой группе пациентов использовался ниволумаб (n=240; 66,5%), который вводился в дозе 3 мг/кг каждые 2 недели. Во второй группе использовалась стандартная системная терапия одним из следующих препаратов: метотрексат, доцетаксел или цетуксимаб (n=121; 33,5%). Медиана ОВ составила 7,5 месяца в группе ниволумаба (95% ДИ: 5,5–9,1) и 5,1 месяца в группе, получавшей стандартную терапию (95% ДИ: 4,0–6,0). ОВ была значительно выше при применении ниволумаба по сравнению с группой сравнения (ОР=0,70; 95% ДИ: 0,51–0,96; р=0,01). Частота ОО составила 13,3% в группе ниволумаба (95% ДИ: 9,3–18,3) против 5,8% в группе стандартной терапии (95% ДИ: 2,4–11,6). НЯ 3–4-й степеней, связанные с лечением, выявлены у 13,1% пациентов в группе ниволумаба и у 35,1% в группе сравнения.
В рандомизированном открытом исследовании III фазы, проведенном R. Ferris. et al., а также в ретроспективном исследовании G.J. Hanna et al. показано увеличение ОВ у ВПЧ-позитивных пациентов, принимавших ниволумаб, по сравнению с ВПЧ-негативными больными (p=0,02). Увеличение OВ у ВПЧ-позитивных пациентов не было зарегистрировано у всех больных, включенных в исследование. Исходя из опубликованных результатов, трудно сделать вывод: существует ли связь между позитивным ВПЧ-статусом и лучшей ОВ и может ли ВПЧ-статус использоваться в качестве предиктивного фактора оценки эффективности иммунотерапии у пациентов с ПРГШ [21, 22]?
Анти-PD-L1-препараты
В настоящее время основным лекарственным средством лечения ПРГШ, нацеленным на PD-L1, является дурвалумаб – моноклональное антитело человеческого IgG1, который блокирует связывание PD-L1 с его рецепторами [23]. В открытое рандомизированное исследование II фазы, проведенное L. Siu et al., включены 237 пациентов с р/мПРГШ. Дурвалумаб использовали в дозировке 20 мг/кг каждые 4 недели в сочетании с тремелимумабом в течение 4 циклов с последующей монотерапией дурвалумабом или тремелимумабом. Частота ОО в группе комбинированной терапии составила 7,8% (95% ДИ: 3,78–13,79), 9,2% для монотерапии дурвалумабом (95% ДИ: 3,46–19,02) и 1,6% для монотерапии тремелимумабом (95% ДИ: 0,04–8,53) [24].
В многоцентровом исследовании II фазы HAWK дурвалумаб использовали пациенты с положительным PD-L1-статуом (показатель TPS ≥25%). Среди 111 пациентов частота ОО опухоли на лечение составила 16,2%, медиана ВБП и ОВ – 2,1 и 7,1 месяца соответственно. НЯ любой степени отмечены в 57,1% случаев, 3–4-я – в 8% [25].
Другой анти-PD-L1-таргетный препарат атезолизумаб (моноклональное антитело IgG1, блокирующее связывание PD-L1 с его рецепторами) оценивался в монорежиме при проведении многоцентрового исследования Ia-фазы пациента с рецидивирующими и/или метастатическими солидными злокачественными новообразованиями или гематологическими злокачественными заболеваниями (всего n=661). В исследование были включены 32 пациента с р/мПРГШ, 7 (22%) из которых не получали предшествовавшей системной лекарственной терапии, 17 (53%) имели ≥2 предшестовавших линий лечения. У 4 (13%) пациентов выявлены НЯ 3–4-й степеней, частота ОО составила 22%, медиана ОВ – 6 месяцев. На основании этих результатов запущено исследование III фазы IMvoke010 [26].
Неоадъювантная иммунотерапия
Пациентам с распространенным ПРГШ современные руководства по лечению в качестве стандарта рекомендуют хирургическое вмешательство с послеоперационной терапией или химиолучевую терапию по радикальной схеме. Несмотря на проведенное комплексное лечение, частота развития рецидивов при ПРГШ остается высокой [9, 27]. Потенциальные терапевтические преимущества неоадъювантной терапии в виде иммунотерапии увеличивают шансы на проведение оптимальных циторедуктивных операций с целью минимизации объема резекции у пациентов, нуждающихся в радикальном хирургическом вмешательстве [28].
Проведение неоадъювантной иммунотерапии до операции не лишено риска, поскольку иммуноопосредованные НЯ могут стать проблемой, приводящей к отсрочке хирургического лечения. Немаловажно возможное гиперпрогрессирование, при котором происходит ускорение кинетики роста опухоли после воздействия анти-PD-1/L1-препаратов [13].
В настоящий момент проходит исследование II фазы, в котором пембролизумаб в неоадъювантном режиме вводят однократно в дозе 200 мг до операции пациентам с локализованной формой ПРГШ. Первичная конечная точка в данном исследовании: развитие местного рецидива в первый год наблюдения и появление отдаленных метастазов.
Предварительный анализ данного исследования обнаружил несколько важных результатов [29]:
- не было серьезных, связанных с препаратом НЯ или случаев отсрочки хирургического лечения;
- не выявлено случаев местного рецидива/появления отдаленных метастазов у первых 10 пациентов, наблюдавшихся более года после операции;
- частота выявления экстракапсулярного роста опухоли или положительного края резекции составила 38% (95% ДИ: 18–62; ожидаемая частота – 80%);
- от 43% пациентов (95% ДИ: 22–66) получен патоморфологический ответ на неоадъювантное введение пембролизумаба;
- отмечена корреляция между экспрессией PD-L1 на опухолевых клетках и частотой ответа опухоли на лечение (р=0,0005).
В данный момент проходит исследование, в котором иммунопрепараты в комбинации или в монорежиме используют при различных локализациях опухолей, в него включены пациенты с вирус-ассоциированным, в т.ч. ВПЧ-положительным, ПРГШ, получавшие ниволумаб в неоадъювантном режиме [30]. Из 29 зарегистрированных пациентов 12 имели ВПЧ-положительный статус и 17 ВПЧ-отрицательный. Медиана наблюдения составила 22 (ВПЧ+) и 12 недель (ВПЧ-). Это первое сообщение о глобальном испытании неоадъювантной анти-PD-1-терапии пациентов как с ВПЧ-положительном, так и с ВПЧ-отрицательным ПРГШ. Препарат приводил к уменьшению размеров опухоли в течение месяца почти у половины поддающихся оценке пациентов.
Предиктивные факторы
Определение прогностических биомаркеров важно для отбора пациентов, которые получат наибольшую пользу от применения иммунотерапии. На сегодняшний день не определены точные прогностические факторы ответа на иммунотерапию при ПРГШ. Один из возможных факторов – экспрессия PD-L1 на иммунных и опухолевых клетках (CPS). Это явление связано с иммуноактивным микроокружением опухоли, поэтому теоретически может быть сильным предиктивным фактором ответа на терапию [31].
В соответствии с высокой иммуногенностью ПРГШ экспрессия в опухолевой ткани PD-L1 наблюдается в 45–80% случаев [32]. В исследовании CheckMate 141 показана более высокая частота ОО при использовании монотерапии ниволумабом пациентов с высоким уровнем экспрессии PD-L1 на опухолевых клетках [21, 33].
В исследовании KEYNOTE-012 отмечена более высокая ОВ в группе пациентов с положительным CPS-статусом (22 против 4%; р=0,021) [14]. Клинические исследования, проводимые независимо от статуса PD-L1, демонстрируют противоречивые результаты, подчеркивая следующее: клинический ответ был отмечен среди пациентов с отрицательным статусом PD-L1, тогда как некоторые больные, у которых опухолевые клетки экспрессировали PD-L1, оставались невосприимчивыми к иммунотерапии. Поскольку не существует единого теста системы определения статуса PD-L1, должны быть установлены референсные значения для определения позитивности статуса. Широкое коммерческое предложение анти-PD-L1-антител и отсутствие технических стандартных процедур окрашивания препаратов и интерпретации данных представляют собой еще одно серьезное ограничение [34]. Необходимо точно знать, какие клеточные популяции, опухолевые или иммунные, экспрессируют PD-L1 [35]. PD-L1 экспрессируется не только макрофагами и опухолевыми клетками, но и фибробластами в опухолевой строме, и активированными Т-лимфоцитами [4, 8]. Предыдущие наблюдения показывают, что экспрессия PD-L1 как на опухолевых, так и на иммунных клетках служит более точным прогностическим фактором, чем экспрессия только на опухолевых клетках у пациентов с ПРГШ.
В то же время экспрессия PD-L2 и статус ВПЧ исследовались в качестве прогностических биомаркеров эффективности применения иммунотерапии в лечении р/мПРГШ. В исследовании KEYNOTE-012 у пациентов с положительной экспрессией PD-L2 имел место более высокий уровень ответов по сравнению с больными с отрицательной экспрессией PD-L2 (26,6 против 9,6%). В том же исследовании пациенты, у которых одновременно была положительная экспрессия PD-L1 и -L2, имели общий коэффициент ответа 27,5% [33, 36].
В 2015 г. T.Y. Seiwert et al. сообщили, что в когорте из 40 пациентов с ПРГШ, получавших пембролизумаб, наличие экспрессии гена IFNγ, определенной по выделенной РНК, характеризовало опухоли с более высоким уровнем ответа на лечение (около 35–40%). Эта корреляция между наличием экспрессии гена IFNγ и клиническим ответом была подтверждена среди независимых когорт и независимо от ВПЧ-статуса и статуса наличия вируса Эпштейна–Барр [37, 38].
Выводы
- Пембролизумаб, по данным исследований, обеспечил увеличение медианы ОВ у пациентов с р/мПРГШ как в первой линии терапии в комбинации с химиотерапией, так и во второй линии в монорежиме, что стало новым стандартом лечения данной группы пациентов.
- Ниволумаб увеличивает ОВ пациентов с р/мПРГШ, рефрактерных к стандартным режимам терапии, вне зависимости от уровня экспрессии PD-L1 и ВПЧ-статуса.
- Последние исследования иммунотерапии ингибиторами точек иммунного контроля подтверждают целесообразность данного подхода, основанного на значимо более высоких показателях контроля над опухолью и продолжительности жизни по сравнению со стандартными методами лечения пациентов с ПРГШ.


