Введение
Лекарственно-индуцированные заболевания (англ.: drug-induced diseases; ЛИЗ) – это вариант нежелательных лекарственных реакций, способных повышать смертность и/или заболеваемость и/или служат причиной возникновения симптомов, вынуждающих пациента обращаться за медицинской помощью или приводящих к госпитализации [1]. Актуальность проблемы обусловлена высокой распространенностью ЛИЗ, повышением риска госпитализаций, в т.ч. в отделения интенсивной терапии, и смертности, а также увеличением прямых и непрямых затрат на лечение [1–6]. Лекарственно-индуцированные симптомы, синдромы и заболевания весьма разнообразны, проявляются поражением всех без исключения органов и систем, поэтому встречаются в практике врачей всех специальностей. Однако их очень сложно диагностировать, поскольку они часто расцениваются как симптомы болезни (ей), имеющейся у пациента. Несмотря на эти объективные трудности, раннее выявление, коррекция и профилактика ЛИЗ будут способствовать снижению заболеваемости и смертности, поэтому данная проблема имеет чрезвычайно важное значение.
Чтобы гарантировать, что ЛИЗ у пациента не останется нераспознанным и возникшие у него симптомы не объясняются другой причиной, клиницисты должны иметь повышенную настороженность в отношении развития нежелательных побочных реакций (НПР) практически всегда, когда больной получает медикаментозную терапию.
В тех случаях, когда у пациента появляется новый симптом или ранее существовавший симптом усилился или изменился с течением времени, лечащий врач должен по крайней мере рассматривать вариант, по которому причиной может быть принимаемое пациентом лекарственное средство (ЛС). Поэтому каждый препарат, который больной получает в настоящее время или принимал недавно, следует рассматривать как возможную причину ухудшения его состояния [1]. В некоторых ситуациях с некоторыми ЛС и типами лекарственных реакций причинно-следственную связь между приемом препарата и развитием НПР выявить легче, с другими – намного сложнее [1, 2].
Существуют определенные подходы к ведению больных, позволяющие повышать эффективность диагностики и профилактики ЛИЗ [1, 2]. Главным из них считают правильность сбора фармакологического анамнеза [1, 2].
Диагностика
Самым важным источником информации выявления возможного ЛИЗ является история болезни [1]. Тщательно заполненная история болезни может содержать много важной информации, которая поможет клиницисту заподозрить наличие или, наоборот, исключить ЛИЗ. Однако следует помнить, что информация, которая составляет фармакологический анамнез, должна аккумулироваться из разных источников: данные, полученные от пациента, его родственников или опекуна, лица, осуществляющего уход за больным; осмотр контейнеров с ЛС, блистеров, упаковок препаратов; различная медицинская документация (выписки, заключения консультаций узких специалистов; результаты лабораторных и инструментальных исследований и т. п.) и др.

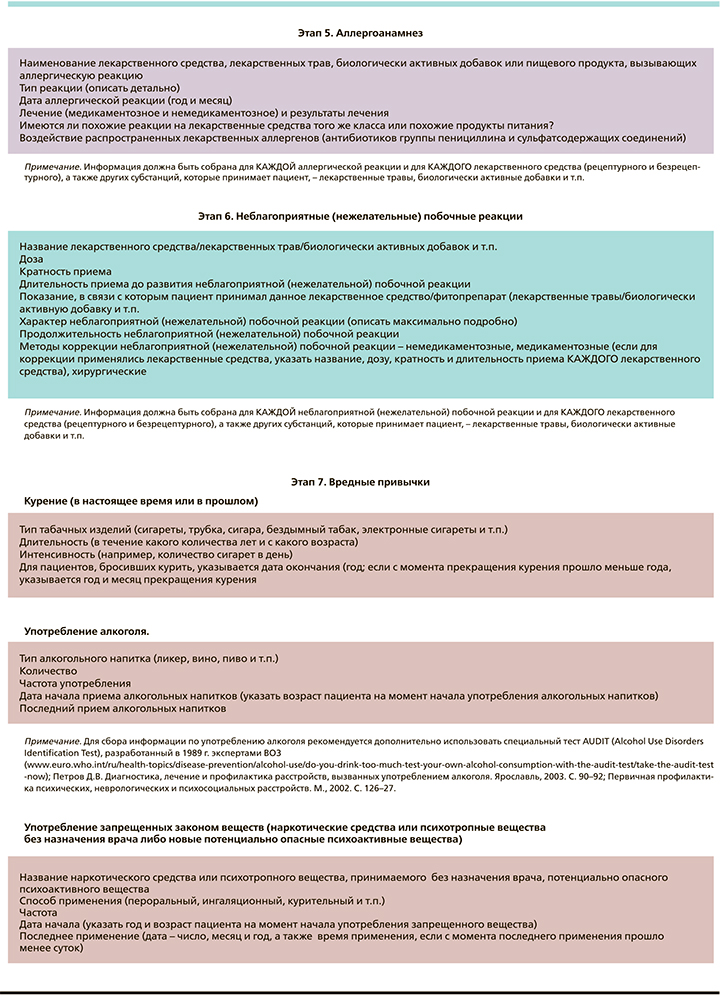
Информация, которая должна быть обязательно отражена в истории болезни, весьма обширна, она должна состоять из нескольких разделов – см. алгоритм на рисунке [1, 2, 7]. Прежде всего это паспортные и демографические данные пациента: его возраст (дата рождения), пол, рост, вес, индекс массы тела, расовая принадлежность. Диагноз должен быть сформулирован максимально полно, особенно в отношении сопутствующих заболеваний. В обязательном порядке должна быть внесена информация о каждом ЛС, которое пациент принимает в настоящее время, рецептурном или безрецептурном, а также о витаминах, лекарственных травах, биологически активных добавках и т.п. Аналогичная подробная информация должна быть собрана и отражена в истории болезни обо всех рецептурных и безрецептурных препаратах, принятых пациентом в течение предшествовавших 6 месяцев, включая те, которые он уже в настоящий момент не принимает (см. рисунок). Информация о каждом препарате, как рецептурном, так и безрецептурном, должна включать название ЛС, показание (я) к его назначению данному пациенту, эффективность, указание на лекарственную форму (таблетка, капсула, пролонгированное высвобождение и др.), дозу, способ (ы) введения, кратность приема, начало терапии ЛС, дату и время приема последней дозы, а также указание на то, где эти ЛС закупались. Необходимо поинтересоваться о приблизительных ежемесячных расходах пациента на ЛС из собственных средств. Следует уточнить: не создает ли покупка ЛС финансовых проблем пациенту или его семье [1, 7]?
Очень важен тщательный сбор аллергоанамнеза (см. рисунок), который должен включать наименование ЛС (лекарственных трав, биологически активных добавок и т.п.) или пищевых продуктов, вызывающих аллергическую реакцию, максимально детально описать каждую аллергическую реакцию, указать ее дату, способы коррекции. В обязательном порядке следует поинтересоваться о наличии сходных реакций на ЛС той же группы или похожие продукты, а также прицельно расспросить пациента о его реакции на прием наиболее распространенных лекарственных аллергенов (антибиотики группы пенициллина, препараты, содержащих сульфонамидную группу) [1, 2, 7].
Один из ключевых разделов фармакологического анамнеза – это раздел по НПР [1, 2, 7]. Необходимо тщательно собрать всю доступную информацию о всех НПР, которые имели место у данного больного. О каждой НПР необходимо иметь следующие данные: название ЛС, его доза, частота приема, в связи с чем пациент принимал это ЛС, подробное описание нежелательной лекарственной реакции, какие меры были приняты для ее купирования (например, отмена препарата, снижение его дозы; были ли назначены в связи с развитием НПР другие ЛС для ее коррекции, если да, то какие именно, их дозы, кратность приема, способы введения, длительность приема; подробно перечислить немедикаментозные меры для коррекции возникшей НПР, а также хирургические вмешательства, если таковые имели место) [1, 2, 7].
Также необходимой является информация о вредных привычках: статус курения в настоящее время и/или в прошлом (указывается тип табачных изделий, количество, стаж курения: если пациент бросил курить, фиксируется дата прекращения курения), употребление алкогольных напитков (тип напитка, количество употребляемого алкоголя и частота употребления, дата последнего приема алкогольных напитков), а также наркотических средств или психотропных веществ, которые пациент применяет без назначения врача, либо новых потенциально опасных психоактивных веществ (указываются название вещества/препарата, способ применения, частота приема, дата начала применения и дата последнего приема) [1, 7]. Для сбора информации по употреблению алкоголя можно рекомендовать дополнительно использовать специальный тест AUDIT (Alcohol Use Disorders Identification Test), разработанный в 1989 г. экспертами ВОЗ [8–10]. Тест содержит серию из 10 вопросов: 3 вопроса по потреблению, 4 – по зависимости и 3 вопроса по проблемам, связанным с употреблением алкоголя [8–10]. Сумма баллов ≥8 считается показателем опасного или вредного употребления алкоголя [8].
Точность и детальность сбора анамнеза о приеме ЛС в том случае, когда врач подозревает развитие ЛИЗ, очень важны. Для повышения качества сбора такой информации сформулирован ряд предложений [1]. Перед сбором анамнеза следует внимательно изучить историю болезни пациента и всю другую доступную медицинскую информацию – это позволит повысить информативность опроса пациента. По возможности необходимо проводить опрос в удобное для врача и пациента время, в приватной обстановке, ни врач, ни пациент не должны торопиться. Врачу рекомендуется поддерживать зрительный контакт с пациентом, быть вежливым, дружелюбным и беспристрастным. J.E. Tisdale и D.A. Miller [1] рекомендуют отдавать предпочтение т.н. открытым вопросам и избегать закрытых (например: что Вы принимаете от головных болей, вместо Вы принимаете что-нибудь от головных болей?). Следует прицельно расспросить пациентов о ЛС, которые он принимает не перорально (например: Вы используете глазные капли?), поскольку пациенты обычно забывают или не считают нужным/важным сообщать врачу о кремах, мазях, пластырях, глазных или ушных каплях, ингаляторах и настоях. Следует задать прямые вопросы о ЛС, которые пациент принимает для лечения конкретных заболеваний, записанных в его диагнозе (например: что Вы принимаете в связи с Вашей глаукомой?), и прицельно расспросить о тех ЛС, которые пациенту мог назначить узкий специалист, у которого он наблюдается/может наблюдаться в связи с наличием определенных диагнозов (например: Вы были у уролога? Какие препараты он Вам назначил?). Также в обязательном порядке следует уточнить: как давно врач назначил тот или иной препарат, отменял ли он какие-то другие препараты, изменял ли их дозы [1, 7]?
Как уже говорилось выше, необходимо собирать информацию обо всех отпускаемых без рецепта ЛС, витаминах, лекарственных травах, биологически активных добавках [1, 2, 7]. При опросе пациента в отношении безрецептурных ЛС J.E. Tisdale и D.A. Miller [1] рекомендуют использовать дополнительные подсказки (например: что Вы принимаете от головной боли, простуды, аллергии, кашля, бессонницы, изжоги, расстройств желудка и кишечника, запора, поноса, болей в мышцах, суставах и т.п.?).
Цель расспроса пациента о принимаемых им ЛС состоит в том, чтобы определить, как на самом деле было использовано лекарство, а не как оно было назначено. Точная информация о начале приема ЛС, о том, когда была принята последняя доза, имеет решающее значение для оценки наличия возможного ЛИЗ. В ряде случаев для решения этого вопроса важно знать не только об ЛС, принимаемых в настоящее время, но и об ЛС, принятых ранее, и их прием был недавно прекращен [1, 2].
Также важно тщательно собрать всю информацию о данном симптоме/синдроме/заболевании, лекарственно-индуцированных характер которых подозревает врач [1, 2, 7]. Что конкретно заметил пациент и когда это началось? Как симптом (ы) прогрессировал (и)? Существовала ли временная связь между появлением симптомов и необходимостью или, наоборот, невозможностью принимать какие-либо ЛС; если да, то имеются ли сведения в инструкции по медицинскому применению ЛС или в медицинской литературе о подобной реакции данного конкретного препарата или других ЛС из той же фармакологической группы? Испытывал ли пациент подобные реакции в процессе лечения в прошлом? С чем еще помимо ЛС, по мнению пациента, могло быть связано появление возникшей проблемы? Пытался ли пациент заниматься самолечением, чтобы устранить возникшую реакцию? Если да, то какие лечебные мероприятия им были испробованы и были ли они эффективными? По мнению пациента, какие процедуры или мероприятия приводили к улучшению, а какие к ухудшению возникшей проблемы [1, 7]?
Важнейшая информация может быть получена благодаря тщательно проведенному физикальному обследованию с особым акцентом на те органы и системы органов, со стороны которых имеются соответствующие симптомы [1, 7]. Также необходима обязательная оценка данных лабораторных исследований: они могут предоставить объективную информацию, полезную в определении наличия/отсутствия ЛИЗ. В зависимости от типа реакции и вовлеченной системы (систем) органов необходима оценка: функции почек (азот мочевины крови, креатинин с расчетом скорости клубочковой фильтрации и клиренса креатинина), функции печени (аланинаминотрансфераза, аспартатаминотрансфераза, щелочная фосфатаза, γ-глутамилтранспептидаза, общий и прямой билирубин, общий белок, альбумин, международное нормализованное отношение), показателей общего (клинического) анализа крови, анализа мочи [1]. В ряде случаев необходимо, если это возможно, определение концентрации препарата в сыворотке крови (и, где это уместно, метаболитов) [1, 2]. В некоторых ситуациях могут быть полезными специальные лабораторные тесты (например, антинуклеарные антитела, определение концентрации сывороточных иммуноглобулинов различных классов [IgG, IgA и IgM], иммунохимическое определение концентрации компонентов комплемента, определение активности комплемента и его компонентов, проведение кожных тестов гиперчувствительности замедленного типа и др.) [1, 2]. Оценка результатов неинвазивных и по показаниям инвазивных инструментальных методов также необходима для объективизации наличия лекарственно-индуцированных симптомов/заболеваний, например ЭКГ, рентгенографии органов грудной клетки, компьютерной томографии, биопсии почки или легкого [1]. Определенные данные, полученные в ходе проведения физикального осмотра, лабораторных и инструментальных методов исследования, очень важны и для дифференциальной диагностики ЛИЗ с другими заболеваниями различных органов и систем [1].
Также данные анамнеза и физикального обследования больного должны быть тщательно проанализированы в контексте выявления факторов риска ЛИЗ в целом, а также конкретного подозреваемого лекарственно-индуцированного симптома/синдрома/заболеваний и конкретных возможных препаратов-индукторов [1]. К общим факторам риска развития ЛИЗ относят возраст (пожилой и старческий, детский), женский пол, расу, генетические особенности, беременность, наличие коморбидных заболеваний, полипрагмазию, межлекарственные взаимодействия, взаимодействие ЛС с пищевыми продуктами и биологически активными добавками, курение, употребление алкоголя и наркотических веществ, прием ЛС в отсутствие назначений врача, низкую приверженность терапии, ошибки в назначении ЛС и их производстве [1].
Дифференциальная диагностика
Как только субъективная и объективная информация относительно подозреваемого ЛИЗ собрана в полном объеме, все известные НПР каждого лекарственного препарата, который принимает или недавно принимал пациент, должны быть оценены на предмет того, имеется ли в данной клинической ситуации явный препарат-индуктор развившейся НПР [1, 2]? Способность вызывать ЛИЗ некоторыми ЛС хорошо известна, однако даже в том случае, когда такие данные отсутствуют полностью, следует понимать, что этот клинический случай может оказаться первым, такую вероятность никогда нельзя полностью исключать [1].
Определение возможной причинно-следственной связи между приемом ЛС и развитием НПР служит, с одной стороны, главной, с другой – наиболее трудной задачей диагностики/дифференциальной диагностики ЛИЗ. В настоящее время используется несколько подходов к оценке причинно-следственной связи между приемом ЛС и развитием какого-либо неблагоприятного симптома, синдрома или заболевания [1, 2, 11, 12].
J.E. Tisdale и D.A. Miller [1] в своей монографии классифицируют доказательства причинно-следственной связи между приемом ЛС и развитием лекарственно-индуцированного синдрома/заболевания на три уровня:
А, В или С:
- А – это уровень, указывающий на наличие причинно-следственной связи, основываясь на результатах одного или нескольких рандомизированных контролируемых клинических исследований;
- B – это уровень, указывающий на наличие причинно-следственной связи, основываясь на результатах проспективных и ретроспективных наблюдательных исследований, когортных исследований, исследований типа «случай–контроль», мета-анализов и/или постмаркетинговых наблюдательных исследований;
- С – это уровень, указывающий на наличие в литературе одной или несколько публикаций с описанием клинического случая или серии случаев, когда использование данного ЛС вызывало специфическую реакцию в виде определенного лекарственно-индуцированного симптома, синдрома или заболевания. Хотя в таких публикациях могут отсутствовать прямые доказательства причинно-следственной связи, эти отчеты очень важны для понимания возможных побочных эффектов ЛС.
Система Центра мониторинга ВОЗ в Упсале (Uppsala Monitoring Centre, UMC), Швеция, на основе определенных выявленных характеристик рекомендует врачу классифицировать НПР на шесть категорий (табл. 1) [11].

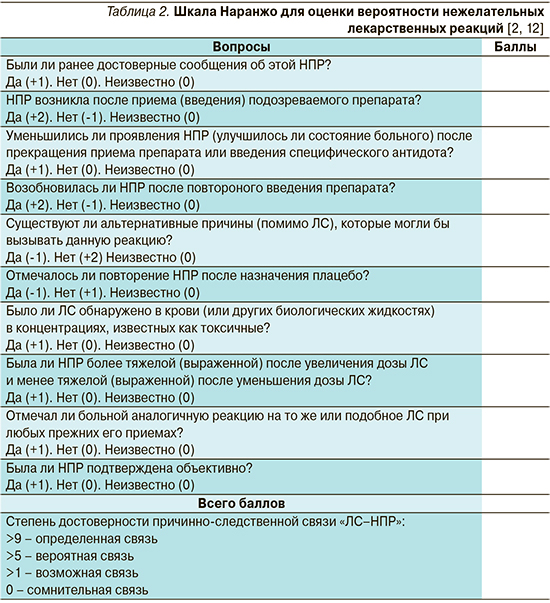
Очень часто в клинической практике для определения причинно-следственной связи между приемом ЛС и развитием НПР используется алгоритм (шкала) Наранжо (табл. 2) [1, 2, 12]. Данная шкала содержит ряд вопросов, за каждый ответ присваивается конкретное количество баллов, которые впоследствии суммируются. Безусловно, как и все другие методы, этот имеет определенные ограничения. Так, чтобы набрать баллы за каждый вопрос по шкале Наранжо, дозу подозреваемого в развитии НПР ЛС нужно было бы увеличивать или уменьшать, чтобы увидеть, усугубилась ли НПР или, наоборот, уменьшилась/разрешилась, также требуется прекращение приема препарата, чтобы увидеть, уменьшается ли реакция, а затем необходимо назначить его повторно, чтобы оценить, возникла ли нежелательная лекарственная реакция вновь, затем пациент должен был получить плацебо, а врач оценить, появилась ли подобная реакция на фоне его приема [1, 2]. Такие «маневры» в реальной клинической практике редко можно применять, прежде всего по этическим соображениям. В результате лишь немногие НПР по шкале Наранжо могут быть классифицированы как определенные или сомнительные, большинство из них классифицируются где-то между этими двумя крайними вариантами, т.е. как вероятные или возможные [1, 2].
В том случае, если степень достоверности причинно-следственной связи «ЛС–НПР» расценены как «возможная», «вероятная» или «определенная», подозреваемый препарат может быть причиной развития лекарственно-индуцированного симптома/синдрома/заболевания [1, 2], и в этом случае практикующий врач должен решить очень сложную задачу: стоит ли продолжить терапию этим ЛС или необходима его отмена (замена на другое ЛС)? Как и во всем, что касается фармакотерапии, в такой ситуации должны быть тщательно взвешены относительные риски и польза каждой из этих стратегий [1, 2]. В некоторых случаях хорошим вариантом может быть замена ЛС-индуктора на другое ЛС, с меньшей вероятностью вызывающее данное ЛИЗ. Когда неблагоприятное действие препарата ассоциировано с дозой ЛС или с его концентрацией в сыворотке, необходимо снижение дозы и/или изменение кратности приема ЛС. Хотя, как правило, назначение другого препарата для лечения побочного действия первого ЛС не приветствуется, бывают клинические ситуации, когда такой подход абсолютно приемлем (например, назначение специальных препаратов для лечения возникших на фоне химиотерапии тошноты и рвоты) [1, 2].
Бывают ситуации, когда при развитии ЛИЗ имеются подозрения в отношении двух и даже более ЛС, такие ситуации являются еще большей проблемой для практикующего врача.
В некоторых случаях возникает необходимость отменить все возможные препараты, которые могли инициировать НПР, а затем повторно назначить их по одному до момента проявления лекарственно-индуцированной реакции [1, 2]. В любом случае необходимо использовать классификацию ВОЗ–UMC [11] и/или шкалу Наранжо [12] для оценки уровня доказательств о причинно-следственной связи каждого из возможных препаратов – индукторов НПР и ассоциированных с их приемом реакций (например, 2 описания клинических случаев данного ЛИЗ на фоне приема одного препарата против 20 случаев этого ЛИЗ для другого препарата в сочетании с доказательствами причинно-следственной связи в одном или нескольких рандомизированных контролируемых клинических исследованиях). Такой подход в ряде случаев может существенно помочь в решении вопроса относительно того, какой препарат служит наиболее вероятной причиной развития ЛИЗ [1, 2].
Общие подходы к коррекции НПР и ЛИЗ
НПР типа А, предсказуемые, – это реакции как результат фармакологического действия ЛС, т.е. его фармакодинамики [1, 2]. Такие НПР представлены в соответствующем разделе инструкции к препарату и имеют дозозависимый характер. При развитии НПР типа А лечащему врачу необходимо [2] оценить ее тяжесть и причинно-следственную связь с приемом ЛС (подробно изложено выше), убедиться в том, что пациент принимал именно назначенный препарат и в назначенной врачом дозе. При развитии серьезных НПР необходимо отменить препарат(ы), кроме тех случаев, когда он (они) назначен по жизненным показаниям и не имеет (ют) альтернативы, а при развитии несерьезных НПР – снизить дозу препарата (ов), а также назначить другие лечебные мероприятия, в т.ч. в ряде случаев и ЛС для купирования симптомов НПР [2].
НПР типа В, непредсказуемые, – это реакции чаще всего аллергической (иммунологической) природы, которые проявляются независимо от дозы препарата, чаще всего они представляют собой лекарственную аллергию [1, 2]. Необходимо помнить, что НПР типа В может развиваться в ответ не только на фармакологически активную субстанцию, но и на вспомогательные компоненты (чаще всего красители) [2]. Коррекция НПР типа В заключается в немедленной отмене препарата, при необходимости в зависимости от степени тяжести НПР типа В следует назначать глюкокортикостероиды, адреналин, антигистаминные препараты (дозы этих ЛС и длительность терапии также зависят от тяжести НПР), а также симптоматическую терапию [2]. В определенных клинических ситуациях необходимо проводить комплекс мероприятий, направленных на замедление всасывания препарата: сорбенты, очистительные клизмы, обкалывание места инъекции раствором адреналина и др. [2].
Общие подходы к профилактике НПР и ЛИЗ
Профилактика НПР
Профилактика НПР типа А. Главным методом профилактики НПР типа А является употребление препарата в стогом соответствии с инструкцией по его медицинскому применению [2]. Перед назначением любого препарата необходимо стратифицировать риск развития всех его потенциальных НПР, и с этой целью следует проводить тщательный сбор фармакологического анамнеза (см. рисунок), оценить наличие у пациента факторов риска развития НПР на фоне приема данного препарата, функцию почек, печени и других элиминирующих органов, фармакологические свойства ЛС (прогнозируемые НПР, широта терапевтического диапазона и др.), сопутствующую медикаментозную терапию на предмет возможности развития межлекарственного взаимодействия. В отдельных случаях необходимо рассмотреть целесообразность и возможность проведения фармакогенетического исследования [2].
Профилактика НПР типа В. Профилактика НПР типа В, в связи с тем что они непредсказуемы, намного сложнее профилактики НПР типа А. В таких случаях необходим целый комплекс профилактических мероприятий [2]. Во-первых, следует тщательно собрать как фармакологический, так и аллергологический анамнез (см. рисунок) для выявления наличия у пациента и его родственников аллергических заболеваний и степени их тяжести, а также наличия у них аллергических реакций на ЛС, химические вещества, лекарственные растения, пищевые продукты с оценкой степени тяжести этих реакций [2]. Следует оценить наличие иммуногенных (аллергогенных) свойств препарата и вспомогательных компонентов (особенно красителей) [2]. Как известно, высокая степень иммуногенности (аллергогенности) характерна для β-лактамных антибиотиков, препаратов, содержащих сульфонамидную группу, белковых препаратов, нестероидных противовоспалительных средств, ЛС группы местных анестетиков, фитопрепаратов. При подозрении на лекарственную аллергию, особенно у больных с высоким риском ее развития (наличие в анамнезе аллергических реакций на схожие по химическому строению ЛС, наличие т.н. атопических заболеваний) целесообразно проведение ряда диагностических тестов [2]: определение IgE к ЛС (методика разработана для β-лактамных антибиотиков, местных анестетиков, некоторых нестероидных противовоспалительных препаратов) и/или на базофилах и/или прямое определение IgE (иммуноферментный анализ); определение IgG, принимающих участие в иммунокомплексных реакциях и/или IgG, реагирующих с нейтрофилами и принимающих участие в реакциях антителозависимой клеточной цитотоксичности. Также имеется ряд тестов, проводимых in vitro (например, реакции дегрануляции тучных клеток, бласттрансформации лейкоцитов, агломерации лейкоцитов, тест торможения естественной миграции лейкоцитов, реакция роезткообразования) и in vivo (например, кожные и внутрикожные пробы и др., представляющие собой оценку изменений при местном воздействии малых доз подозреваемых ЛС – покраснение, отек кожи и слизистых оболочек) [2]. Однако следует помнить, что данные методики не являются высокочувствительными и специфичными, а тесты in vivo потенциально опасны, вплоть до развития летального исхода. Поэтому они противопоказаны детям и их проводят только в условиях специализированных аллергологических отделений медицинских учреждений [2].
Доказанная аллергическая реакция на ЛС служит противопоказанием к его назначению, а также всех «родственных», сходных по химическому строению лекарственных препаратов [2]. Соблюдение данного правила служит лучшей стратегией профилактики НПР типа В [2]. Эффективность назначения противоаллергических препаратов для профилактики лекарственной аллергии в настоящее время не доказана [2].
Обучение пациентов
Обучение пациентов и надлежащим образом оформленная вся медицинская документация – необходимые условия профилактики развития НПР или ЛИЗ [1]. Пациенту следует знать реакцию, которая произошла, название активного вещества и торговое наименование препарата, наименование активных веществ и торговые названия любых других ЛС, на фоне приема которых могут возникать аналогичные реакции; он должен быть осведомлен, имеется ли возможность в связи с наличием его основного заболевания или сопутствующих заболеваний в будущем полностью избегать использования таких ЛС, если же он будет пробовать их принимать, то делать это надо с большой осторожностью, начиная с минимальных доз и очень медленно их титруя [1]. В идеале пациентам необходимо предоставить список всего класса ЛС (например, ингибиторы ангиотензинпревращающего фермента, сульфосодержащие соединения, бензодиазепины), наименования активных веществ и торговых названий ЛС, входящих в этот класс, в письменной форме. Пациента следует предупредить, чтобы при посещении других медицинских учреждений и врачей других специальностей (например, стоматолога) он в обязательном порядке предоставлял всю информацию о наличии у него НПР на прием определенных препаратов. Подробное описание НПР должно быть в обязательном порядке включено не только в историю болезни, но и хотя бы в кратком виде должно присутствовать в другой медицинской документации, например в выписном эпикризе, в направлениях на консультацию к узкому специалисту или на дополнительное обследование [1].
Отчетность при ЛИЗ: cхема информирования о развитии НПР
Правильная отчетность также очень важна для предотвращения ЛИЗ у других людей, которые будут принимать этот препарат (ы) в будущем. Информация о многих побочных эффектах ЛС и связанных с ними ЛИЗ была собрана в полном объеме, хорошо задокументирована, и во многом именно благодаря этим мерам данные НПР и ЛИЗ хорошо известны медицинским работникам. Поэтому их в ряде случаев можно предотвратить с помощью более осторожных подходов к назначению ЛС (начало терапии с минимальных доз или даже с 1/2 или 1/4 минимальной дозы, более медленная титрация, применение специальных немедикаментозных и медикаментозных профилактических мер и т.д.) и/или наблюдения за пациентами. Однако некоторые НПР и ЛИЗ еще в полной мере не проявились, не описаны и поэтому не признаны, на сегодняшний день их нельзя предотвратить. Идентифицировать и описать эти лекарственно-индуцированные симптомы и синдромы необходимо в первую очередь для увеличения вероятности их успешной профилактики в будущем.
Эта важнейшая медицинская и социальная задача лежит в основе создания специальных программ по предоставлению информации о нежелательных лекарственных реакциях. В США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (Food and Drug Administration – FDA) в 1993 г. разработало и внедрило специальную программу MedWatch (FDA’s MedWatch) по предоставлению информации о безопасности ЛС, для сообщений о нежелательных явлениях со стороны медицинских работников и пациентов [13]. Система собирает т.н. спонтанные сообщения о возникновении НПР, связанных с ЛС, как рецептурными, так и безрецептурными биопрепаратами, устройствами/приборами и нутрицевтиками, включая пищевые добавки, медицинские продукты и детские смеси [1]. Сообщения о неблагоприятных реакциях, ассоциированных с использованием вакцин, поступают в FDA через другую специальную систему сообщений о побочных эффектах вакцин (VAERS) [1]. Спонтанное сообщение – это описание неблагоприятного события, которое произошло во время ведения пациента. В США подозрение, что средство для медицинского применения может быть взаимосвязано с развитием НПР, служит достаточным основанием для предоставления спонтанного сообщения, при этом доказательства наличия причинно-следственной связи не нужны [1]. Отчеты можно подавать онлайн, по бесплатному телефону, по факсу или по почте. Основные элементы карты-извещения включают имя и фамилию человека (медицинского работника или пациента), кто предоставляет сообщение, подозреваемый препарат или устройство, описательный отчет о неблагоприятном событии или проблеме и информацию о пациенте (идентификатор, пол, возраст и вес) [1]. После поступления в FDA отчеты о неблагоприятных событиях вводятся в специальную базу данных постмаркетингового надзора, благодаря чему может быть произведена проверка на наличие аналогичных сообщений и в случае положительного результата может быть сформирован отчет о серии случаев. Когда благодаря сообщению или серии сообщений выявляется ранее не известная проблема безопасности применения ЛС, FDA может потребовать изменения маркировки, наложить ограничения на назначение или дозирование ЛС и при необходимости изъять препарат с рынка [1].
Медицинские работники могут получать информацию, собранную в рамках программы FDA MedWatch, зайдя на их сайт. Информация также распространяется по электронной почте среди тех работников сферы здравоохранения, кто подписан на такую рассылку, и через массу профессиональных организаций, сотрудничающих с FDA с этой целью [1].
В РФ для формирования спонтанных сообщений о НПР существует специальная законодательная база: в cтатье 64 Федерального закона о ЛС говорится, что субъекты обращения ЛС обязаны предоставлять сведения об НПР соответствующему органу исполнительной власти [2, 14]. Если врач выявил НПР, расценил причинно-следственную связь между ней и подозреваемым ЛС как определенную или вероятную, в первую очередь он должен обратиться к специальному уполномоченному лицу по мониторингу безопасности ЛС отделения, назначенного приказом руководителя медицинского учреждения [2]. Тот в свою очередь передает информацию уполномоченному по мониторингу безопасности ЛС медицинского учреждения (также назначается приказом его руководителя), обычно это либо заместитель главного врача по лечебной работе, либо врач-клинический фармаколог. Далее уполномоченный по мониторингу безопасности ЛС отделения заполняет карту-извещение (форма имеется на сайте Росздравнадзора) о данной НПР и передает ее по электронной почте в соответствующий Региональный центр мониторинга безопасности ЛС, в котором информация из этой карты вносится в специальную базу Роспотребнадзора [2]. Также возможно электронное заполнение карты-извещения в он-лайн-режиме. Росздравнадзор осуществляет анализ всей имеющейся в базе информации о НПР и на основании результатов анализа обращается в случае необходимости в Минздрав России с предложениями об отмене регистрации, запрете на использование партии ЛС, внесении изменений в инструкцию по медицинскому применению и т.д. [2].
Отличия российской системы оповещения о НПР от американской состоят в том, что в США врач сам заполняет карту-извещение и сам сообщает об НПР напрямую в регуляторный орган (FDA), могут это сделать и непосредственно пациенты, а в РФ данную информацию могут передать только уполномоченные по мониторингу безопасности ЛС медицинской организации и некоторые другие специалисты (на основании письма от администрации медицинского учреждения руководству Роспотребнадзора) [2].
Не все НПР требуют оповещения. В РФ, согласно приказу Федеральной службы по надзору в сфере здравоохранения «Об утверждении порядка осуществления фармаконадзора» от 15.02.2017 № 1071, извещения об НПР следует заполнять и отсылать в центры по мониторингу безопасности ЛС в тех случаях, когда имеют место серьезные нежелательные реакции на ЛС; отсутствует эффективность ЛС, кроме случаев, когда отсутствие клинического эффекта вызвано спецификой заболевания и/или индивидуальными особенностями пациента; имеет место случай передачи инфекционного заболевания через лекарственный препарат; нежелательная реакция возникла вследствие злоупотребления препаратом, умышленной передозировки ЛС и т.п.; имеют место непредвиденные нежелательные реакции ЛС; имеется индивидуальная непереносимость ЛС; о всех НПР новых ЛС (в течение 5 лет после регистрации); имеются особенности взаимодействия лекарственного препарата с другими ЛС [2, 15]. Более подробно система фармаконадзора в РФ и в других странах рассмотрена ниже.
Фармаконадзор
Серьезные, иногда фатальные летальные осложнения фармакотерапии подтолкнули медицинское сообщество к пониманию того, что субстанции, при стандартных испытаниях на животных выглядящие почти безвредными, могут впоследствии при их применении к людям приводить к тяжелым осложнениям, поэтому стала очевидной необходимость организации глобальной системы, которая бы позволила эффективно отслеживать осложнения фармакотерапии и при необходимости применять рекомендательные или административные меры. В 1968 г. на основе Резолюции Всемирной ассамблеи здравоохранения (WHA 20.51) от 1967 г. была создана Программа ВОЗ по мониторингу безопасности ЛС. Через 10 лет, в 1978 г., Сотрудничающий центр ВОЗ по мониторингу безопасности ЛС был открыт в городе Уппсала, Швеция (WHO-UMC), функция которого заключается в сборе, систематизации и анализе сведений о безопасности ЛС со всего мира путем внесения их в базу данных НПР VigiBase [16, 17]. Доступ к информации из VigiBase в ограниченной форме можно получать, перейдя по ссылке http://www.vigiaccess.org [18].
Задачи глобальной системы мониторинга ЛС [16, 17]:
- выявление ранее не известных данных о безопасности ЛС;
- выявление новых данных о ЛС с изученными профилями безопасности, например увеличение числа сообщений об уже известной НПР на ЛС относительно ожидаемого уровня;
- анализ полученной информации о безопасности ЛС;
- информирование участников Программы ВОЗ по мониторингу безопасности ЛС о полученных в процессе деятельности данных;
- методическое сопровождение Фармаконадзора;
- обучение субъектов обращения ЛС.
В настоящее время в РФ широко используется термин «фармаконадзор» (англ. pharmacovigilance) [2]. Интересно отметить, что термин «pharmacovigilance» состоит из двух частей: «pharmaco-» (от лат. «pharmaco» – яд, лекарство) и «vigilance» (англ. «бдительность»), следовательно, правильнее было бы перевести термин как «фармакобдительность», однако в России прижился именно термин «фармаконадзор», который несет более жесткую и даже в какой-то степени авторитарную семантику. Что такое «фармаконадзор» и ограничивается ли он только мониторингом НПР? Существует масса определений и трактовок этого термина, однако остановимся на трех наиболее актуальных для жителей Российской Федерации:
- Фармаконадзор – наука и деятельность, направленные на выявление, оценку, понимание и предупреждение нежелательных эффектов или любых иных возможных проблем, связанных с ЛС [16, 17].
- Фармаконадзор – вид деятельности, направленной на выявление, оценку, понимание и предотвращение нежелательных последствий применения ЛС [19].
- Фармаконадзор – вид деятельности по мониторингу эффективности и безопасности ЛС, направленный на выявление, оценку и предотвращение нежелательных последствий их применения [20].
Все три определения различаются широтой охвата задач и проблем, решаемых в рамках фармаконадзора, но все они неизменно касаются безопасности ЛС.
Функционирует глобальная система фармаконадзора следующим образом: в каждой стране – участнице Программы ВОЗ по мониторингу ЛС создается национальный центр, отвечающий за создание и функционирование системы фармаконадзора внутри каждой конкретной страны. Он берет на себя обязательство регулярно, не реже 1 раза в квартал, направлять сообщения о безопасности ЛС в международную базу данных VigiBase, что необходимо для функционирования глобальной системы в целом.
Рассмотрим на примерах нескольких стран, как организованы национальные системы фармаконадзора.
Соединенные Штаты Америки (США). США были первой страной, официально создавшей организацию по изучению побочных эффектов ЛС на своей территории еще в 1952 г. (Департамент по изучению дискразий крови). Затем в 1960 г. Агентство по контролю за пищевыми продуктами и лекарственными средствами США (US FDA) утвердило и спонсировало программу по мониторингу НПР и сбору сообщений о них в лечебно-профилактических учреждениях [21]. Надо отметить, что США внесли значительный вклад в становление, развитие и функционирование глобальной системы фармаконадзора, являясь одной из 10 стран (Австралия, Великобритания, Канада, Новая Зеландия, Ирландия, Нидерланды, США, ФРГ, Чехословакия, Швеция), первыми присоединившимися к Программе ВОЗ по мониторингу безопасности ЛС [21]. В настоящий момент эта страна занимает одну из лидирующих позиций в аспекте эффективности функционирования фармакондазора: более половины сообщений о НПР в VigiBase присланы из США [17, 18]. Национальный центр фармакондазора: US FDA [22].
Великобритания. Великобритания, как и США, была одной из первых стран, присоединившейся к Программе ВОЗ по мониторингу ЛС.
В 1963 г. при Министерстве здравоохранения Соединенного Королевства был учрежден Комитет по безопасности ЛС. Эта страна является родоначальницей метода спонтанных сообщений – основного метода сбора информации о безопасности ЛС в настоящее время. В 1964 г. была начата «программа желтых карт», которая получила свое название по характерному цвету формы-извещения о НПР [21]. Национальный центр фармаконадзора: Medicines and Healthcare products Regulatory Agency (MHRA) [23].
Европейский Союз (ЕС). В декабре 2010 г. в ЕС вступило в силу новое законодательство в области фармаконадзора (Regulation (EU) № 1235/2010 and Directive 2010/84/EU), согласно ему в ЕС формируется регуляторная сеть, участниками которой являются держатели регистрационных удостоверений, национальные центры стран – членов ЕС, Европейская комиссия и Европейское агентство по ЛС (European Medicines Agency, ЕМА) – координатор функционирования всей системы. Ключевым подразделением внутри ЕМА является Комитет по оценке рисков в области фармаконадзора (The Pharmacovigilance Risk Assessment Committee, PRAC). Ключевым пакетом документов данного законодательства являются Правила надлежащей практики фармаконадзора, разработанные комиссией экспертов ЕМА и стран – членов ЕС для обеспечения функционирования системы фармаконадзора на территории ЕС. До 2010 г. каждая страна, которая на момент подготовки материала входила в состав ЕС, имела свою систему фармаконадзора, национальный центр, методы сбора, систематизации и анализа информации о безопасности ЛС [24, 25].
За рубежом в некоторых странах, например, таких как Австралия, Канада, Дания, Нидерланды, Швеция, Великобритания, США, потребители также могут сообщать о развитии в них НПР при применении ЛС. Более того, это активно поощряется, т.к. подобные сообщения по качество мало уступают (а иногда и превосходят) сообщениям, полученным от специалистов практического здравоохранения и позволяют оперативно выявлять проблемы с ЛС и их качеством. ВОЗ и Европейская комиссия также признают необходимость вовлечения потребителей в фармаконадзор [26].
Фармаконадзор в СССР и Российской Федерации. В 1969 г. в Советском Союзе был создан Отдел учета, систематизации и экспресс-информации о побочном действии ЛС. В апреле 1973 г. этот отдел был трансформирован во Всесоюзный организацинно-методический центр по изучению побочных действий лекарств (ВЦПДЛ), в который поступала информация от врачей о нежелательных эффектах ЛС. ВЦПДЛ был упразднен вместе с Минздравом СССР в конце 1991 г. После этого большую, пожалуй, ключевую, роль в воссоздании службы контроля безопасности ЛС взяла на себя кафедра общей и клинической фармакологии Российского университета дружбы народов под руководство Владимира Константиновича Лепахина и Аллы Васильевны Астаховой, на базе которой в 1997 г. Минздравом РФ был создан Федеральный центр по изучению побочных действий ЛС, ликвидированный в 1999 г., а его функции были возложены на отдел токсикологии и изучения побочных эффектов лекарственных препаратов Института доклинической и клинической экспертизы лекарств Государственного научного центра экспертизы средств медицинского применения. Таким образом, фактически работа по фармаконадзору была в Российской Федерации заморожена вплоть до 2007 г., когда на базе Росздравнадзора был создан Федеральный центр мониторинга безопасности лекарственных средств на базе Научного центра экспертизы средств медицинского применения [21]. В 2010 г. функции фармаконадзора были официально закреплены за Росздравнадзором, а Федеральный центр мониторинга безопасности лекарственных средств трансформирован в Центр экспертизы безопасности лекарственных средств Федерального государственного бюджетного учреждения Научный центр экспертизы средств медицинского применения Минздрава России (бывший Научный центр экспертизы средств медицинского применения, вошедший в состав Минздрава) и утратил функции Национального центра фармаконадзора РФ.
Фармаконазор в Евразийском экономическом союзе и Российской Федерации. 29 мая 2014 г. был подписан договор о создании Евразийского экономического союза (ЕАЭС) на базе Таможенного союза, в который вошли Российская Федерация, Армения, Белоруссия, Казахстан и Киргизия. Данный документ вступил в силу 01.01.2015 [27]. В рамках Союза режим регулирования обращения ЛС и медицинских изделий определяет Договор о ЕАЭС [27]. С 01.01.2016 начал функционировать общий рынок ЛС и медицинских изделий (изделий медицинского назначения и медицинской техники) в соответствии с Правилами надлежащих практик (GxP) ЕАЭС [27].
Надлежащая практика фармаконадзора (GVP, Good Pharmacovigilance practices), являющаяся одной из Правил надлежащих практик (GxP) ЕАЭС, представляет собой руководство по осуществлению фармаконадзора в государствах – членах ЕАЭС [19, 27]. Система фармаконадзора (pharmacovigilance system) – структура, организуемая держателями регистрационных удостоверений ЛС и уполномоченными органами государств – членов ЕАЭС для выполнения задач и обязанностей по фармаконадзору, предназначенная для контроля безопасности ЛС, своевременного выявления всех изменений в оценке соотношения «польза–риск» лекарственных препаратов, разработки и внедрения мер по обеспечению применения ЛС при превышении пользы над риском [19, 27].
ЛС, находящиеся в обращении в Российской Федерации, подлежат мониторингу эффективности и безопасности в целях выявления возможных негативных последствий их применения, индивидуальной непереносимости, предупреждения медицинских работников, специалистов в области ветеринарии, пациентов или владельцев животных и их защиты от применения таких лекарственных препаратов [20].
Фармаконадзор осуществляется Федеральной службой по надзору в сфере здравоохранения (далее – Росздравнадзор) путем анализа представляемой субъектами обращения ЛС (держатели или владельцы регистрационных удостоверений на ЛС; юридические лица, на имя которых выданы разрешения на проведения клинических исследований в Российской Федерации, либо иные уполномоченные юридические лица; медицинские организации) информации о:
- побочных действиях ЛС;
- нежелательных реакциях ЛС;
- серьезных нежелательных реакциях ЛС;
- непредвиденных нежелательных реакциях ЛС;
- индивидуальной непереносимости ЛС;
- отсутствии эффективности ЛС;
- иных фактах и обстоятельствах, представляющих угрозу жизни и здоровью человека при применении ЛС, выявленных на всех этапах обращения лекарственных препаратов на территории Российской Федерации и других государств в целях выявления возможных негативных последствий их применения, индивидуальной непереносимости, предупреждения медицинских работников, пациентов и их защиты от применения таких ЛС [15, 28].
Фармаконадзор осуществляется Росздравнадзором на основании сведений, полученных в виде [15, 28]:
- сообщений субъектов обращения ЛС;
- периодических отчетов по безопасности ЛС;
- периодических отчетов по безопасности разрабатываемого (исследуемого) лекарственного препарата;
- информации, полученной в ходе осуществления государственного контроля (надзора) в сфере обращения ЛС.
Таким образом, с 2010 г. национальным центром фармаконадзора Российской Федерации является Росздравнадзор [28]. Данная организация обеспечивает сбор, систематизацию и анализ данных о безопасности ЛС на территории РФ, осуществляет ведение специализированной базы данных нежелательных реакций – Автоматизированная система «Фармаконадзор», а также международное сотрудничество с ВОЗ и WHO–UMC [15, 28].
Заключение
Заболеваемость и смертность, ассоциированные с развитием НПР при применении ЛС, по-прежнему вызывают серьезную озабоченность всех практикующих врачей, фармацевтов, организаторов здравоохранения. ЛИЗ могут также приводить к существенному росту расходов здравоохранения. Хотя некоторые лекарственно-индуцированные симптомы, синдромы и заболевания выявляются еще в ходе клинических исследований, другие не распознаются до тех пор, пока препарат не выпущен на рынок и будет доступен для широкого повседневного использования. Хотя все ЛС обладают потенциальной способностью вызывать ЛИЗ, их легко упустить из виду как возможную причину болезни пациента. Поэтому формирование у медицинских работников определенной «фармаконастороженности», повышение их профессиональных навыков в плане диагностики, коррекции и профилактики НПР, информированности о порядке предоставления информации о нежелательных лекарственных реакциях служат одними из основных принципов обеспечения лекарственной безопасности для пациентов при оказании медицинской помощи.


