Введение
Основной причиной клинических неудач при применении эмпирической антимикробной терапии помимо антибиотикорезистентности микрофлоры является нарушение регламента и инструкций введения антимикробных препаратов [1–3]. Акушерские стационары достаточно редко используют собственные протоколы (лекарственные формуляры) этиотропной терапии послеродовой инфекции с подробной регламентацией проведения процедуры. Наиболее часто в практической работе следуют только национальным рекомендациям [4, 5], при этом не учитываются перманентные локальные изменения в устойчивости госпитальных возбудителей [6, 7]. Ситуацию усложняет и фармакоэкономическая политика родильных домов [8].
Целью настоящего исследования стал анализ стереотипов применения родовспомогательными учреждениями Санкт-Петербурга системных антимикробных препаратов при послеродовых инфекционных осложнениях.
Методы
Проведено ретроспективное многоцентровое фармакоэпидемиологическое исследование, в котором проанализированы протоколы стартовой эмпирической терапии послеродовых инфекционно-воспалительных осложнений, предоставленные СПбГБУЗ МИАЦ всеми акушерскими стационарами Санкт-Петербурга. Предоставленные протоколы оценены на соответствие основному отраслевому приказу МЗ РФ № 572 [9] и действующим федеральным клиническим рекомендациям [4, 10–12]. Одновременно проведена экспертиза 150 историй родов из трех родильных домов, послеродовый период которых осложнился развитием эндометрита после кесарева сечения. Оценивали качество микробиологической диагностики, адекватность выбора и использования антимикробных химиопрепаратов (АМХП).
Критерии включения в исследование: абдоминальное родоразрешение, классические симптомы послеоперационного эндометрита (гипертермия ≥38°С со вторых суток послеоперационного периода, тазовая боль и/или болезненность матки при пальпации, гнойные выделения из половых путей с ихорозным запахом, субинволюция матки), наличие микробиологического подтверждения. Критерии исключения из исследования: несоответствие критериям включения. Конфаудингфакторы: в анамнезе предшествующее лечение системными противоопухолевыми иммуносупрессивными препаратами; вторичные иммунодефицитные состояния.
Результаты
За истекший год в СПбГБУЗ МИАЦ поступили данные о 2593 случаях послеродовых инфекционно-воспалительных осложнений. Согласно форме № 32, утвержденной приказом Росстата № 591 [13], идентифицированы следующие диагнозы: родовой сепсис, разлитая послеродовая инфекция (шифр по МКБ-10 О75,3 и О85) и инфекции мочеполовых путей (О86,2 и О86,3). Подавляющее большинство инфекционных осложнений скрывалось за диагнозом «другие инфекции мочеполовых путей после родов – О86,3». За указанный период в обсервационный стационар переведены только 26 родильниц.
Структура назначений антимикробных препаратов представлена на рис. 1, при этом около 1/2 всех родильниц изначально получали комбинацию из нескольких препаратов, в основном это были метронидазол и/или гентамицин.
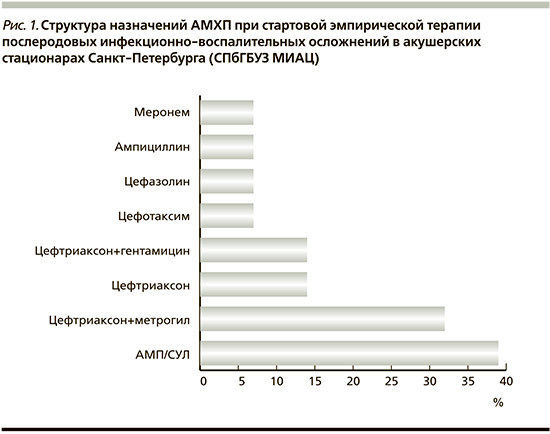
На долю β-лактамных антибиотиков пришлось 100% всех назначений, нитроимидазолов – 33% и аминогликозидов II генерации – 13%. Обращает на себя внимание, что при выборе комбинированной терапии нерационального назначения АМХП с разнонаправленным микробиологическим эффектом, как, например сочетание бактерицидного и бактериостатического действий, выявлено не было. Все комбинации представлены сочетанием бактерицидных АМХП, что должно потенцировать их действие. Однако каждой пятой родильницы были назначены цефалоспорины различных поколений без сочетания с метронидазолом. Данный вариант монотерапии следует признать недостаточным с микробиологической точки зрения, т.к. не перекрывается спектр облигатной неклостридиальной анаэробной микрофлоры, в первую очередь Bacteroides fragilis. Указанный облигатный анаэроб является одним из ведущих ассоциантов при развитии пуэрперальной инфекции и фенотипически обладает природной резистентностью к указанным цефалоспоринам [14].
Более чем в 1/2 всех случаев в родовспомогательных учреждениях города назначали цефалоспорины. Их спектр был представлен цефтриаксоном, цефотаксимом (цефалоспорины III генерации) и цефазолином (цефалоспорин I генерации). Обращает на себя внимание тот факт, что IV и V генерации цефалоспоринов в родовспомогательных учреждениях города в стартовой терапии не используют. В странах Европы по сравнению с РФ отмечается более широкое применение цефалоспоринов IV генерации и ингибиторозащищенных (ИЗ) цефалоспоринов [15].
ИЗ-аминопеницилины занимают второе место в сложившейся практике стартовой эмпирической терапии послеродовых инфекционно-воспалительных осложнений. Предпочтение в 100% случаев отдано ИЗ-ампициллину (АМП/СУЛ, комбинированный препарат ампициллина и сульбактама). Другие ИЗ-пенициллины, регламентированные действующими приказами, в формулярные списки родильных домов не входили.
Среди аминогликозидов в родовспомогательных учреждениях города использовался только препарат II генерации – гентамицин (13%). Сводные данные по микробиологической диагностике свидетельствуют о широком распространении в акушерских стационарах города устойчивости к аминогликозидам. Очевидно, что гентамицин не следует включать в схемы стартового эмпирического лечения нозокомиальных инфекций или при наличии необходимости заменить его амикацином (аминогликозид III генерации).
На последнем месте в формулярных списках стартовой эмпирической терапии послеродовых инфекционно-воспалительных осложнений стояли карбапенемы (меропенем). В последнее время карбапенемы все чаще стали рассматривать не только как средство резерва, но и в качестве АМХП для стартовой эмпирической фармакотерапии мультирезистентных госпитальных инфекций. Однако массовое эмпирическое их применение связано со значительными финансовыми затратами и высоким риском развития устойчивости у ряда патогенных возбудителей к этому классу антимикробных средств [1, 15].
В 14% случаев препаратами выбора при терапии послеродовых инфекционно-воспалительных осложнений являлись незащищенный ингибитором аминопенициллин ампициллин и цефалоспорин I генерации цефазолин. В настоящее время применение данных препаратов следует признать нерациональным. В связи с крайне высокой частотой распространения приобретенной антибиотикорезистентности среди подавляющего большинства госпитальных штаммов ни карбокси-, ни амино-, ни уреидопенициллины не следует использовать в протоколах для эмпирической терапии послеродовой инфекции в родовспомогательных учреждениях. Уже в ближайшем будущем эти некомбинированные β-лактамы будут полностью вытеснены из клинической практики ингибиторозащищенными АМХП.
Фторхинолоны состояли в резерве и использовались только при смене антимикробной терапии после клинической неэффективности стартового применения. Антимикробные препараты других классов не использовались.
Выявленный дисбаланс в сторону цефалоспоринов III генерации и незаслуженно низкое использование ИЗ-аминопенициллинов, по-видимому, служат следствием фармакоэкономических причин. В настоящее время на отечественном фармацевтическом рынке нередко генерики цефалоспоринов III генерации стоят дешевле, чем более ранние их поколения. В результате в клинической практике все чаще наблюдается уменьшение активности цефтриаксона в ситуации госпитальных инфекций и рост числа антибиотикорезистентности, проявляющейся как в увеличении числа энтерококковых и MRSA-суперинфекций, так и в росте числа ESBL-продуцентов семейства Enterobacteriaceae [16].
Только 25% акушерских стационаров города в протоколах стартовой антимикробной терапии учитывали стратификацию родильниц.
Формулярный список резервных препаратов, используемых акушерскими стационарами, представлен на рис. 2.
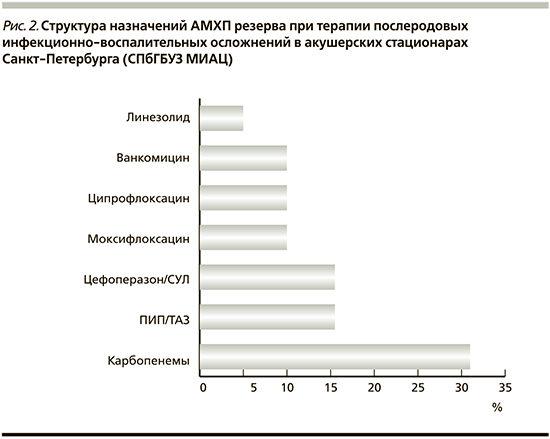
Как показывают описанные данные, более чем в половине случаев антимикробные препараты резерва были представлены β-лактамными антибиотиками (карбапенемами, ИЗ-уреидопенициллинами и ИЗ-цефалоспоринами III генерации). Комбинации препаратов, как в случаях стартовой терапии, не было.
Наиболее часто в качестве препаратов резерва, имеющих сверхширокий спектр антимикробной активности, использовались карбапенемы. Частота применения для имипенема была 33%, для меропенема – 50% и для эртапенема – 17%. Указанные препараты имеют высокую клиническую эффективность при терапии грамотрицательной инфекции, резистентной к цефалоспоринам III генерации. На наш взгляд, для терапии пуэрперальной инфекции больше подходит имипенем, в меньшей степени – эртапенем. Имипенем выгодно отличает более сбалансированное антимикробное действие на грамотрицательную и грамположительную микрофлору, включая большинство энтерококков, чего лишен эртапенем. Данная особенность очень важна, т.к. за мощное антимикробное действие карбапенемов на грамотрицательные энтеробактерии приходится расплачиваться грамположительной суперинфекцией.
На втором месте по частоте использования в акушерских стационарах стоит ИЗ-уреидопенициллин – пиперациллина тазобактам (ПИП/ТАЗ). Однако наш клинический опыт подсказывает, что резервация ПИП/ТАЗ в данном случае нецелесообразна как минимум по двум причинам. Во-первых, его принципиальное отличие по антимикробному спектру от ИЗ-аминопенициллинов – это антипсевдомонадное действие, которое в акушерской практике неактуально, т.к. Pseudomonas aeruginosa является крайне редким возбудителем послеродовой инфекции, а по действию на грамположительную кокковую микрофлору уступает АМП/СУЛ (ампициллин/сульбактам).
Во-вторых, использование резервного ПИП/ТАЗ в деэскалационной тактике сомнительно ввиду того, что он редко присутствует в панели тестируемых антибиотиков, а его антимикробная активность ненамного выше препаратов, лидирующих при стартовом применении (цефалоспорины III генерации и ИЗ-аминопеницилины).
Все вышеизложенное характерно и для ИЗ-цефалоспорина III генерации – цефоперазона/СУЛ.
Вторым по частоте использования АМХП резерва оказались фторхинолоны. Предпочтение отдавалось препарату I генерации фторхинолонов ципрофлоксацину и препарату II генерации моксифлоксацину. Это действительно мощные средства резерва для борьбы с госпитальной инфекцией, и во многих странах существует запрет на их использование в качестве средств первого ряда. Фторхинолоны следует назначать только при неэффективности стартовой эмпирической терапии в случаях получения антибиотикограммы.
Гликопептидный антибиотик ванкомицин и оксазолидиноновый антибиотик линезолид стояли на третьем месте. В связи с их узким действием на грамположительную микрофлору, в т.ч. и полирезистентную, они остаются единственно эффективным средством в клинической практике при суперинфекции, вызванной неудачным лечением цефалоспоринами III генерации и карбапенемами. На наш взгляд, такие антибиотики глубокого резерва, как ванкомицин, линезолид и тейкопланин, должны быть в арсенале только обсервационного септического отделения многопрофильной больницы, в противном случае единственным методом лечения переведенной родильницы после неэффективно проведенной антимикробной терапии в родильном доме остается только гистерэктомия.
При анализе имеющихся историй родов несоблюдение инструкции к АМХП были выявлены в среднем у 22,7% больных (табл. 1).
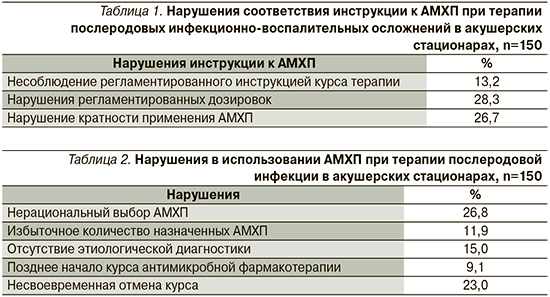
Наиболее типичными были ошибки в используемых дозировках и кратности применения АМХП, в частности, метронидазол назначался по 500–1000 мг/сут, гентамицин 80 мг – по 2 раза в сутки, цефтриаксон – по 2,0 г 2 раза в сутки, имипенем – по 1000–1500 мг/сут, ципрофлоксацин – по 2,0 г/сут (!). Суточная доза используемого антибиотика соответствовала обычной терапевтической дозировке и массе тела только в 71,7% историй родов.
При экспертизе историй родов нарушения в организации использования антимикробных препаратов при послеродовой инфекции были выявлены у 17,2% родильниц (табл. 2).
Обсуждение
Наиболее типичными были ошибки в выборе препарата и несвоевременной его отмене. Для 26% пациентоквыбор препарата в акушерском стационаре строился без учета лекарственного анамнеза и микробиологического мониторинга. В частности, пациенткам с эндометритом после кесарева сечения назначался антибиотик, уже использованный ими при периоперационной антибиотикопрофилактике. Использование цефалоспоринов I генерации и незащищенных пенициллинов вызывает недоумение, т.к. они крайне активно разрушаются β-лактамазами широкого спектра.
В связи с этим их применение не может рассматриваться как адекватная терапия (не соответствует международным и национальным рекомендациям), тем более при нозокомиальных инфекциях. С другой стороны, с фармакологической точки зрения использование ИЗ-аминопенициллинов в комбинации с метронидазолом следует считать избыточным.
Ни в одной из историй родов в дневниках на 3–4-е сутки от начала антимикробной терапии не было этапного эпикриза с отражением динамики в состоянии родильницы.
Также достаточно часто (23%) отмечалась несвоевременная отмена курса терапии (≤24 часа апирексии или использование антибактериальных препаратов ≥72 часов апирексии). Наиболее часто зафиксировано неоправданно длительное применение АМХП.
Качество бактериологического исследования лохий следует признать неудовлетворительным. Возбудитель послеродового эндометрита определен менее чем в 70% случаев. Обращает на себя внимание достаточно частая изоляция Staphylococcus epidermidis, что дает основание предполагать о некачественном заборе лохий с контаминацией исследуемого материала микрофлорой влагалища и вульвы, а изоляцию VRE (Vancomycin-resistant Enterococci) – технической ошибкой бактериологической лаборатории. Крайне нерационально для практического использования составлены панели тестируемых антибиотиков. При анализе истории родов в 15% случаев ресурс микробиологической диагностики вообще не был использован.
Заключение
Таким образом, проведенное исследование позволило выявлять ряд отклонений рутинной практики терапии послеродовой инфекции в акушерских стационарах от федеральных клинических протоколов и национальных рекомендаций.
Трудно оценить установленный в ходе настоящего исследования высокий уровень потребления акушерскими стационарами города цефалоспоринов III генерации при нозокомиальных инфекциях с высоким уровнем вероятности изоляции полирезистентных возбудителей. В общехирургической практике схемы стартовой антимикробной фармакотерапии госпитальных инфекций с использованием цефалоспоринов III генерации давно признаны неадекватными ввиду крайне высокого уровня ESBL-продуцентов семейства Enterobacteriaceae в этиологии интраабдоминальных инфекций, в т.ч. послеоперационных [16, 17].
Следовательно, тактику антибиотикотерапии послеродовой нозокомиальной инфекции в акушерских стационарах города признать полностью рациональной нельзя. Невысокими были объем и качество проведенной этиологической диагностики. Выбор препарата или нерациональная комбинация, как правило, не учитывали антибактериальный анамнез родильницы и проведенную периоперационную антибиотикопрофилактику.
Существующая практика назначения антимикробной терапии послеродовых инфекционных осложнений не соответствовала рекомендуемой каждой пятой родильнице. Часть используемых комбинаций нерациональные с точки зрения фармакодинамического профиля препаратов (синергизм в отношении ведущих возбудителей послеродовой инфекции) и с микробиологической точки зрения не имели преимуществ перед монотерапией ИЗ-пенициллинами. Выявленный невысокий комплаенс проводимой стартовой эмпирической фармакотерапии послеродовой инфекции национальным рекомендациям – одна из основных причин роста частоты клинических неудач лечения и резистентности микрофлоры.
Выявленные нарушения негативно отразились на результатах терапии – 19% пациентов требовали смены антимикробных препаратов в связи с клинической неэффективностью, а 0,5% госпитализированы в септическое отделение многопрофильной больницы.


