Идея
Рождение желанных детей в подходящее для семьи время – идея, зародившаяся еще в XVIII в. В 1898 г. австрийский психоаналитик З. Фрейд высказал следующую мысль: «Теоретически это было бы одним из величайших достижений человечества… если бы акт, необходимый для произведения потомства, был бы поднят на уровень свободного и преднамеренного действия, для того чтобы отделить его от поведения, направленного на удовлетворение естественных (сексуальных) желаний…» [1].
Первыми выразителями идеи предупреждения беременности считают английского священника, демографа и экономиста Томаса Мальтуса (1766–1834) и социального реформатора Фрэнсиса Плейса (1771–1854), в дальнейшем – последователей Мальтузианской лиги, организованной в 1877 г. Лига занималась просветительской работой, боролась за возможность использования контрацепции, предполагая, что причиной бедности и страданий рабочего класса являются нерационально большие семьи. Вслед за Британией аналогичные лиги были организованы в Германии, Франции и Голландии. В 1892 г. Голландская лига при участии первой женщины-врача в Нидерландах, суфражистки доктора Алетты Якобс (1854–1929), открыла в Амстердаме первую в истории клинику планирования семьи. Там обучали использованию диафрагмы Месинги, также известной как голландский колпачок (Dutch cap), изобретенной в 1882 г. пионером в области контрацепции д-ром C. Hasse (псевдоним – Вильгельма Месинги, 1836–1910) [2].
Американская активистка Маргарет Сэнгер (1879–1966) основала аналогичную клинику в США (1916). Она считала: «Контроль над рождаемостью – это первый важный шаг, который женщина должна сделать для достижения своей свободы; это первый шаг, который она должна сделать, чтобы быть равной мужчине; это первый шаг, который они оба должны сделать для освобождения человека» (1918) [3]. Пример собственной матери, умершей в 45 лет и бывшей беременной за свою жизнь около 20 раз, оказал значительное влияние на ее мировоззрение.
М. Сэнгер основала Американскую лигу контроля над рождаемостью (1921), с 1956 г. стала президентом созданной ею Международной ассоциации планирования семьи. Сегодня это Международная федерация планируемого родительства, в состав которой входят 132 ассоциации-члены в 164 странах. Миссия организации – обеспечение репродуктивного здоровья во всем мире, борьба за сексуальные права. По мнению ее сына, Александра Сэнгер: «Отделение сексуальности от репродукции стало самым высоким и дальним прыжком из царства необходимости в царство свободы, сделанным человечеством в ХХ в.» [2].
Праотцы
В 1905 г. Эрнст Старлинг (1866–1927) впервые применил термин «гормон» [4]. Это греческое слово означает «импульс, толчок к действию, запуск». В 1919 г. Людвиг Хаберландт (1885–1932), профессор физиологии в Университете Инсбрука (Австрия), имплантировал яичники беременной крольчихи под кожу небеременной особи, что сделало ее бесплодной на несколько месяцев, и пришел к выводу, что гормон желтого тела, секретируемый яичниками, тормозит овуляцию. Он предположил, что вещество с аналогичными биологическими свойствами может быть основой контрацептива для человека. По словам Карла Джерасси (1923–2015): «Если когда-либо существовал “дед пилюли”, Людвиг Хаберландт прежде всего заслуживает этой чести» [5]. Совместно с фармацевтической компанией Gedeon Richter (Венгрия) в 1930 г. Л. Хаберландт разработал и начал клинические испытания препарата Инфекундин. Однако его предназначение противоречило моральным, этическим и религиозным устоям того времени и препарату не сужено было увидеть свет (стал выпускаться только с 1966 г.) [2]. В своей книге «Гормональная стерилизация женского организма» Л. Хаберландт отмечал, что гормональная контрацепция сможет способствовать построению лучшего общества, а возможность контролировать деторождение – «один из величайших триумфов человечества» [6]. Его идеи не были приняты. За них он поплатился научной карьерой и в 1932 г. умер от сердечного приступа (по другим источникам – покончил с собой).
Примерно в то же время в химико-фармацевтической компании Schering AG (Германия) изучали химическую структуру половых гормонов. Исследовательскую группу возглавил физиолог Геттингенского университета Адольф Бутенандт (1903–1995), и в 1929 г. был получен эстрон в чистой кристаллической форме, названный им фолликулином (рис. 1). Тогда же эстрон синтезировал выдающийся американский биохимик Эдуард Дойзи (1893–1986) [6]. В 1931 г. А. Бутенандт выделил второй гормон – эстриол, а спустя год с помощью спектрографического и химического анализов он и его коллеги доказали стероидную структуру эстрогенов. К 1934 г. ученый получил в кристаллическом виде и прогестерон, параллельно доказав его блокирующее действие на овуляцию, а через пять лет синтезировал его из холестерина. В 1939 г. А. Бутенандт получил Нобелевскую премию по химии (совместно со швейцарским ученым Леопольдом Ружичкой) с формулировкой Нобелевского комитета «За работы по половым гормонам».

Э. Дойзи также продолжал изучать половые гормоны и к 1936 г. выделил из свиных яичников наиболее активный эстроген – эстрадиол (при этом потребовалось 4 тонны яичников свиноматок, чтобы получить 12 мг гормона) [7]. И А. Бутенандт и Э. Дойзи получали натуральные гормоны из биологической субстанции. Их себестоимость была очень высокой, и вопрос о введении гормонов в медицинскую практику не поднимался.
Другими ключевыми моментами 1930-х гг. стали определение роли гипофиза в регуляции менструального цикла (W. Holweg и C. Jankmann, 1932–1935); расшифровка структуры и синтез эстрадиола в 1938 г. и его синтетических аналогов – местранола и этинилэстрадиола, активных при приеме внутрь (H.H. Inhoffen, 1906–1992); синтез прогестерона из дикого ямса, произрастающего в Мексике (R.E. Marker, 1940).
В 1951 г. группа К. Джерасси в США осуществила химический синтез перорального прогестерона, что значительно упростило и удешевило его производство, хотя эти исследования не фокусировались на контрацепции. Ученый писал: «В то время прогестерон использовался в клинике для лечения нарушений менструального цикла, бесплодия и рака шейки матки с помощью довольно болезненных инъекций концентрированного масляного раствора, что привело нас к идее создать более мощное прогестагенное соединение, которое было бы активным при введении внутрь» [5]. И в том же 1951 г. был получен норэтистерон, а двумя годами позже – норэтинодрел, синтезированный Фрэнком Колтоном (1923–2003). Оба соединения были в несколько раз сильнее, чем естественный прогестерон, и могли применяться перорально, однако ни К. Джерасси, ни Ф. Колтон не видели их потенциала в целях контрацепции [5].
Начало
Грегори Пинкус (1903–1967), американский биолог, начал изучать стероидные гормоны еще в начале своей карьеры, и первым его успехом было достижение экстрапорального оплодотворения кроликов в 1934 г. (рис. 2). В 1951 г. М. Сэнгер, встретившая Г. Пинкуса на званом обеде, выхлопотала для него небольшой грант, который позволил ему начать заниматься новаторскими исследованиями в области гормональной контрацепции. Пинкус со своим великолепным сочетанием технических знаний и научной интуиции нашел определяющее решение почти сразу. Вскоре вместе с доктором Мин Че Чангом (1908–1991), исследователем Уорчестерского фонда, он проверил прогестерон на лабораторных животных и убедился, что овуляция прекращается при пероральном применении. Однако финансирование вскоре закончилось. В 1953 г. М. Сэнгер знакомит Г. Пинкуса с филантропом Кэтрин МакКормик (1875–1967), которая работала вместе с нею по вопросам контроля рождаемости и основала Фонд нейроэндокринных исследований. Встреча эта оказалась судьбоносной: К. МакКормик начала финансировать исследовательский фонд Пинкуса. В 1952–1953 гг. он провел небольшие испытания на людях вместе с доктором Джоном Роком (Бостон, США). На V Международной конференции по планированию семьи в 1955 г. Г. Пинкус объявил, что норэтинодрел и норэтиндрон имеют наибольший потенциал для контрацепции. Также Г. Пинкус и его коллеги обнаружили, что сочетание прогестерона и эстрогена увеличивает их эффективность в подавлении овуляции [5].
Масштабные испытания таблеток на женщинах провела доктор Эдрис Райс-Рей в 1956 г. в Пуэрто-Рико (в США в то время средства контрацепции были вне закона). В итоге были созданы «пилюли» Enovid, и хотя к тому времени их контрацептивное действие было доказано, они были одобрены FDA (Food and Drug Administration) в 1957 г. для лечения нарушений менструального цикла. Инструкция по применению содержала предупреждение о временном бесплодии как о побочном эффекте. Тем временем американки, которым был прописан Enovid, стали использовать его именно как средство контрацепции. Достаточно быстро выяснилось, что спрос на препарат намного превысил предполагаемую частоту распространенности расстройств менструации, и к 1959 г. число принимающих его достигло полумиллиона [2]. «Идея о том, что здоровые женщины могут принимать высокоактивные гормональные препараты каждый день для предупреждения беременности, кажется необычайной», – отмечал Г. Пинкус. Однако эта идея оправдала себя и в 1960 г. к показаниям была добавлена контрацепция. В феврале 1961 г. первоначальный состав таблеток изменился (150 мкг местранола и 10 мг норэтинодрела) [8]. В том же году компания Schering выпустила Anovlar (50 мкг этинилэстрадиола и 4 мг норэтистерона ацетата) [6]. Уже 80-летняя М. Сэнгер наконец-то увидела, как ее мечта претворилась в жизнь.
Даже после того, как таблетки были одобрены, К. МакКормик продолжала финансировать лабораторию Пинкуса и исследования по улучшению состава таблеток вплоть до ее смерти в 1967 г., предоставив таким образом около 20 млн долл. (в современном выражении) собственных денег на разработку гормональных контрацептивов (ГК).
Появившийся рынок ГК (а они считаются самыми продаваемыми таблетками в мире) внес существенные перемены в экономику, общественную и частную жизнь сотен миллионов человек. Позднее, в 2010 г., журнал TIMES так оценил значение ГК: «Выйдя в свет в момент социальных и политических потрясений, «таблетка» стала поводом для более глубоких тенденций: отказа от традиционного уклада жизни, изменения института семьи, пересмотра роли женщины» [9].
На территории СССР ГК появились лишь в начале 1970-х гг. (инфекундин и бисекурин завозились из Венгрии) и были, как и многие другие лекарства, в дефиците. Это было время «холодной войны», и быстрое распространение таблеток по всему миру требовало от Советского Союза реагирования на это изобретение «чуждого» мира. Поэтому политическая и бюрократическая элита вела политику, специально направленную на ограничение доступности и использования противозачаточных таблеток, сосредоточив внимание общественности на побочных эффектах [10].
Эволюция
Вопросы о безопасности ГК в отношении венозной тромбоэмболии поднимались еще в 1934 г. и в ходе испытаний в Пуэрто-Рико [7]. В 1970-е гг. вопрос «о таблетках» получил широкий общественный резонанс и даже был заслушан в Сенате США [11]. Решением этих проблем предстояло заняться разработчикам следующих поколений контрацептивов.
Сначала дальнейшее развитие комбинированных оральных контрацептивов (КОК) пошло по линии уменьшения количества активного вещества в препарате, что, с одной стороны, делало их безвреднее за счет уменьшения побочных эффектов, с другой – дешевле, а вместе – все более популярными. Так, с переходом на препараты, содержащие менее 40 мкг этинилэстрадиола (ЭЭ), их переносимость значительно улучшилась, а также более чем в 2 раза снизилась частота развития тромботических осложнений [12]. Современные низкодозированные КОК содержат 30–35 мкг ЭЭ, микродозированные – 15–20 мкг. Однако дальнейшее снижение дозы ЭЭ оказалось нецелесообразным в связи с ухудшением контроля цикла [13].
Параллельно шел поиск новых гестагенов, и в отличие от эстрогенной составляющей, неизменно предоставляемой ЭЭ на протяжении многих лет, прогестагенный компонент в КОК постоянно менялся. Синтетические прогестагены (их называют прогестинами) взаимодействуют в организме не только с прогестероновыми рецепторами, но и с рецепторами других стероидов, что определяет их добавочные эстрогенное, андрогенное, глюкокортикоидное и минералокортикоидное действия. Первыми прогестинами в составе ГК были эстраны – производные тестостерона (норэтистерон, норэтинодрел, линестренон). Их андрогенное влияние связывают с появлением акне, гирсутизма; задержкой жидкости в организме, изменением липидного спектра крови, а дополнительное эстрогенное – с усилением проявлений эстрогензависимых побочных эффектов. Кроме того, их гестагенная активность была невысокой [14].
Иными свойствами обладают производные 17-α-гидроксипрогестерона (прегнаны): кроме антигонадотропного эффекта они оказывают еще и антиандрогенное, а также глюкокортикоидное действия. Глюкокортикоидный эффект ГК считается нежелательным, поскольку он может стать причиной увеличения массы тела и снижения минеральной плотности костной ткани. В то же время дополнительное антиандрогенное действие оказалось полезным женщинам с проявлениями гиперандрогении. Антиандрогенные эффекты умеренно выражены у хлормадинона ацетата (ХМА, описан/введен в клиническую практику в 1959/1965 гг. Belara и др., в России – Белара), максимально – у ципротерона ацетата (ЦПА, 1961/1978, в составе Diane и Diane-35, Femilar, в России – Диане-35) (прим. авт. – здесь и далее приводятся названия только оригинальных препаратов) [15].
Новое производное тестостерона группы гонанов норгестрел, предложенный бразильским ученым Эльсимаром Кутиньо (р. 1930), позволил уменьшить дозу прогестина и впервые введен в состав КОК в Германии в 1966 г. (Euginon), в США – в 1968-м (Ovral) [16]. Открытие норгестрела предвосхитило синтез левоноргестрела (ЛНГ), внедрение которого в практику было большим прогрессом. ЛНГ – левовращающий изомер норгестрела, абсолютная биодоступность которого составляет 100% от принятой дозы. Ввиду наиболее прочного и избирательного связывания с рецепторами прогестерона ЛНГ проявляет более высокую гестагенную активность в отсутствие взаимодействия с иными рецепторами (кроме клинически незначимого андрогенного влияния).
ЛНГ является наиболее изученным среди всех прогестинов: его свойства и особенности действия подтверждены многочисленными исследованиями, поэтому его используют в качестве эталона («золотого» стандарта) для сравнения при оценке эффективности и безопасности всех других ГК. Первый препарат, содержащий 30 мкг ЭЭ и 150 мкг ЛНГ, Микрогинон, стал применяться с 1973 г., а в 1979 г. вышел Триквилар – трехфазный препарат, доза гормонов в котором была снижена на 40%, что способствовало уменьшению андрогенных и метаболических эффектов [17].
ЛНГ оказался прогестином, который может использоваться внутриматочно. Первая внутриматочная терапевтическая система (ВМС) Progestasert, выделявшая 65 мкг прогестагена, с периодом использования 1 год начала применяться с 1976 г. в Финляндии [18], но не получила широкого распространения. Более успешной оказалась ВМС-ЛНГ Mirena (20 мкг/24 ч), впервые одобренная в Финляндии (1990) и в Соединенных Штатах (2000) [19]. Это одна из наиболее эффективных форм контроля рождаемости с частотой неудач в течение года 0,1–0,2%, в течение 5 лет – 0,7–0,9% [19].
К производным ЛНГ относятся более поздние прогестагены – дезогестрел, гестоден, норгестимат. Активным метаболитом дезогестрела (ДЗГ) является 3-кетодезогестрел, обладающий высоким сродством к прогестероновым рецепторам и селективностью. Биодоступность ДЗГ в среднем составляет 76% (индивидуально от 40 до 100%). Он был открыт в 1972 г. (Organon International, Нидерланды) и введен для использования в медицинских целях в Европе в 1981 г., в США – в 1992-м. Несколькими годами позже КОК, содержащие ДЗГ, были зарегистрированы и в России – Марвелон (30/150) и Мерсилон (20/150), а также трехфазный Три-Мерси. Открытый в том же году гестоден (ГСД) высокоселективен к рецепторам прогестерона, обладает 100%-ной биологической доступностью и некоторыми антиминералокортикоидными свойствами в отсутствие андрогенной активности. Препараты, содержащие 30 мкг ЭЭ, 75 мкг ГСД (Femoden, Minulet, Millinette 30/75 и др.), появились в 1986 г., позднее – содержащие 20 мкг ЭЭ (Meliane, Sunya, Femodette и Millinette 20/75 и др.). В России они известны как Фемоден и Логест соответственно. Эти КОК также пригодны к использованию пациентами с сахарным диабетом или нарушением липидного обмена, потому что они имеют минимальное воздействие на уровень глюкозы в крови и липидный профиль [20].
Норгестимат был запатентован в 1965 г. (введен в КОК в 1986 г. – Silest, Cyclen и др.; в России – Силест 35/250). Его активные метаболиты обладают очень слабой андрогенной активностью и не имеют иного гормонального влияния [21].
Этоногестрел – активный метаболит ДЗГ, обладающий всеми его свойствами (1972/1998), входит в состав современных ГК пролонгированного действия – подкожных имплантатов (Nexplanon, Implanon) и влагалищных колец (в сочетании с ЭЭ – NuvaRing, Circlet, в России – Импланон и Импланон НКСТ, НоваРинг) [22]. Синтез этого вещества определил возможность иного пути введения ГК, кроме перорального.
Сосредоточив внимание в первую очередь на дополнительных эффектах прогестинов, ученым удалось разработать новый гибридный гестаген – диеногест (ДНГ; 1979/1995; Valette, Natazia и Qlaira, в России – Жанин, Клайра). Он сочетает преимущества природного прогестерона с метаболической устойчивостью гонанов, что обусловливает его наиболее сильное действие на эндометрий и антиандрогенное действие. ДНГ не влияет на все основные виды обменов – белковый, липидный и углеводный [23].
Производное спиронолактона дроспиренон (ДРСП) объединяет свойства прогестерона (антигонадотропный и антиандрогенный) и антиминералокортикоидов (уменьшение задержки жидкости и натрия в организме), запатентован в 1976 г. Первые таблетки, содержавшие 3 мг ДРСП, стали доступными в 2002 г. (Yasmin, Jasmine, Yarina, др. – 30ЭЭ/ДРСП и Yaz, Yasminelle, др. – 20ЭЭ/ДРСП; в России – Ярина и Джес соответственно) [24].
Наиболее высокоселективное производное 19-норпрогестерона – номегэстрола ацетат (NOMAC, 1983/2011; Zoely, в России – Зоэли с составом 1,55 мг этрадиола и 2,5 мг NOMAC), обладающий только антигонадотропными свойствами [25].
Новые прогестины, полученные из структуры прогестерона или спиронолактона, были разработаны, чтобы избежать андрогенных эффектов и улучшить профиль безопасности. Однако их сочетание с ЭЭ не уменьшило риска тромбозов [26]. В связи с этим новой тенденцией стало изменение типа используемого эстрогена – в состав КОК были введены природные соединения, такие как эстрадиол (Э2) и эстрадиола валерат (Э2В). КОК, содержащие Э2В/ДНГ и Э2/NOMAC, показали благоприятные результаты в исследованиях гемостаза и метаболизма [27, 28]. Биодоступность Э2В и Э2 эквивалентна эндогенному эстрадиолу и составляет 3–5%, что обеспечивает низкую частоту побочных эффектов. Основная проблема в неадекватном контроле цикла при их монофазном режиме. В результате для Э2В/ДНГ найден оптимальный четырехфазный режим (Клайра), показавший лучшие результаты по сравнению с монофазным Э2/NOMAC [29–34].
Можно отметить, что натуральные эстрогены в минимальных дозах в составе КОК – начало искоренения проблемы венозных тромбозов. Результаты исследования реальной клинической практики INAS-SCORE [35] показали более низкий риск венозных и артериальных тромбоэмболий для Э2В/ДНГ по сравнению с другими КОК или КОК, содержащими ЛНГ (подробнее – во II части статьи).
Одним из путей эволюции ГК стало создание новых режимов с укороченным безгормональным интервалом (БГИ). Классическая схема применения КОК включает 21 день приема активных таблеток с последующим 7-дневным БГИ в конце цикла (перерыв или плацебо, 21/7). Плацебо используют для того, чтобы не прерывать привычного ежедневного приема таблеток и не пропускать начало нового цикла. Доказано: в режиме продленного дозирования при применении 24 активных таблеток, содержащих 20ЭЭ/ДРСП или Э2/NOMAC, в монофазном режиме и плацебо в последующие четыре дня значительно уменьшаются объем кровопотери и частота межменструальных кровотечений [33]. Лучшие данные получены для Э2В/ДНГ в режиме 26/2 [36, 37]. Подобная схема обеспечивает повышенную эффективность контрацепции, низкую частоту дисменореи и головной боли [36, 37]. Режим продленного цикла отличается отложенным БГИ: активные таблетки используют 84 дня подряд, затем следует неделя приема плацебо. При таком режиме число менструаций снижается с 13 до 4 в год (Seasonique – 30ЭЭ/150ЛНГ 84 дня и 10ЭЭ 7 дней, LoSeasonique – 20ЭЭ/100ЛНГ 84 дня и 10ЭЭ 7 дней) [38]. При непрерывном режиме менструации отсутствуют вовсе (Lybrel – 20ЭЭ/90ЛНГ 365 дней) [39]. Существует еще гибкий режим, когда наступление менструации может определять сама женщина (Yaz Flex – 20ЭЭ/ДРСП от 24 до 120 дней с перерывом 4 дня; в России – Джес® во флекс-картридже с дозатором Clyk) [40].
По мере создания новых гестагенов в 1970-е гг. предложены таблетки, содержавшие только прогестагены, получившие название «мини-пили». Первая такая таблетка содержала 0,5 мг ХМА и продавалась в Мексике и Франции в 1968 г. (отозвана в 1970 г. из-за проблем безопасности) [41]. Впоследствии в 1971 г. в Германии выпущены мини-пили, содержавшие 30 мкг ЛНГ (Microval, в России – Микролют) [42]. После этого последовал ряд других препаратов, в т.ч. содержащих этинодиола диацетат 500 мкг (Femulen), линестренол 500 мкг (Exluton), норэтистерон 300 мкг (Mini-Pe), норгестрел 75 мкг (Neogest, Ovrette). Мини-пили с 75 мкг ДЗГ (Cerzette) появился в Европе в 2002 г. (в России – Чарозетта). От более ранних они отличаются тем, что способны ингибировать овуляцию в 97% циклов [43].
Кастомизация
Этот термин (от англ. customize) означает настраивать, подбирать что-то, делая более подходящим под нужды конкретного потребителя. Как было показано выше, прогестины имеют отличия по ряду биологических эффектов, в зависимости от которых КОК приобретают дополнительные свойства, определяя их неконтрацептивные преимущества (лечебные эффекты), имеющие практическое значение для женщин с дополнительными потребностями, нуждающихся в контрацепции. В ряде случаев в инструкции по медицинскому применению препаратов внесены соответствующие показания, что делает юридически обоснованным использование КОК в лечебных целях: контрацепция и лечение угрей (acne vulgaris) средней степени тяжести (Джес и Джес Плюс); явления андрогенизации и андрогензависимыми заболеваниями: угри (особенно их выраженные формы, сопровождающиеся себореей, воспалительными явлениями с образованием узлов/папулезно-пустулезные угри, узелково-кистозные угри), андрогенная алопеция и легкие формы гирсутизма (Диане-35); контрацепция и лечение обильных и/или длительных менструальных кровотечений без органической патологии (Клайра); лечение идиопатической меноррагии, а также профилактика гиперплазии эндометрия при проведении менопаузальной терапии эстрогенами (ВМС-ЛНГ Мирена); лечение тяжелой формы ПМС (Джес, Джес Плюс) [44–47]. В последние годы появились ДРСП, содержавшие КОК с добавлением 400 мкг фолатов (Джес Плюс, Ярина Плюс), позволившие избегать возникновения дефицита фолиевой кислоты при длительном приеме КОК, особенно у женщин с их дефицитом [48, 49].
Еще в 1966 г. Г. Пинкус сказал: «Пройдет полвека, и люди забудут о первой таблетке, потому что у них будут тысячи других таблеток и сотни других возможностей» [5].
И его предвидение в полной мере оправдалось.
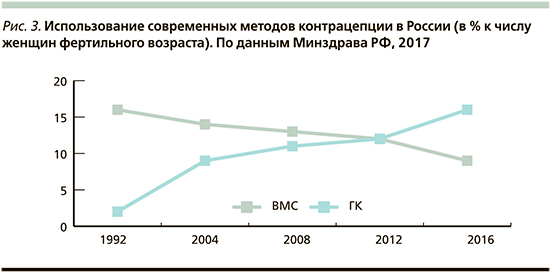
С 1990 г. проблема развития и внедрения ГК в России начала решаться на государственном уровне. В 1992 г. создана Российская ассоциация «Планирование семьи» (РАПС), генеральным директором которой стала к.м.н. И.И. Гребешева. В 1993 г. РАПС была принята в члены Международной федерации по планированию семьи (МФПС). В 1993 г. было организовано Российское общество по контрацепции (РОК), которое вошло в состав Европейского общества по контрацепции, президент – профессор В.Н. Прилепская. Результаты просветительской работы РОК сегодня – содействие снижению числа абортов, распространение рациональной контрацепции (рис. 3), внедрение ее новых прогрессивных методов. Настоящие и будущие исследования российских ученых нацелены на изучение новых препаратов с позитивным влиянием на различные звенья репродуктивной системы.
Перспективы
Хотя к настоящему моменту достигнуты впечатляющие результаты в создании безопасных и приемлемых средств ГК, исследования в этом направлении продолжаются. По мнению профессора R. Sitruk-Ware (США), «доступные в настоящее время контролируемые пользователем методы контрацепции могут быть улучшены для повышения соответствия требованиям пользователей. Внедрение новых методов с дополнительными преимуществами для здоровья может, кроме того, повысить готовность использовать противозачаточные средства».
Новые разработки в области ГК включают КОК, содержащие новые прогестины (SPRMs – селективные модуляторы рецептора прогестерона), натуральные эстрогены (Э4 – фетальный эстерол), добавки – андрогены (ДГЭА), витамины или кардиопротективные агенты, новые пластыри (0,9 мкг ЭЭ/гестоден, ЛНГ-только, ЭЭ/ЛНГ), вагинальные кольца с 3-месячным периодом пользования (прогестиновые с натуральным прогестероном, содержащие SРRMs в сочетании с эстрогенами), вагинальные кольца с двойным действием (содержащие антиретровирусный препарат), система дозированной трансдермальной доставки в виде геля. Ряд исследований сфокусированы на разработке внутриматочных систем с новыми гестагенами или сниженной дозой ЛНГ и инъекционных препаратов с прогестинами, которые переносятся лучше, чем депо медроксипрогестерона ацетата, и с более длительным действием [50].
Заключение
Итак, с момента выпуска препарата Эновид прошло 60 лет. Это было непростое время – время политических, экономических и социальных потрясений, но еще и время плодотворных научных поисков, открытий и достижений. Но, пожалуй, ни одно изобретение не оказало такого значительного влияния на общество во всем мире, как изобретение гормональной контрацепции: «За всю историю медицины были разработаны тысячи лекарств, но только одно из них было достаточно влиятельным, чтобы заработать титул просто «таблетки» [8].
С медицинской точки зрения современные ГК характеризуются высокой контрацептивной эффективностью, низким риском развития побочных эффектов и тромбоэмболических событий, неконтрацептивными свойствами, доступностью. Широкая линейка средств ГК позволяет каждой женщине сделать свой выбор в пользу того препарата, который будет максимально отвечать ее потребностям и ожиданиям.


