Введение
Бронхиальная астма (БА) – одно из самых частых заболеваний, которым в различных странах мира страдают около 360 млн человек [1]. Увеличение продолжительности жизни населения в развитых странах мира привело к возрастанию числа пациентов, страдающих этим заболеванием в пожилом и старческом возрасте. Показано, что распространенность БА среди больных в возрасте 60 лет и старше составляет от 1,8 до 14,5% [2–6]. По нашим данным, в Санкт-Петербурге этим заболеванием страдают 4,2% мужчин и 7,8% женщин старше 60 лет [7]. Хорошо известно, что в большинстве случаев БА начинается в детском или молодом возрасте («ранняя» астма). Ее проявления могут сохраняться у пожилых или исчезать. У значительно меньшего числа больных симптомы болезни появляются в пожилом (~в 3% ) и старческом (~в 1%) возрасте («поздняя» астма) [8, 9].
Установлено, что риск смерти пожилых с БА выше, чем у молодых [2, 3]. Так, среди 400 тыс. больных, умирающих ежегодно в мире от БА, преобладают люди старше 65 лет. Значительная часть их смертей обусловлена неадекватным длительным лечением БА и ошибками оказания неотложной помощи при развитии обострений [10].
Диагностика БА
Постановка диагноза БА, впервые возникшей в пожилом и старческом возрасте, часто сопряжена со значительными трудностями. Более чем у половины пациентов это заболевание диагностируется поздно или не выявляется совсем [11]. Возможные причины гиподиагности БА приведены в табл. 1.
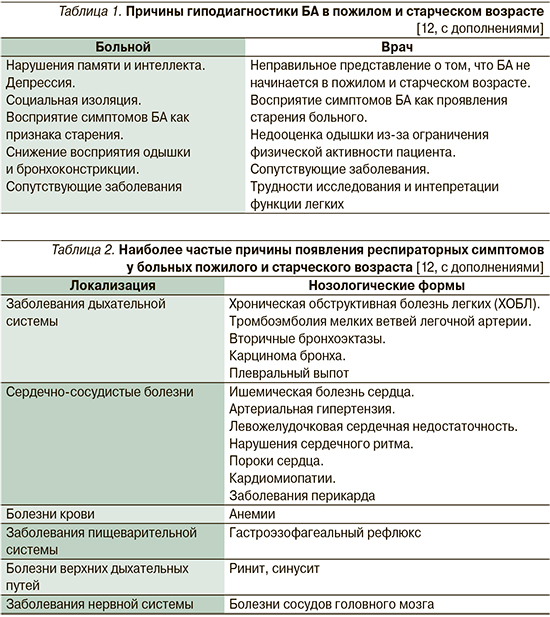
Восприятие симптомов БА пациентами пожилого возраста часто снижено [13]. Вероятно, это связано со снижением у них чувствительности инспираторных (главным образом диафрагмальных) проприорецепторов к изменениям объема легких, хеморецепторов к гипоксии, а также к нарушениям ощущения увеличенной респираторной нагрузки [9, 14]. Пароксизмальная одышка, приступообразный кашель, стеснение в грудной клетке, свистящее дыхание нередко воспринимаются самим больным и лечащим врачом как признаки старения или других заболеваний (табл. 2). Более чем у 60% пациентов отсутствуют классические приступы экспираторного удушья [15]. Одним из самых частых симптомов, беспокоящих пожилых пациентов, является быстрая утомляемость [16].
Показано, что почти 75% больных БА пожилого возраста имеют хотя бы одно сопутствующее хроническое заболевание [17]. Наиболее часто встречаются ишемическая болезнь сердца (ИБС), артериальная гипертензия, катаракта, остеопороз, респираторные инфекции, ожирение [18–20]. Сопутствующие болезни часто видоизменяют клиническую картину БА. Показано, что их своевременное выявление и адекватное лечение могут улучшить контроль БА [20].
Большое значение для постановки правильного диагноза имеет тщательно собранный анамнез болезни и жизни пациента. Важно обращать внимание на возраст начала заболевания, причину появления его первых симптомов, характер течения, отягощенную наследственность, профессиональный и аллергологический анамнез, курение, сведения о ранее перенесенном туберкулезе органов дыхания, прием лекарственных препаратов по поводу сопутствующих болезней (табл. 3).

В связи с трудностью интерпретации клинических симптомов при постановке диагноза большое значение имеют результаты объективного обследования, позволяющие установить наличие признаков бронхиальной обструкции, гиперинфляции легких, сопутствующих заболеваний и оценить их выраженность.
К обязательным методам исследования относится спирография с тестом на обратимость обструкции. Признаки нарушения бронхиальной проходимости: снижение объема форсированного выдоха за 1-ю секунду (ОФВ1<80% от должного) и соотношения ОФВ1/форсированная жизненная емкость легких (ФЖЕЛ) менее 0,7. Обструкция обратима, если через 15–45 минут после ингаляции бронхолитика наблюдается прирост ОФВ1 на 12% и 200 мл и более по сравнению с исходным [21, 22].
Показано, что у пожилых больных нормальные показатели ОФВ1 регистрируются менее чем в 20% случаев [23]. По сравнению с пациентами молодого возраста они нередко имеют более выраженную бронхиальную обструкцию, меньшую ее обратимость после ингаляции бронхолитика и нарушения на уровне дистальных бронхов [2, 24]. До 30% пациентов имеют фиксированную бронхиальную обструкцию (постбронхолитический ОФВ1/ФЖЕЛ<0,7) [25]. В ряде случаев это затрудняет дифференциальный диагноз БА и ХОБЛ.
Для оценки вариабельности нарушений бронхиальной проходимости используется пикфлоуметрия. Из-за снижения остроты зрения и нарушений памяти ее выполнение пациентами пожилого и старческого возраста часто затруднено.
Кроме обратимости бронхиальной обструкции к дополнительным тестам при дифференциальном диагнозе БА и ХОБЛ относится определение диффузионной способности легких. Показано, что у больных ХОБЛ в отличие от пациентов с БА наблюдается ее снижение [8, 26].
У пациентов с характерными клиническими симптомами и нормальной функцией легких выявление неспецифической гиперреактивности бронхов (к метахолину, гистамину, дозированной физической нагрузке и др.) позволяет подтвердить диагноз БА. Вместе с тем наряду с высокой чувствительностью эти тесты имеют среднюю специфичность. Показано, что гиперреактивность бронхов встречается не только у пациентов с БА, но и у здоровых людей в пожилом возрасте, курильщиков, больных ХОБЛ и аллергическим ринитом [9, 22]. Иными словами, ее наличие не всегда позволяет дифференцировать БА и другие заболевания органов дыхания.
В популяционном исследовании показано, что объективная оценка функции легких при постановке диагноза БА выполняется менее чем у 50% пациентов пожилого и старческого возраста. Частота ее использования снижается до 42,0%, 29,0 и 9,5% у больных в возрасте 70–79, 80–89 и 90–99 лет соответственно [27]. Вместе с тем в нескольких работах показано, что подавляющее большинство пациентов преклонного возраста под руководством опытного медицинского персонала могут выполнять качественные и воспроизводимые маневры при спирографии и оценке диффузионной способности легких [28, 29].
Для подтверждения диагноза БА в ряде случаев используют цитологический анализ мокроты и концентрацию неинвазивных маркеров воспаления в выдыхаемом воздухе (оксида азота и др.). Установлено, что эозинофилия мокроты (>2%) и уровень FeNO как маркера эозинофильного воспаления дыхательных путей имеют высокую чувствительность, но среднюю специфичность [21]. Повышение их уровней может наблюдаться не только при БА, но и при других заболеваниях (например, при аллергическом рините). Напротив, нормальные значения этих показателей могут наблюдаться у курильщиков, а также пациентов с неэозинофильной астмой [30].
Таким образом, результаты исследований маркеров воспаления дыхательных путей при диагностике БА должны обязательно сопоставляться с клиническими данными.
Больные пожилого возраста характеризуются более выраженными признаками ремоделирования стенки бронхов (по данным компьютерной томографии) и признаками нарушения функции дистальных бронхов (по результатам импульсной осциллометрии и величине PEF [пиковая экспираторная скорость выдоха] 25–75) [24]. Предполагается, что эти изменения связаны как со старением легких, так и с морфологическими нарушениями, обусловленными БА.
Аллергологическое обследование пациентов важно для оценки роли экзогенных аллергенов в развитии БА. Показано, что атопическая БА у пожилых встречается реже, чем у молодых [24]. Это отражает возрастную инволюцию иммунной системы.
Для диагностики сопутствующих заболеваний (см. табл. 2) больным пожилого и старческого возраста следует выполнять клинический анализ крови, рентгенологическое исследование органов грудной полости в 2 проекциях и придаточных пазух носа, электрокардиограмму (ЭКГ), по показаниям – эхокардиографию [8].
Основные трудности диагностики БА в пожилом и старческом возрасте указаны в табл. 4.

Фенотипы и течение БА
Результаты наших собственнх исследований (табл. 5) свидетельствуют о том, что у пациентов старше 60 лет чаще, чем у больных молодого возраста, наблюдаются более тяжелое течение БА, фиксированная бронхиальная обструкция, низкий уровень контроля заболевания и сниженное качество жизни пациентов.
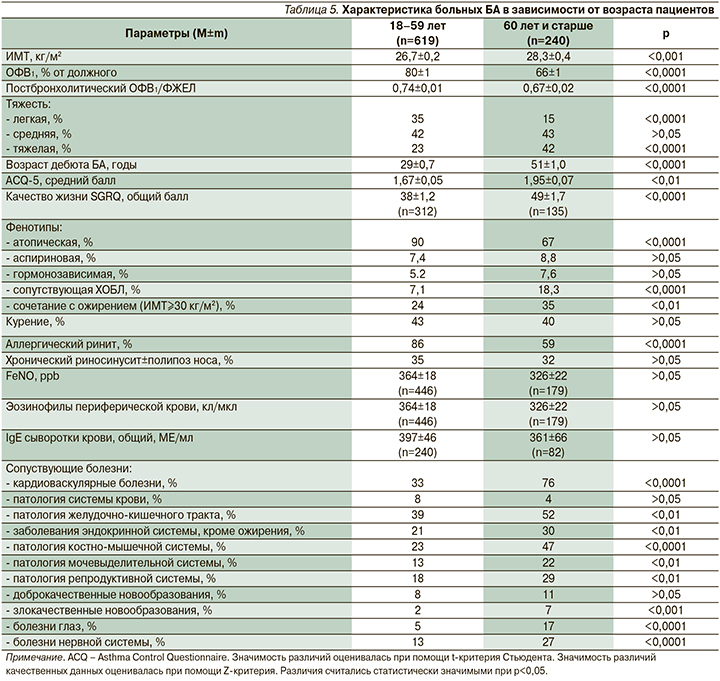
Атопическая БА и аллергический ринит у пожилых пациентов встречаются реже, чем у молодых. Вероятно, это отражает возрастную инволюцию иммунной системы. Вместе с тем полученные нами данные и результаты других исследований показывают, что у 50–75% больных старше 60 лет имеется гиперчувствительность как минимум к одному аллергену [31, 32]. Наиболее часто выявляется сенсибилизация к клещам домашней пыли, аллергенам кошек, плесневым грибам и тараканам [32–34]. Эти данные свидетельствуют о важной роли аллергологического обследования у больных пожилого возраста для выявления возможных триггеров обострений БА и их элиминации.
У пациентов в возрасте 60 лет и старше БА чаще сочетается с ожирением и ХОБЛ. По данным компьютерной томографии грудной клетки у них выявляется эмфизема легких. В отличие от изолированной ХОБЛ у них чаще (52%) отмечаются гиперчувствительность к ингаляционным аллергенам и высокий уровень FeNO [35, 36]. Вместе с тем уровни маркеров эозинофильного воспаления дыхательных путей (FeNO и эозинофилов крови) у пациентов с БА старше и моложе 60 лет существенно не различаются (табл. 5). Важной особенностью больных пожилого и старческого возраста является наличие сопуствующих заболеваний, среди которых ведущее место занимают болезни сердечно-сосудистой системы.
В ряде случаев БА служит причиной летального исхода. Известно, что около 50% смертей при БА наблюдаются у пациентов пожилого и старческого возраста [12, 37, 38]. Дополнительным фактором неблагоприятного течения БА в этой группе пациентов может быть депрессия [39].
Лечение БА
Целью лечения БА у пожилых пациентов стали достижение и поддержание контроля симптомов, нормального уровня физической активности, показателей функции легких, предупреждение обострений, побочных эффектов лекарственных препаратов и летальности [22].
Большое значение имеет обучение больных пожилого возраста и членов их семей. Каждый пациент должен иметь письменный план лечения. При встрече с больным необходимо оценивать выраженность симптомов его болезни, контроль БА, используемые лекарственные препараты, выполнение рекомендаций по элиминации триггеров обострений, наличие когнитивных нарушений. В нескольких исследованиях показано, что с возрастом увеличивается число ошибок при использовании ингаляторов и снижается восприятие правильности их применения [40, 41]. В связи с этим оценка ингаляционной техники и при необходимости ее коррекция должны проводиться во время каждого визита пожилых пациентов к врачу.
Фармакотерапия включает использование лекарственных средств для длительного контроля БА и быстрого купирования ее симптомов. Сту-пенчатое лечение БА в пожилом и страческом возрасте не отличается от такового у молодых [22]. К особенностям пожилых пациентов относятся сопутствующие заболевания, необходимость одновременного приема нескольких препаратов и снижение когнитивной функции, уменьшающее приверженность лечению и увеличивающее число ошибок при использовании ингаляторов.
При лечении пожилых пациентов ведущее место отводится ингаляционным глюкокортикоидам (ИГКС), чувствительность к которым c возрастом не снижается. Регулярная терапия этими препаратами показана, если больной использует бронхолитики быстрого действия 2 и более раз в месяц [22].
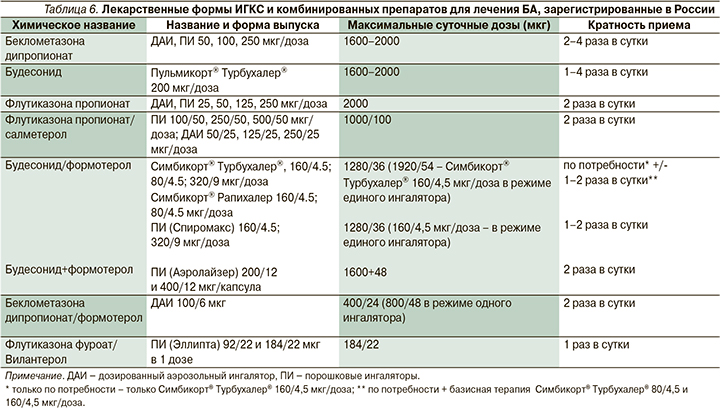
В многочисленных исследованиях показано, что ИГКС (табл. 6) уменьшают выраженность симптомов БА, повышают качество жизни пациентов, улучшают бронхиальную проходимость и гиперреактивность бронхов, предупреждают развитие обострений, снижают частоту госпитализаций и летальность [42, 43]. Следствием избыточного употребления КДБА является увеличение частоты обострений БА (при применении 3 и более ингаляторов в год) и вероятности летального исхода (при использовании 12 и более ингаляторов в год). Одной из проблем при регулярном использовании этих препаратов является низкая приверженность. Пациенты для контроля симптомов часто предпочитают монотерапию β2-адреномиметиками короткого действия (КДБА). Это стало одной из препосылок для создания новой концепции лечения легкой БА. Она заключается в интермиттирующем приеме комбинации ИГКС/бронхолитик быстрого действия: будесонид/формотерол (Симбикорт® Турбухалер®) и беклометазон пропионат/сальбутамол, причем назначение первой комбинации предпочтительнее. В нескольких крупных исследованиях показано, что интермиттирующий прием комбинации будесонид/формотерол (БУД/ФОРМ, Симбикорт® Турбухалер®) в течение 52 недель достоверно уменьшает число тяжелых обострений БА и улучшает ее контроль по сравнению с монотерапией КДБА. Частота обострений БА при использовании БУД/ФОРМ была такой же, как при регулярном лечении БУД, при этом кумулятивная доза последнего была существенно ниже [44–46].
Назначение комбинаций ИГКС/Формотерол и ИГКС/сальбутамол в режиме «по потребности» возможно пациентам как молодого, так и пожилого возраста. В настоящее время в международных и национальных рекомендациях из ступенчатого лечения полностью исключена монотерапия КДБА при легкой БА, что явилось самым значительным изменением, внесенным в эти документы за последние 30 лет.
Наиболее частыми побочными эффектами у людей пожилого возраста являются осиплость голоса, кандидоз полости рта, реже – пищевода, и кровоточивость кожи. Высокие дозы ИГКС могут способствовать прогрессированию имеющегося в пожилом возрасте остеопороза [2, 22].
Предупреждают развитие побочных эффектов использование спейсеров большого объема и порошковых ингаляторов (Турбухалер® и др.). Больным, получающим высокие дозы ИГКС, рекомендуется принимать препараты кальция, витамин D3 и биcфосфонаты для профилактики и лечения остеопороза [22].
В отношении пациентов с БА средней тяжести и тяжелого течения широко используется комбинация ИГКС с одним из β2-агонистов длительного действия (ДДБА): формотеролом, сальметеролом и вилантеролом. Совместное применение этих средств пожилыми больными БА обеспечивает более эффективный контроль БА, снижает частоту госпитализаций и летальных исходов в большей степени, чем монотерапия каждым из препаратов в отдельности [47]. В последние годы зарегистрированы фиксированные комбинации (табл. 6). Они более удобны, улучшают дисциплину больных и их приверженность лечению, гарантируют прием ИГКС вместе с бронхолитиками [22].
В клинических исследования, в которые включались пациенты пожилого возраста с астмой средней тяжести и тяжелого течения, показана возможность использования комбинации ИГКС/Формотерол (Симбикорт® Турбухалер® и др.) как для поддерживающей терапии (1–2 ингаляции 1–2 раза в сутки), так и для купирования симптомов БА «по потребности» [48–50]. Такой режим дозирования предупреждает развитие обострений, позволяет уменьшать суммарную дозу ИГКС и снижает стоимость лечения [51, 52].
Таким образом, в последние годы на примере комбинации будесонид/формотерол (Симбикорт® Турбухалер®) валидизирована концепция “противоспалительного” бронхолитика. Она заключается в использовани формотерола как бронхолитика быстрого действия и одновременной доставки ГКС – будесонида, титрование его дозы в соответствие с потребностями пациента и увеличение вероятности использования ИГКС у больных с низкой приверженностью к лечению и предпочитающими ситуационное применение КДБА. Результаты выполненных исследований обосновывают использование комбинации будесонид/формотерол (Симбикорт® Турбухалер®) на всех ступенях лечения БА как у пациентов молодого (начиная с 12 лет), так и пожилого возраста [22].
У пациентов пожилого и старческого возраста, имеющих сопутствующие заболевания сердечно-сосудистой системы, требуется осторожность при использовании β2-агонистов. Эти препараты необходимо назначать под контролем уровня артериального давления, частоты пульса, электрокардиограммы (интервал Q-T) и концентрации калия в сыворотке крови, которая может снижаться [53].
В последние годы убедительно доказано, что ДДБА (салметерол, формотерол и др.) должны использоваться больными БА только в сочетании с ИГКС [22].
Антилейкотриеновые препараты (зафирлукаст и монтелукаст) обладают умеренной противовоспалительной активностью. По влиянию на симптомы БА, частоту обострений и функцию легких они уступают ИГКС.
В некоторых исследованиях показано, что терапевтическая эффективность зафирлукаста с возрастом может снижаться [54, 55].
Антагонисты лейкотриеновых рецепторов, хотя и в меньшей степени, чем ДДБА, усиливают действие ИГКС [56]. Показано, что монтелукаст, назначаемый в дополнение к ИГКС, улучшает результаты лечения пожилых пациентов с БА [57, 58]. Отличительной особенностью антилейкотриеновых препаратов является простота их приема. В процессе лечения важно следить за состоянием ментального статуса больных из-за риска развития суицидальности [22].
Единственным длительно действующим холинолитиком, зарегистрированным в настоящее время для лечения БА тяжелого течения, является тиотропия бромид. Установлено, что его применение в дополнение к ИГКС/ДДБА оказывает умеренное бронхолитическое действие и увеличивает время до первого обострения [59]. Показано, что тиотропия бромид улучшает показатели функции легких и сокращает потребность в сальбутамоле у пациентов с ХОБЛ в сочетании с БА, получающих ИГКС [60].
В регистрационные клинические исследования включались и пожилые пациенты, имевшие сопутствующие заболевания. Хороший профиль безопасности препарата [59, 61] свидетельствует о возможности его использования для лечения БА у людей преклонного возраста.
Биологическая терапия предусматривает использование моноклональных антител, направленных против основных цитокинов, участвующих в развитии БА. Она требует тщательного отбора пациентов на основании клинических и биологических маркеров. Строгий отбор необходим, с одной стороны, для получения оптимального эффекта терапии, с другой, с целью избежать неоправданных затрат, поскольку использование биологических препаратов – это дорогостоящее лечение. В связи с этим лечение ими должно проводиться в специализированных центрах.
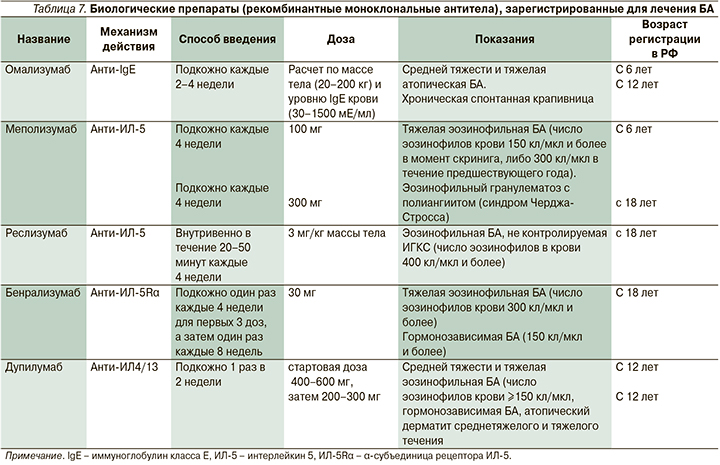
Препараты гуманизированных моноклональных антител к иммунглобулину E (омализумаб), интерлейкину-5 – ИЛ-5 (меполизумаб, реслизумаб) и к рецепторам ИЛ-5 (бенрализумаб) и ИЛ-4/13 (дупилумаб) уменьшают активность эозинофильного воспаления в дыхательных путях больных БА (T-2 эндотип заболевания). Они зарегистрированы для лечения тяжелой БА (табл. 7) и внесены в ступенчатую терапию [22]. Эти препараты снижают частоту обострений, улучшают контроль заболевания и качество жизни пациентов, повышают показатели функции легких, а также снижают потребность в системных ГКС у больных гормонозависимой БА.
В последнее время предложены алгоритмы их дифференцированного назначения [22].
Эффективность и безопасность этих средств для больных старше и моложе 60 лет были сходными. Полученные данные свидетельствуют о потенциальной возможности их применения у пациентов пожилого и старческого возраста без дополнительной коррекции дозы (https://www.accessdata.fda.gov/drugsatfda_docs/label/2017/761070s000lbl.pdf.) Вместе с тем эффективность биологических препаратов зависит от возраста начала БА. Так, омализумаб и дупилумаб наиболее эффективны в отношении пациентов с началом БА в детском возрасте, меполизумаб, резлизумаб и бенрализумаб – при дебюте в возрасте страше 40 лет [22]. Антагонист рецептора ИЛ-5 бенрализумаб (Фазенра®) отличается быстрым влиянием на уровень эозинофилов крови и удобством введения (табл. 7). Клинические исследования показали, что его влияние на частоту обострений тяжелой эозинофильной БА является стойким, не зависит от уровня IgE, а частота побочных эффектов сопоставима с группой плацебо [22].
Пациенты пожилого и старческого возраста чувствительны к побочным эффектам СГКС (табл. 8). В связи с этим следует избегать их длительного применения пациентами с тяжелой БА.

Среди лекарственных средств для купирования симптомов БА основное место занимают ингаляционные бронхолитики (КДБА и ипратопия бромид). Пациенты пожилого и страческого возраста часто используют их комбинации (беродуал и др).
Прием таблетированных теофиллинов (эуфиллин, теопэк и др.) и пероральных β2-агонистов (сальбутамол и др.) может приводить к развитию побочных эффектов (табл. 8). Из-за потенциальной токсичности они не должны применяться больными пожилого и старческого возраста [9, 12].
Для пациентов пожилого и старческого возраста большое значение имеет правильный выбор ингаляционного дозирующего устройства. Вероятность ошибок при использовании ингаляторов увеличивается с возрастом пациента в отсутствие его обучения и инструкций по применению [40, 63].
Нередко у пожилых пациентов снижена скорость вдоха, в связи с чем им бывает трудно использовать порошковые ингаляторы. Альтернативой в этом случае могут быть дозированные аэрозольные ингаляторы (ДАИ), к числу которых относится недавно зарегистрированный в России Симбикорт® Рапихалер. Он имеет удобный счетчик доз, позволяющий контролировать расход препарата, а также систему, предупреждающую случайное высвобождение дозы в виде специального защитного колпачка, прикрепленного гибким фиксатором к корпусу ингалятора. Его дозы эквиваленты Симбикорт® Tурбухалер® (табл. 6).
В масштабном рестроспективном иследовании реальной клинической практики было показано, что Сибикорт® Рапихалер в режиме регулярной терапии снижал частоту обострений БА в два раза эффективнее по сравнению с ФК салметерол флутиказона пропионат ДАИ (-0,15 против -0,07, 95% ДИ [0,85–0,99]; p=0,0255) [64]. Симбикорт® Рапихалер на сегодняшний день единственный зарегистрированный в РФ ДАИ будесонид/формотерол, что позволяет использовать его у пожилых людей со спейсером [65].
Принципы лечения обострений БА у пожилых не отличаются от таковых у людей более молодого возраста.
В связи с сопутствующими заболеваниями (артериальная гипертензия, сахарный диабет и др) предпочтительно использование ИГКС вместо системных глюкокортикоидов.
В последние годы в нашей стране накоплен большой опыт применения высоких доз будесонида (Пульмикорт® суспензии) через небулайзер для лечения обострений астмы в стационарных и амбулаторных условиях. Важно, чтобы сам пациент и члены его семьи умели правильно обращаться с таким устройством.
Для профилактики респираторных инфекций и снижения летальности от них рекомендуется ежегодная вакцинация против гриппа [22].
К сожалению, неправильное лечение БА служит частой проблемой для пациентов пожилого и старческого возраста. В нескольких исследованиях показано, что 39% пациентов не получают никакой терапии и лишь 21–22% используют ИГКС [8, 66]. Отсутствие их назначения было более частым в группе больных, которые наблюдались врачами общей практики и семейными врачами, по сравнению с теми, кто лечился у пульмонологов и аллергологов [67]. Многие пациенты пожилого и старческого возраста сообщали о проблемах общения с врачами [12]. Этому способствуют нарушения когнитивных функций пациентов.
Заключение
Таким образом, у больных пожилого возраста имеются важные особенности течения БА, связанные с инволютивными изменениями органов дыхания. У таких пациентов часто наблюдается более тяжелое течение болезни и отсутствие его контроля. Они имеют низкое качество жизни, более часто госпитализируются и умирают, чем люди молодого возраста. Трудности диагностики БА обусловлены снижением восприятия больными симптомов болезни и мультиморбидностью. В связи с этим большое значение имеет качественное исследование функции легких с тестом на обратимость обструкции. При длительном наблюдении большую роль играют обучение пациентов и членов их семьи, выявление и лечение сопутствующих заболеваний, учет лекарственных взаимодействий и побочных эффектов препаратов.


