Введение
Головокружение – это одна из самых распространенных жалоб пациента в рутинной практике врача-невролога. Только жалобы на боль остаются более частой причиной обращения за медицинской помощью. Традиционно разделение на системное и несистемное головокружение [1, 2]. Самой частой причиной системного головокружения у пациентов всех возрастных групп является доброкачественное позиционное пароксизмальное головокружение (ДППГ) [2, 3]. По данным различных авторов, на ДППГ приходится до 35% всех причин головокружения, примерно каждый третий человек старше 70 лет хотя бы раз испытывал приступ позиционного головокружения [2], а общая его распространенность в популяции составляет 2,4% [4].
По этиологии ДППГ можно разделить на две формы: идиопатическую, или дегенеративную (более 90% всех случаев), и симптоматическую, которая обычно обусловлена черепно-мозговой травмой или вестибулярным нейронитом, а также развивается при длительном постельном режиме (например, реанимационные пациенты). Патогенетическим субстратом ДППГ, согласно теории каналолитиаза, предложенной L.S. Parnes и J.A. McClure в 1991 г., является наличие свободно плавающих в эндолимфе полукружных каналов отолитовых частиц, отделившихся от отолитовой мембраны утрикулюса (эллиптический мешочек) [5]. Кроме того, существует теория купулолитаза, согласно которой приступ головокружения связан с перемещением неорганических частиц в области ампулы заднего полукружного канала, что вызывает дисфункцию купулы полукружного канала [6].
Клиническая картина ДППГ достаточно типична и неоднократно описана в литературе [2, 3, 7]. Редко, особенно у пожилых пациентов, клиническая картина ДППГ может быть атипичной, в частности быть без системного головокружения, а проявляться только эпизодами неустойчивости или быть без нистагма [8–10]. Несмотря на обычно типичную клиническую картину, заболевание часто остается нераспознанным и проводится неверное лечение [11]. Это может приводить к учащению рецидивов ДППГ [11]. Учитывая распространенность заболевания, проблемы, обусловленные неправильной диагностикой и лечением, ежегодные экономические затраты в США на одного пациента с ДППГ оцениваются в 2000 долл., хотя эти затраты можно значительно сократить [12].
Классическое лечение ДППГ проводится посредством применения спе-цифических лечебных маневров (Эпли, Семонта и др), а также с помощью вестибулярной гимнастики (упражнение Брандта–Дароффа) [2]. Согласно статистическим данным, эффективность лечебных маневров составляет более 90%. Однако заболевание может рецидивировать, что требует повторного визита к врачу с проведением лечебных маневров. Частота рецидивов варьируется, по данным разных авторов, при этом у женщин в течение года она достигает 58%, у мужчин – 39% [11, 13–14]. Причины рецидивов не совсем ясны. Возможно, стоит более внимательно отнестись к вопросам патогенеза ДППГ, в частности к нарушениям кальциевого обмена.
Дефицит витамина D в настоящее время – весьма «популярный» объект исследований, причем не только с точки зрения патологии опорно-двигательного аппарата, но и в качестве одной из возможных причин широкого спектра острых и хронических заболеваний (т.н. внекостные или неклассические эффекты витамина D) [15–16]. Ряд исследований показывает, что низкий уровень витамина D в сыворотке крови связан с повышенным риском развития сердечно-сосудистых заболеваний и сахарного диабета 1 и 2 типов, некоторых видов онкологических заболеваний, аутоиммунных заболеваний, заболеваний дыхательных путей [15], заболеваний нервной системы и психических расстройств [17–18]. Примером последнего являются исследования о взаимосвязи дефицита витамина D и депрессии. Мета-анализ когортных исследований показывает статистически значимое увеличение частоты депрессии у людей с дефицитом витамина D [19].
В контексте внекостных влияний витамина D существует много спорных вопросов, а наличие причинно-следственной связи между дефицитом витамина D и развитием какого-либо заболевания служит предметом дискуссий, активно продолжающихся и в настоящее время. К примеру, результаты одного из мета-анализов продемонстрировали, что применение витамина D связано со статистически значимым снижением общей смертности от всех причин [20], но повторный анализ данных с попыткой выделения самостоятельного влияния дефицита витамина D от сопутствующего приема препаратов кальция не подтвердил достоверности такой ассоциации [21].
Остается открытым вопрос: почему отолиты отделяются от отолитовой мембраны при идиопатическом ДППГ? Ряд независимых исследований выявил взаимосвязь между ДППГ и остеопорозом [22, 23], указывая, что наиболее выраженный дефицит витамина D встречается среди пациентов с рецидивирующими формами ДППГ [24]. По данным ряда авторов, назначение витамина D способствует улучшению функционального исхода у пациентов с ДППГ [25–26]. Вышеописанные данные становятся еще более весомыми, если учитывать, что среди больных ДППГ превалируют женщины в возрасте 50–70 лет [2, 4, 27].
Определенное значение могут иметь данные о химическом строении отолита (отоконии), который по своему химическому строению близок к костной ткани и основной неорганический матрикс которого состоит из карбоната кальция [24]. Известно, что отоконии состоят из центральной и периферической частей. Центральная часть (ядро) преимущественно состоит из органического матрикса, основу которого составляют гликопротеины. Периферическая часть, состоящая из полиморфного карбоната кальция, тесно встроена в отолитовую мембрану и связана белковыми нитями с киноцилиями ниже лежащих волосковых клеток. Формирование отокониев, окруженных эндолимфой, содержащей мало ионов кальция, является активно контролируемым процессом [28].
Однако данная теория в настоящее время требует доказательной базы. Некоторые исследователи отмечают, что, несмотря на выявленную взаимосвязь между дефицитом витамина D и ДППГ, обнаруженные изменения не коррелировали с полом и возрастом [22]. S.S. Kahraman et al. провели исследование пациентов с ДППГ, изучая ряд параметров костно-минерального обмена. При этом T-score (плотность костной ткани) по данным денситометрии, уровень ионизированного кальция, а также уровень сывороточного витамина D не коррелировали с наличием диагноза ДППГ, хотя пациенты имели повышенные уровни маркера формирования костного матрикса P1NP и маркера резорбции костной ткани бета-CrossLaps, являющихся маркером остеопороза и ремоделирования костной ткани [23].
В конце 2018 г. был впервые проведен мета-анализ взаимосвязи дефицита витамина D и ДППГ, суммировавший исследования, проведенные в течение последних 5 лет [29]. Данный мета-анализ включил 235 пациентов с ДППГ и 401 – группу контроля. Его результаты оказались достаточно спорными. Не было выявлено взаимосвязи между дефицитом витамина D и возникновением ДППГ, однако обнаружена взаимосвязь между низким уровнем дефицита витамина D и возникновением рецидивирующих форм ДППГ. Кроме того, авторы подчеркивают, что результат мог быть ненадежным из-за неоднородности основной и контрольной групп.
Таким образом, согласно данным литературы, дефицит витамина D может быть фактором риска ДППГ, вызывая более частые и интенсивные приступы головокружения и снижая эффективность традиционного лечения. Восполнение дефицита витамина D в свою очередь может приводить к уменьшению частоты рецидивов ДППГ и, соответственно, к улучшению качества жизни пациентов с данным заболеванием. В то же время ряд исследователей не подтверждают данную теорию, что делает вопрос взаимосвязи между дефицитом витамина D и развитием ДППГ объектом научного изучения.
Целью нашего исследования стало определение взаимосвязи между содержанием сывороточного 25(ОН)D, рецидивированием и тяжестью течения ДППГ.
Методы исследования
Нами было проведено ретроспективное клиническое исследование пациентов с ДППГ. Критериями исключения из исследования являлись смешанные формы головокружения (по данной причине в исследование не включались пациенты с функциональным головокружением), тяжелая сопутствующая соматическая или неврологическая патология, психические нарушения, прием препаратов витамина D, также из исследования исключались пациенты с симптоматическими формами ДППГ. Всего в исследование были включены 70 пациентов, разделенных на 2 группы, идентичные по демографическим показателям: 1-я (основная) группа – 40 пациентов с ДППГ, 2-я (контрольная) группа – 30 пациентов с прочими установленными заболеваниями вестибулярного характера (центрального и периферического генеза). Все пациенты основной группы были разделены на 2 подгруппы: 1-я подгруппа – пациенты с уровнем витамина D (25(ОН)D)≤12 нг/мл – 13 человек; 2-я – пациенты с уровнем дефицита витамина D >12 нг/мл – 27 человек.
Помимо стандартного неврологического осмотра с применением специфических вестибулярным проб (пробы на позиционное головокружение, исследование вестибулоокулярного рефлекса) проводилась оценка выраженности головокружения по шкале его оценки (Dizziness Handicap Inventory – DHI). Шкала DHI включает 25 вопросов с тремя вариантами ответов (да, нет, иногда). Ответ «да» оценивался в 4 балла, «иногда» – 2, «нет» – 0 баллов. Таким образом, суммарный балл по DHI может составлять от 0 (нет головокружения) до 100 (очень выраженное головокружение). Считается, что головокружение отсутствует, если суммарный показатель DHI ниже 14 баллов. При сумме баллов от 1 до 30 говорят о легком головокружении, от 31 до 60 – об умеренном, свыше 60 – о выраженном головокружении. Также применялась визуальная аналоговая шкала головокружения (ВАШГ) – аналог визуальной аналоговой шкалы боли. Дополнительно проводилась оценка по госпитальной шкале тревоги и депрессии (HADS) для скрининга этих явлений у пациента. При необходимости пациентам проводились магнитно-резонансная или компьютерная томографии головного мозга, видеонистагмография, аудиометрия, пациенты были консультированы оториноларингологом. Все пациенты исследовались на уровень витамина D крови (25(ОН)D) стандартным иммунноферментным анализом (ELISA), проведенным в лаборатории Инвитро, а также определялись уровни общего и ионизированного кальция, паратиреоидного гормона (паратгормон).
Статистическая обработка результатов исследования проводилась с использованием пакета прикладных программ Statistica 10.0 с учетом двух особенностей: 1) полученные результаты отличаются от нормального распределения (для чего использовался тест Колмогорова–Смирнова); 2) небольшой объем выборки (в понимании математической статистики). В связи с этим были использованы непараметрические методы и параметры. В качестве описательных параметров использовались Ме – медиана (оценка середины выборки), Мин, Макс – минимальное и максимальное значения выборки, LQ и UQ – квартили нижний (25%) и верхний (75%), характеризующие размах выборки (аналог среднеквадратичного отклонения для нормального распределения), интерквартильный размах. Для выявления различий данных между группами использовался рекомендованный критерий непараметрической статистики – критерий Вилкоксона–Манна–Уитни или U-критерий Манна–Уитни. Данный критерий используется для проверки нулевой гипотезы при распределении в вариационных рядах, отличных от нормального. В результате получаем 3 уровня достоверности, при которых отвергается нулевая гипотеза о равенстве распределений: p≤0,05 – различия достоверны. Наличие корреляционных связей выявлялось с помощью коэффициента ранговой корреляции Спирмена. Данный метод также непараметрический, что позволяет его использование при распределении, отличном от нормального, для оценки силы, направления и тесноты связи между исследуемыми явлениями. Сила связей определялась с использованием шкалы Чеддока, где теснота r<0,1 расценивается как незначимая, r=0,1–0,3 – слабая; r=0,3–0,5 – умеренная; r=0,5–0,7 – заметная; r=0,7–0,9 – высокая; r=0,9–0,99 – весьма высокая.
Результаты и обсуждение
Общая группа обследованных пациентов с вестибулярными расстройствами составила 70 человек в возрасте 25–89 лет (Ме=60,5 [45,0; 67,0]). Пациенты основной группы, страдавшие ДППГ, составили 40 человек в возрасте 25–89 лет (Ме=60,5 [46,5; 67,0]; табл. 1). Группу контроля (пациенты с прочими вестибулярными нарушениями периферического и центрального генеза) составила 30 человек, сопоставимых с первой группой по полу и возрасту (табл. 1).
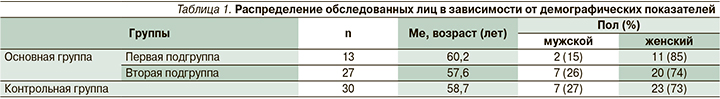
Распределение нозологий в группе контроля представлена на рис. 1. Обращает внимание большой процент пациентов с вестибулярным нейронитом и инсультом, вероятно, это связано с особенностями набора больных в условиях отделений неотложной неврологии и острого сосудистого центра.
Соотношение женщин и мужчин в группе пациентов с ДППГ составило 3,5:1, а именно 31 (78%) женщина и 9 (22%) мужчин, что слегка превышает среднестатистические мировые показатели, где соотношение женщин и мужчин с ДППГ колеблется на уровне 2–3:1 [2, 29].
Наибольшая встречаемость ДППГ составила в возрасте 50–70 лет. При этом у 2 пациентов (1 мужчина и 1 женщина) заболевание развилось в возрасте до 30 лет. Среди обследованных лиц у 39 из 40 пациентов клиническая картина ДППГ была классической, у одной заболевание протекало без характерного системного головокружения: больная жаловалась только на шаткость при переходе из горизонтального в вертикальное положение и тошноту. В 52% случаев выявлялось поражение правой стороны, в 40% – левой. В 8% случаев имело место сочетанное поражение. Согласно данным литературы, для ДППГ характерно преобладание правостороннего поражения [3, 35]. У троих пациентов диагностировано поражение горизонтального полукружного канала. Таким образом, у 85% больных выявлено поражение заднего полукружного канала, у 15% – поражение горизонтального полукружного канала или двустороннее поражение (т.н. атипичные формы ДППГ). Это соотносится с данными литературы, согласно которым частота атипичных форм ДППГ составляет, по данным различных авторов, 6,8–20% [2, 30].
На момент включения в исследование все пациенты, согласно данным анамнеза, были распределены по количеству рецидивов заболевания следующим образом: 1 обострение (дебют заболевания), ≥2 обострений (рецидивирующие формы ДППГ). Количество пациентов с рецидивами заболевания составило 45%, что несколько выше среднестатистических мировых показателей, в соответствии с которыми процент рецидивов составляет 20,5–37% [3], хотя в некоторых исследованиях он достигает 56% [2]. Примечателен тот факт, что, согласно мировым данным, процент рецидивов ДППГ меньше в более современных исследованиях. В международных клинических рекомендациях по ДППГ от 2008 г. частота рецидивов составляет 37–50%, в то время как в новых рекомендациях от 2017 г. – 36% [3]. У мужчин рецидивы заболевания случались в 33% случаев (у 3 из 9), у женщин – в 48% (у 15 из 31). Таким образом, в нашей выборке пациентов с ДППГ выявлен больший процент рецидивов головокружения, что, на наш взгляд, может быть связано с дефектами диагностики заболевания.
Исследование параметров кальциевого обмена показало статистически значимое различие между пациентами основной и контрольной групп в уровне витамина D. При этом можно сделать следующий вывод: низкие уровни витамина D связаны с развитием ДППГ. По остальным параметрам кальциевого обмена статистически значимые различия отсутствовали (табл. 2).
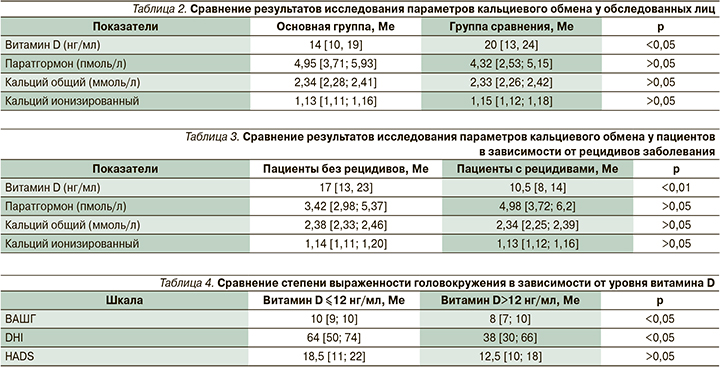
Далее пациенты с ДППГ были разделены на две подгруппы: с дебютом заболевания (n=22) и с его рецидивирующим течением (n=18; табл. 3).
Как следует из табл. 3, у пациентов с рецидивами ДППГ имеет место высокий уровень статистической значимости различия (р<0,01) содержания витамина D по сравнению с группой лиц без рецидивов, что означает, что дефицит витамина D вызывает рецидивирующие формы заболевания.
Таким образом, резюмируя представленные выше данные, можно сделать вывод: низкое содержание витамина D служит фактором риска развития ДППГ, особенно рецидивирующего течения.
Все пациенты с ДППГ были разделены на 2 подгруппы: с уровнем витамина D ≤12 нг/мл (n=14) и с уровнем дефицита витамина D >12 нг/мл (n=26). Всем пациентам проведено тестирование по шкалам ВАШГ, DHI и HADS.
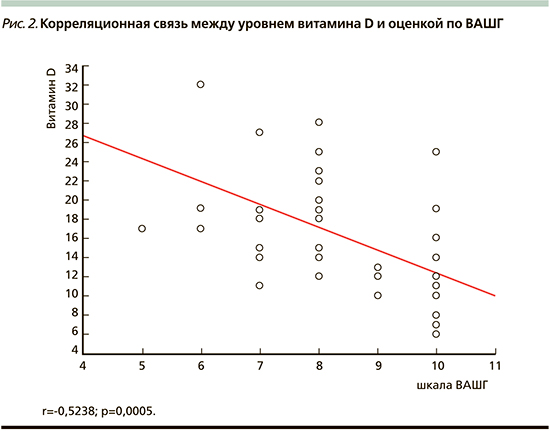
При оценке степени выраженности головокружение по ВАШГ прослеживается статистически значимое различие интенсивности приступов головокружения у пациентов с более низкими показателями уровня витамина D (табл. 4). Большинство пациентов с уровнем витамина D ≤12 нг/мл оценивали интенсивность приступов в 10 баллов. Выявлена значимая корреляционная связь (r=0,52) между уровнем витамина D и интенсивностью приступов головокружения (рис. 2). При этом пациенты с уровнем витамина D≤12 нг/мл чаще испытывали выраженное головокружение, т.е. набирали по шкале DHI более 61 балла (рис. 3). Выявлена умеренная корреляционная связь (r=0,38) между уровнем витамина D и выраженностью головокружения (рис. 4).
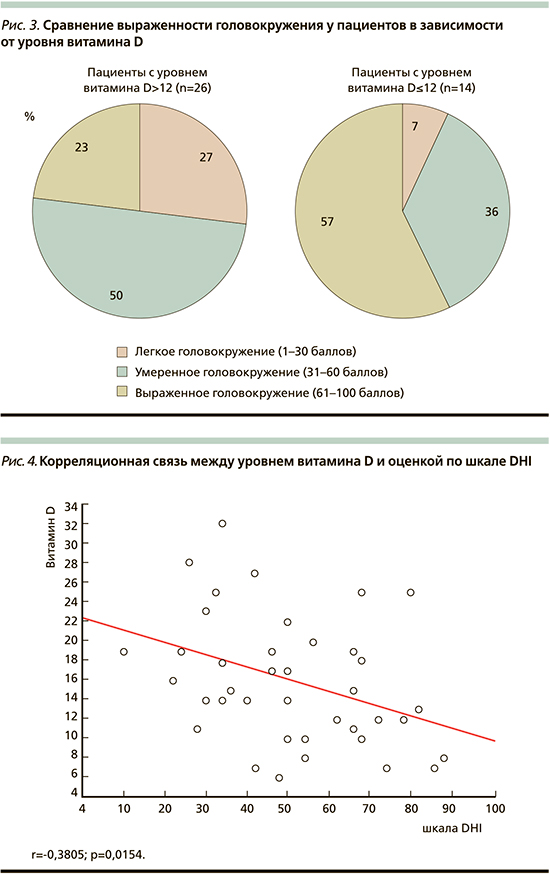
Выявлена умеренная корреляционная связь (r=0,38) между уровнем витамина D и выраженностью головокружения (рис. 4).
Исходя из полученных данных, можно сделать следующий вывод: у пациентов с уровнем витамина D ≤12 нг/мл (выраженный дефицит) приступы ДППГ более интенсивные и приводят к большей степени выраженности симптомов головокружения.
Заключение
Таким образом, резюмируя результаты нашего исследования, можно сделать следующие выводы:
- Пациенты с ДППГ имеют более низкий уровень сывороточного витамина D, чем пациенты с прочими формами системного головокружения (р<0,05).
- У пациентов с рецидивирующими формами ДППГ уровень витамина D ниже, чем у пациентов с нерецидивирущим ДППГ (р<0,01).
- Уровень витамина D ≤12 нг/мл определяет более тяжелое течение заболевания у пациентов с ДППГ.
Исходя из вышесказанного, представляется целесообразным определение витамина D у пациентов с рецидивирующими формами ДППГ и восполнение дефицита витамина D при его выявлении, особенно у лиц с рецидивирующими формами заболевания.


