Введение
Более 80% пациентов после перенесенного мозгового инсульта имеют инвалидизацию различной степени выраженности. С увеличением числа выживших возрастает число нетрудоспособных лиц, нуждающихся в реабилитации [1]. В настоящее время подходы к реабилитации больных после инсульта многообразны и включают восстановление как двигательных расстройств, так и высших психических функций [2]. Среди причин, ограничивающих повседневную активность пациентов, ведущее место занимает сложный полиморфный двигательный дефицит различного характера и степени выраженности, который приводит к снижению скорости ходьбы, асимметрии походки, трудности адаптации походки к меняющимся условиям, повышенным энергозатратам, нарушениям статического и динамического баланса [3]. Развивающиеся вследствие пареза изменения опорно-двигательного аппарата в виде нарушений осанки, ограничения движений в суставах здоровой и пораженной конечностей, нарушенных взаимоотношений звеньев и рычагов двигательно-механической системы тела человека обусловливают расстройства равновесия, повышают риск падений, ведут к низкому уровню активности и участия пациентов с инсультом [3–5]. Нарушения функции ходьбы ассоциируются со снижением качества жизни и риском преждевременной смерти [1–6].
Нарушения походки формируются примерно у 80% пациентов уже в первые 3 месяца после инсульта [7]. Опороспособность человека определяется двумя компонентами: состоянием опорно-двигательного аппарата (в первую очередь это поясничный отдел, таз и нижние конечности); удержанием равновесия благодаря содружественной активности проприоцептивного, зрительного, вестибулярного анализаторов при координирующей роли мозжечка. Функция баланса напрямую связана с возможностью передвижения, является предиктором достижения способности ходить [8, 9] и потенциально модифицируется физической активностью [9–11].
К числу факторов, оказывающих отрицательное влияние на эффективность реабилитационных мероприятий у больных инсультом и ухудшающих функциональный прогноз заболевания, относятся постинсультные когнитивные нарушения (КН) и эмоциональные расстройства (немоторные проявления синдрома верхнего мотонейрона) [12].
Депрессия является наиболее распространенным эмоциональным расстройством и отсроченным психосоциальным последствием инсульта, оказывающим отрицательное влияние на восстановление повседневной активности и качество жизни [13]. Более того, наличие депрессии снижает выживаемость после инсульта. Так, у пациентов с депрессией смертность в течение года после инсульта на 50% выше, чем у пациентов без депрессии. Согласно последним опубликованным в литературе данным, депрессия зарегистрирована у 33% выживших после инсульта, хотя достоверные оценки частоты и распространенности депрессии в популяции больных инсультом ограничены. Развитие депрессии снижает мотивацию к участию в реабилитационных мероприятиях, затрудняет их проведение и эффективность восстановления неврологического дефицита и функционирования пациента. Депрессивные расстройства, появляющиеся после инсульта, снижают адаптацию больного к новому образу жизни, прежде всего оказывая неблагоприятное влияние на качество и количество его социальных связей. Кроме того, психические расстройства после инсульта служат основным потенциально регулируемым фактором, определяющим качество жизни пациентов [14].
КН встречаются более чем у трети выживших после инсульта в период 3 и 12 месяцев, характеризуются нарушениями в нескольких областях когниции, включая внимание, скорость обработки информации, исполнительную функцию, вербальную и визуальную память, язык и восприятие. Клиническая значимость постинсультных КН заключается прежде всего в ухудшении прогноза пациентов, перенесших инсульт [14]. По данным О.С. Левина и соавт., наличие КН, даже не достигших степени деменции, считается неблагоприятным прогностическим фактором, предвещающим более плохое восстановление неврологических функций и функционального статуса [15].
Все вышеперечисленные нарушения негативно сказываются на функции ходьбы и приводят к изменению образа жизни пациентов. Данные Кокрейновского обзора по мониторингу объективной активности продемонстрировали пассивность образа жизни пациентов, перенесших инсульт, по сравнению с сопоставимыми по возрасту здоровыми лицами. Более 80% времени у пациентов с инсультом тратятся на сидячий образ жизни [16], следствием чего становится дальнейшее снижение кардиореспираторных резервов и общей выносливости.
Таким образом, комплексное применение медикаментозных и немедикаментозных методов лечения в составе индивидуальных реабилитационных программ служит необходимым условием для эффективного восстановления двигательных функций, формирования новой моторной программы, сенсомоторного переобучения, улучшения функционирования, активности и участия пациентов, перенесших инсульт, в повседневной жизни.
В связи с этим используют физические факторы, воздействующие как непосредственно на головной мозг, так и на сегментарные и периферические структуры нервно-мышечного аппарата.
Эффективным методом улучшения постинсультных двигательных нарушений является дозированная физическая нагрузка, что связано с формированием новых реципрокных и межполушарных связей, активацией процессов нейропластичности [17]. Основываясь на принципах статолокомоторной реабилитации, физическая нагрузка должна быть двусторонней и эмоционально ярко окрашенной с вовлечением в процесс реабилитации зрительного и слухового анализаторов. Все это реализуется в процессе тренинга пациента на стабилометрической платформе с использованием биологической обратной связи (БОС) [8].
БОС-стабилометрический тренинг на опорной стойке позволяет осуществлять направленную коррекцию двигательных функций, нарушенного постурального баланса под объективным контролем визуальной и проприоцептивной обратной связи. Стабилометрическое исследование дает возможность оценить баланс тела, исследовать качество функции равновесия и определить вклад различных систем в поддержании вертикальной стойки у конкретного пациента: вестибулярные механизмы удержания равновесия и двигательной активности, функцию проприоцептивной системы, зрительного анализатора и других систем организма, прямо или косвенно влияющих на постуральные реакции. При этом пациент получает визуальную информацию о положении центра тяжести, стоя на стабилометрической платформе [8]. В ходе стабилометрического тренинга решаются задачи восстановления, развития опороспособности конечностей, управления движениями тела и его балансом, тренировки точности движений, времени движений (достижение цели к определенному времени), стабилизации движений (удержание центра давления в определенной зоне определенное время).
Реабилитационный комплекс включает использование индивидуальных методик кинезиотерапии, массажа, электростимуляции, рефлексо-, психотерапии и медикаментозную коррекцию постинсультных состояний.
В соответствии с современными представлениями о реабилитационном процессе, базируясь на международной классификации функционирования, фармакотерапия относится к факторам поддержки реабилитационного процесса [18]. Наряду с базисной терапией и терапией, направленной на вторичную профилактику инсульта, проводится специфическая патогенетическая терапия в зависимости от подтипа инсульта, в т.ч. коррекция нарушенных эмоциональных и когнитивных функций [18–21].
Наличие у больного депрессивной симптоматики требует не только своевременной диагностики, но и выбора эффективного препарата. Сложности терапии обусловлены высокой коморбидностью пациента, перенесшего инсульт, необходимостью учитывать возможность взаимодействия антидепрессанта с другими медикаментозными средствами, направленными на коррекцию сопутствующей соматической патологии. Кроме того, имеющиеся постинсультные КН требуют применения препаратов с минимальным холинолитическим действием, поскольку дефицит уровня ацетилхолина усугубляет нарушения памяти, внимания, речи [13].
В связи с этим особый интерес представляет включение в комплексную программу реабилитации антидепрессанта вортиоксетина – представителя нового фармакологического класса антидепрессантов с мультимодальным механизмом действия и доказанным независимым прокогнитивным эффектом. Согласно результатам многочисленных исследований, вортиоксетин – антидепрессант сбалансированного действия и не вызывает астенических нарушений, не влияет на способность управлять транспортным средством, не имеет синдрома отмены, не провоцирует расстройства сна и не вызывает увеличения массы тела при длительном применении, а также не нарушает сексуальных функций [14, 22, 23].
Таким образом, интеграция нового антидепрессанта в реабилитационный процесс перспективна для получения результатов высокого уровня. Представляет интерес изучение влияния вортиоксетина на восстановление эмоциональных и двигательных функций пациентов, перенесших инсульт, при включении его в схемы реабилитационных программ в восстановительном периоде ишемического инсульта (ИИ) на амбулаторном этапе.
Цель исследования: оценить эффективность комплексной реабилитационной программы с включением БОС-стабилометрического тренинга e пациентов с постинсультными двигательными, эмоциональными и когнитивными нарушениями и нового антидепрессанта вортиоксетина в позднем восстановительном периоде ИИ.
Методы
Проведено рандомизированное клиническое открытое контролируемое исследование. В исследование были включены 110 пациентов в позднем восстановительном периоде ИИ; из них 43 (39,1%) мужчины, 67 (60,9%) женщин в возрасте от 38 до 72 лет (средний возраст – 58,0±9,74 года). Давность перенесенного инсульта находилась в диапазоне от 181 до 352 дней, составив в среднем 228,59±31,9 дня; преобладали пациенты (70,9%) с давностью инсульта 180–270 дней. Диагноз был подтвержден методами нейровизуализации (компьютерная или магнитно-резонансная томография головного мозга): у 46 (41,8%) обследованных больных зафиксированы признаки перенесенного инфаркта головного мозга в бассейне правой средней мозговой артерии; у 53 (48,2%) – в бассейне левой средней мозговой артерии; у 11 (10%) выявлены очаги в стволе мозга и в мозжечке.
Все пациенты предъявляли жалобы на слабость и ограничение движений в конечностях на стороне гемипареза: правосторонний гемипарез наблюдался у 62 (56,4%) пациентов, левосторонний – у 48 (43,6%). Нарушение опороспособности и переноса пораженной конечности отмечалось в 100% случаев; у 38,1% пациентов был нарушен перекат стопы; 41,8% пациентов пользовались дополнительными средствами опоры. Также при неврологическом осмотре больных выявлялись координаторные (77,3%), чувствительные (88,2%) нарушения и речевые расстройства в виде элементов моторной афазии у 21 (19%) пациента, сенсорной – у 9 (8,2%); смешанной афазии – у 2 (1,8%). Когнитивные изменения отмечены у 73 (66,4%) больных со средним баллом по шкале MoCA 22,5±1,15.
У большинства пациентов диагностировались следующие коморбидные заболевания. Артериальная гипертензия наблюдалась у 107 (97,2%) пациентов. Диагноз ишемической болезни сердца был выставлен 65 (59%); стенокардии напряжения – 57 (51,8%); мерцательной аритмии – 36 (32,7%) пациентам; хроническая сердечная недостаточность (по классификации Нью-Йоркской ассоциации кардиологов – NYHA, 1995) I и II стадий наблюдалась у 37 (33,6%) и 22 (22,7%) пациентов соответственно. Среди исследуемых больных 23 (20,9%) человека страдали сахарным диабетом 2 типа. К началу исследования соматическое состояние всех больных соответствовало таковому ремиссии или компенсации.
В исследование не включались пациенты с глубокой степенью двигательного дефицита; тотальной афазией; выраженными КН; эпилепсией; тяжелыми декомпенсированными или нестабильными соматическими заболеваниями.
Пациентам проводилось полное неврологическое обследование с комплексной оценкой функции движения: определение степени пареза по 6-балльной системе оценки двигательных нарушений Британского совета медицинских исследований (Harrison): 0 баллов соответствует отсутствию пареза, 5 баллов – наличию плегии; оценка постуральных нарушений по шкале Тинетти; исследование биомеханики движений.
Биомеханическое исследование выполняли на комплексе для диагностики, лечения и реабилитации «Траст-М» (ООО «Неврокор», Москва). Применялись методики анализа основной стойки – стабилометрия. Для анализа были использованы стабилометрические параметры: координаты общего центра давления (ЦД) во фронтальной (X) и сагиттальной (Y) плоскостях в мм; площадь статокинезиограммы (s95) в мм2 и средняя скорость движения общего центра давления (V) в мм/c; энергоиндекс (Ei).
Для коррекции равновесия и двигательных нарушений использовался метод тренировки на стабилоплатформе в режиме БОС с применением комплекса для диагностики, лечения и реабилитации «Траст-М» (ООО «Неврокор», Москва). Использовалась проба Ромберга по европейскому варианту установки стоп (пятки вместе, носки разведены на угол в 30°) в 2 фазы: с открытыми (ОГ) и закрытыми (ЗГ) глазами. Каждая фаза исследования проводилась в течение 30 секунд. В случаях, когда требовалось сравнение с нормой, были использованы общие нормативные величины, предложенные Д.В. Скворцовым [8]. БОС-тренинг проводился с использованием статического («Мишень») и динамического («Человек») тестов с экспозицией по 20–30 минут с учетом индивидуальной переносимости нагрузок 3 раза в неделю на протяжении 8 недель. Тренировка выполнялась в первой половине дня перед проведением функциональной электростимуляции для минимизации воздействия внешних факторов. По окончании курса БОС-тренинга проводилась контрольная стабилометрия в динамике.
Когнитивный статус был обследован по Монреальской шкале оценки когнитивных функций (MоCA). Для оценки степени выраженности тревожных и депрессивных расстройств использовалась Госпитальная шкала тревоги и депрессии HADS.
Поскольку предполагаемое улучшение двигательной активности взаимосвязано с повышением активности в повседневной жизни и функциональной независимостью, проводилась оценка по шкале Бартел с анализом каждого ее раздела. Кроме того, исследовалось качество жизни пациентов по Европейскому опроснику качества жизни – EuroQol EQ-5D-5L (version 1.0, 2011; в сочетании с визуализирующей аналоговой шкалой).
Обследование проводили исходно, до начала терапии (1-й визит), через 2 недели терапии (2-й визит), через 4 недели терапии (3-й визит), через 8 недель (4-й визит) и через 12 недель от начала реабилитационного курса (5-й, окончательный визит).
Программа реабилитации для всех пациентов включала медикаментозную терапию, согласно стандарту специализированной медицинской помощи при инфаркте мозга [24], терапию, направленную на вторичную профилактику инсульта, лечебную физкультуру, механотерапию, стабилотреннинг с БОС, массаж паретичных конечностей, индивидуальную и групповую психотерапию, посещение школ профилактики инсульта. Также пациенты самостоятельно по индивидуально подобранной программе выполняли ежедневные домашние занятия длительностью 40 минут–1 час.
Во время исследования не назначали ингибиторы моноаминоксидазы, нейролептики, трициклические антидепрессанты.
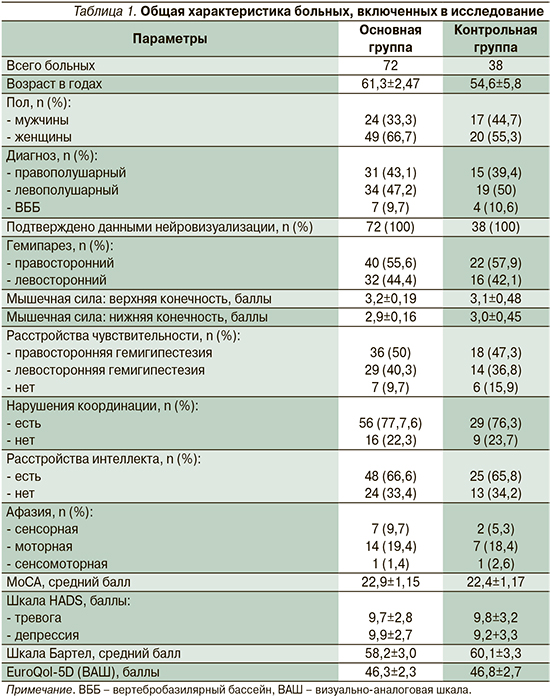
В зависимости от программы реабилитации все пациенты были рандомизированы в две группы, сопоставимые по полу, возрасту, клиническим проявлениям. Основную группу (I группа) составили 72 пациента с ИИ, которые наряду с немедикаментозной реабилитационной программой получали вортиоксетин. Вортиоксетин применяли внутрь однократно утром перед приемом пищи в течение 12 недель. Суточная доза в первые 3 дня терапии составила 5 мг с последующим повышением до 10 мг в сутки. Группу контроля (II группа) составили 38 пациентов с ИИ, получавших программу комплексной реабилитации, в которую не включали вортиоксетин. Клиническая характеристика пациентов представлена в табл. 1.
Переносимость вортиоксетина пациентом оценивалась в основной группе на 2–5-м визитах. Эффективность терапии в обеих группах – на 3-м, 4-м и заключительном визитах.
Результаты исследований заносились в индивидуальный протокол и в дальнейшем статистически обрабатывались с использованием программ Excel, EpiStat и Statistica 13.0. Описательная статистика при нормальном распределении признака (в соответствии с результатами теста Колмогорова–Смирнова) была представлена в виде среднего значения и средней ошибки средней арифметической (M±m), а также в виде медианы (Ме). Описательная статистика качественных признаков выражалась в виде абсолютных и относительных частот (процентов). Для сравнения двух независимых групп по одному признаку применяли χ2-критерий. Статистически значимыми различия считались при р<0,05.
Результаты
В исходном состоянии у 72 (65,5%) больных I группы и 38 (34,5%) II выявлен центральный парез, степень выраженности которого соответствовала легкой и средней степеням тяжести.
Биомеханическое обследование пациентов обеих групп выявило снижение стабильности, что сопровождалось отклонением ЦД на здоровую сторону. Положение ЦД в сагиттальной плоскости характеризовалось смещением вперед на величину около 9 мм; колебания ЦД превышали норму как во фронтальной, так и в сагиттальной плоскостях; площадь статокинезиограммы превышала норму в обе фазы исследования. Энергозатраты пациентов были увеличены, особенно в фазу ЗГ. Увеличение среднеквадратичного отклонения ЦД в сагиттальной плоскости и площади статокинезиограммы стало инструментальным подтверждением наличия у пациентов нарушения баланса. У пациентов с парезом мышц нижней конечности значительное изменение среднеквадратичного отклонения ЦД во фронтальной плоскости расценивалось как маркер патологической позы – с переносом центра тяжести на здоровую «непаретичную» конечность или в некоторых случаях, наоборот, на пораженную конечность при умеренно выраженной степени спастичности.
При оценке постуральных нарушений по шкале Тинетти легкие двигательные нарушения выявлялись в 62,7, умеренные – в 37,3% случаев.
При проведении тренингов на стабилометрической платформе игровое поведение больных основной и контрольной групп различалось в зависимости от выраженности исходного статолокомоторного дефекта. Пациенты с легкими постуральными нарушениями быстрее адаптировались к предлагаемым заданиям, их скорость и качество выполнения заданий были выше, быстрее достигалось улучшение показателей, нежели у пациентов с более грубыми нарушениями статики. При сходной выраженности постинсультного двигательного дефицита пациенты различались в способности к удержанию равновесия. Это коррелировало с наличием мнестических расстройств, ухудшающих процесс понимания задания, координирования работы мышечных групп и как следствие – затруднения в выполнении требуемых действий.
Под влиянием реабилитационных программ отмечено уменьшение степени пареза в конечностях, вовлечение нижней конечности в процесс ортостаза, уменьшилась разница выраженности сухожильных рефлексов, выраженность вестибулоатактического синдрома, нормализовались координаторные пробы и устойчивость в позе Ромберга. По окончании курса реабилитации увеличение мышечной силы в среднем составило 0,5–1,0 балл для пациентов обеих групп, у 54,7% пациентов в момент проведения процедуры была более правильная постановка стопы на опору.
Постуральные нарушения. Клини-ческий регресс выраженности симптоматики локомоторного характера подтверждался результатами повторного тестирования познотонических расстройств по шкале Тинетти. У пациентов основной группы легкие и умеренные статолокомоторные нарушения выявлены в 52,3 и 9,5% случаев; у 38,2% регистрировалась нормальная двигательная активность. В контрольной группе эти цифры составили 68%, 12 и 20% соответственно. При повторной оценке постурологических показателей в основной и контрольной группах в процессе комплексной реабилитации с применением БОС-стабилометрического тренинга получены положительные результаты (табл. 2).
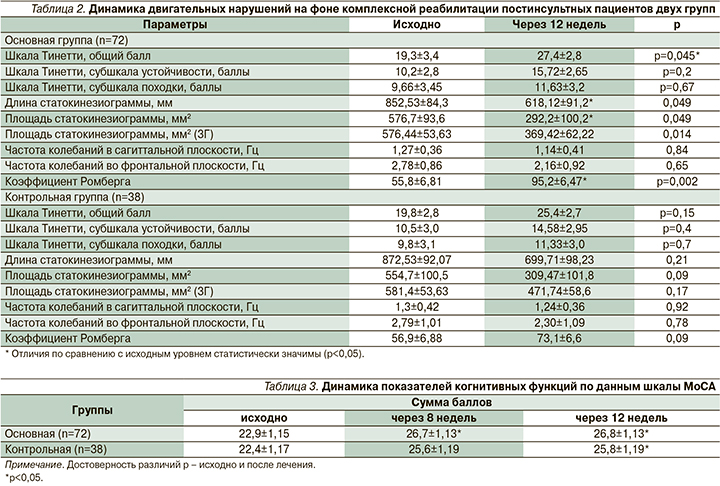
К 12-й неделе наблюдения имело место уменьшение площади статокинезиограммы и снижение отклонения общего ЦД в сагиттальной плоскости, что можно рассматривать как объективное увеличение устойчивости пациентов. Уменьшился коэффициент Ромберга, что свидетельствовало о восстановлении глубокой проприоцептивной чувствительности и увеличении ее доли информации в контроле стояния. Таким образом, перестройка стабилограммы совпадала с клиническим регрессом статолокомоторных нарушений.
В основной группе основные показатели статокинезиограммы достигали статистической значимости (р<0,05): выравнивался ЦД в обеих плоскостях (достоверно по оси Х), уменьшилась площадь статокинезиограммы, снизилась скорость движения ЦД, достоверно нормализовался коэффициент Ромберга, что также свидетельствовало об уменьшении пареза и возрастании общей устойчивости пациентов.
Когнитивные функции. Исходно умеренные КН и деменция легкой степени выявлены у 74 (66,1%) больных. Средний балл по шкале МоСА в I группе составил 22,9±1,15; во II группе – 22,4±1,17. В обеих группах отмечались нарушения способности быстрой ориентации в меняющейся обстановке, концентрации внимания при выполнении тестов. Выявлено снижение памяти, особенно на текущие события, замедленность мышления, быстрая истощаемость при напряженной умственной работе, сужение круга интересов. Нарушения памяти носили модально-неспецифический характер.
Под влиянием терапии отмечена достоверная положительная динамика показателей нейродинамических (p<0,05) и регуляторных функций (p<0,05) в основной группе пациентов. Позитивные изменения памяти отмечены с 8-й недели терапии и сохранялись на протяжении всего периода наблюдения, оставаясь статистически значимыми к концу исследования (табл. 3). Суммарный балл шкалы МоСА в группе контроля также нарастал в процессе реабилитации, однако темпы роста и степень прироста балла существенно отставали от показателей основной группы пациентов.
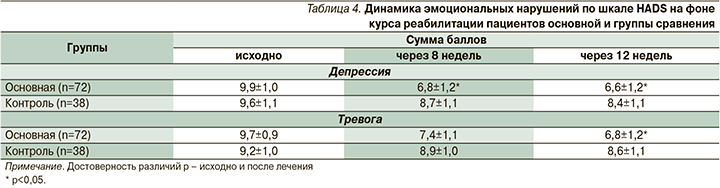
Эмоциональные нарушения. При изучении эмоциональных нарушений у большинства больных, перенесших ИИ, обнаружено наличие тревожных и депрессивных расстройств различной степени выраженности. Оценка по шкале HADS выявила 71 (64,5%) пациента с легкими тревожными и депрессивными расстройствами.
Большей частью умеренные расстройства тревожно-депрессивного спектра наблюдались у пациентов с более грубыми двигательными нарушениями, снижающими повседневную активность и возможность к самообслуживанию. Пациенты предъявляли жалобы на неприятные ощущения, страх, опасения за невозможность реализации себя как личности, потерю лидерства в семье и профессиональной непригодности из-за перенесенного заболевания.
Средний показатель выраженности депрессии у больных I группы до начала комплексной терапии составил 9,9. Средний показатель выраженности депрессии у больных II группы исходно равнялся 9,6 балла.
Анализ динамики эмоционального состояния по шкале HADS показал снижение суммарного числа баллов по подшкале «депрессия» у 53 (73,6%) пациентов I группы к 8-й неделе терапии до средних показателей 6,8. Это ниже диагностического показателя субклинической депрессии (8 баллов). В дальнейшем прослеживалась стабилизация состояния и сохранение положительной динамики показателей депрессии у пациентов, получавших вортиоксетин.
Положительная динамика, но менее выраженная, наблюдалась у пациентов I группы по подшкале тревоги. Средний показатель выраженности тревоги у пациентов I группы до начала реабилитации составлял 9,7 балла. Средний показатель тревоги у пациентов II группы – 9,3 балла. Спустя 8 недель от начала восстановительного лечения средний балл тревоги по шкале HADS снизился до 7,8 у пациентов I группы, что ниже диагностического показателя субклинической депрессии (8 баллов). К 12-й неделе реабилитации прослеживалось дальнейшее постепенное снижение показателей тревоги у пациентов обеих групп, достигнув уровня статистической значимости у больных, получавших вортиоксетин.
Изменения показателей контрольной группы не достигали степени статистической значимости ни по одной из подшкал HADS (табл. 4).
К моменту окончания исследования у пациентов основной группы в целом отмечено улучшение общего самочувствия, что сопровождалось уменьшением лабильности настроения, внутреннего напряжения, тревожности, проявлений психомоторного беспокойства.
Изменения показателей тревоги и депрессии по шкале HADS ассоциировались с улучшением характеристик ходьбы. Проведенный корреляционный анализ показал наличие положительной связи между показателем Ромберга и уровнем депрессии (r=0,72; р<0,05). Данный факт свидетельствует о наличии тесной взаимосвязи выраженности эмоциональных расстройств и степени нарушений ходьбы.
Оценка показателей функциональной независимости, повседневной активности и качества жизни. Большое значение в реабилитации больных ИИ имеет оценка показателей функциональной независимости, повседневной активности и качества жизни.
На фоне комплексной реабилитации в обеих группах достоверно повысилась активность больных в сфере повседневной жизнедеятельности – индекс Бартел (р<0,05; табл. 5). Исходно пациенты всех групп не различались по сумме баллов по шкале Бартел. Через 8 недель после начала реабилитационных мероприятий увеличение суммы баллов в основной группе было статистически значимым (табл. 5).
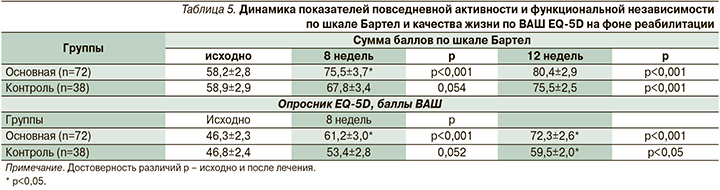
К окончанию исследования наблюдалось дальнейшее нарастание суммы баллов. Средний балл к моменту окончания исследования для пациентов I группы составил 80,4±4,0; для II группы – 75,5±3,1. Наиболее выраженный прирост по шкале Бартел к исходу 2-го месяца отмечен в группе пациентов, получавших вортиоксетин. Нужно отметить и более выраженный темп прироста показателей у пациентов основной группы: через 8 недель терапии прирост составил 77,8% для пациентов основной группы, в то время как в группе контроля увеличение составило всего 44,7%. Достоверных различий по подшкалам у пациентов основной и контрольной групп получено не было. Тем не менее статистически значимая динамика суммарных показателей индекса Бартел была связана в первую очередь с нарастанием баллов в основной группе по критериям движения (подъем по лестнице – прирост за 2 месяца 46%, пересаживание – 40%, ходьба – 80,6%) и навыков самообслуживания (прием пищи – прирост за 2 месяца 54%, приема ванны – 60%, пользование туалетом – 46%).
Оценка качества жизни. Наличие проблем со здоровьем при использовании опросника EuroQol-5D выявлено у всех 110 пациентов, причем бóльшая часть из них оценили проблемы по всем компонентам опросника качества жизни. В наибольшей степени была нарушена способность передвигаться: затруднения в подвижности испытывали 58 (52,7%) опрошенных пациентов; проблемы ухода за собой отметили 62 (56,4%) человека; на эмоциональные расстройства указали 48,2% больных.
В повседневной деятельности проблемы испытывали 41,8%, умеренную боль и дискомфорт ощущали 40% опрошенных. Средний показатель опросника, характеризующий качество жизни по визуально-аналоговой шкале (ВАШ), на момент начала исследования составил 46,3±2,3 балла для I группы и 46,8±2,7 – для II. Через 8 недель проведения комплексной реабилитации оценка пациентами уровня качества жизни была значимо выше; в I группе пациентов, получавших в комплексной терапии вортиоксетин, эти изменения достигали степени статистической значимости (р<0,05). Дальнейшее наблюдение за пациентами показало устойчивый положительный эффект терапии в обеих группах по показателям функциональной независимости и качества жизни.
Проведенный корреляционный анализ показал, что общая оценка по шкале EQ-5D была достоверно выше у пациентов, имевших более высокую оценку по шкале Бартел (r=0,47; р<0,05). Общая оценка по шкале Бартел достоверно коррелировала с таковой по шкале HADS (r=-0,68; p<0,05) и MoCA (r=0,49; р<0,05) через 12 недель наблюдения. Общая оценка по шкале EQ-5D через 12 недель достоверно коррелировала с таковой по шкале MoCA через 8 и 12 недель (r=0,47, r=0,38, r=0,37; р<0,05), показателям подшкалы депрессии HADS через 8 и 12 недель (r=-0,28; r=-0,44; р<0,05), а также показателем Ромберга через 8 и 12 недель (r=0,49; r=0,54, р<0,05) реабилитации.
Побочные эффекты и переносимость вортиоксетина
За время лечения отмечена хорошая переносимость вортиоксетина. В ходе исследования значимых побочных эффектов, ухудшения общесоматического и психического состояний, изменений гемодинамики, лабораторных показателей, электрокардиограммы не зарегистрировано. Было выявлено 6 (8,3%) случаев появления тошноты на 1-й неделе лечения. Во всех случаях тошнота самостоятельно прошла и не привела к отказу от терапии. У 5 (6,9%) пациентов отмечено усиление тревожности в течение первых 7 дней терапии, что также не привело к отказу от лечения и регрессировало самостоятельно.
В течение первых 14 дней терапии в некоторых случаях отмечались побочные эффекты, не доходившие до степени клинически значимых: легкая седация (2 человека), ортостатическое головокружение (1 пациент), диарея (1 пациент), кожный зуд (1 пациент). Эти жалобы не требовали дополнительного лечения или отмены препарата.
В целом переносимость препарата как очень хорошую и хорошую отметили 93% пациентов, принимавших вортиоксетин.
Таким образом, показано достоверное влияние вортиоксетина на эмоциональные и постуральные нарушения, показатели независимости в повседневной жизни, качество жизни больных при включении его в комплексную реабилитационную программу.
Обсуждение
ИИ оставляет после себя стойкие двигательные расстройства [1]. Частота встречаемости статолокомоторных дисфункций колеблется от 40 до 100% в зависимости от подтипа мозгового инсульта и возраста пациентов [4, 6]. Нарушения постурального баланса дополнительно затрудняют передвижение пациентов, повышают риск их падений, ухудшают возможности самообслуживания [3–4].
Поддержание необходимой устойчивости в вертикальном положении диктует вовлечение в процесс переобучения всех звеньев системы равновесия. Это реализуется последовательной тренировкой пациентов в условиях стояния и ходьбы, что требует воли и напряжения сил больного. Акцент на «игровой» мотивации пациентов делает процесс реабилитации более привлекательным, заставляя больного отвлечься от своей болезни и реализовать необходимый для участия в игре двигательный потенциал. Задаваемые условия игры предполагают умственное напряжение пациента, что положительно влияет на восстановление нарушенных когнитивных функций. Достижение больным видимого на экране монитора результата, принося положительные эмоции, мотивирует его на последующее стремление к выздоровлению. Это находит подтверждение в улучшении клинической оценки двигательной системы пациентов, а также трансформации параметров стабилограммы в сторону нормализации [8, 25].
В результате проведенного исследования у всех пациентов наблюдалось стойкое улучшение функционального состояния нервно-мышечного аппарата. К концу наблюдения в основной группе пациентов (БОС+вортиоксетин) статистически значимо выровнялся ЦД в обеих плоскостях (достоверно по оси Х; р<0,05), уменьшилась длина статокинезиограммы в среднем на 27,4%; снизилось отклонение общего ЦД в сагиттальной плоскости, что можно рассматривать как объективное увеличение устойчивости пациентов. Улучшился коэффициент Ромберга (с 55,8±6,81 до 95,2±6,47; р<0,05), что свидетельствовало о восстановлении глубокой проприоцептивной чувствительности и увеличении доли ее информации в контроле стояния. У пациентов с наличием пареза конечностей улучшился показатель положения общего ЦД во фронтальной плоскости (p<0,05) при выполнении функциональных проб (регресс пареза и асимметрии позы). Прослеживалась тенденция к снижению скорости перемещения ЦД (индикатор общей стабильности). Как следствие – более ранняя двигательная и социальная адаптация пациента (изменения по шкале Бартел с 58,2±3,0 до 84,4±2,9 балла; р<0,001), восстановление нарушенной функции равновесия, улучшение качества жизни (46,3±2,3 против 72,3±2,6 в конце исследования; p<0,05). Нужно подчеркнуть эмоциональную окрашенность физической нагрузки при БОС-тренинге на платформе (воздействие на психическую составляющую двигательного дефици-та; усиление сенсорного входа). Пере-стройка стабилограммы совпадала с клиническим регрессом статолокомоторных нарушений. Клинический эффект прослеживался через 4 недели после начала реабилитации, достигнув максимума к 8–12-й неделе реабилитации.
Определенный вклад в развитие двигательных нарушений вносят имеющиеся постинсультные КН и эмоциональные расстройства [13, 15, 22, 23].
Постинсультная депрессия является распространенным и серьезным осложнением после инсульта, встречающимся почти у трети выживших после инсульта и влияющим на смертность, функциональный исход, результаты реабилитации и качество жизни. Имеется относительно небольшое число научных докладов о клинической пользе и безопасности антидепрессантов при постинсультной депрессии. Показано, что антидепрессанты могут уменьшать депрессивные симптомы, но ни оптимальный препарат, ни оптимальная продолжительность лечения не определены. Серотонинергические препараты остаются препаратами выбора из-за их лучшего профиля безопасности, но в последние годы были проведены важные дебаты о возможной связи между использованием селективных ингибиторов обратного захвата серотонина (СИОЗС) и увеличением смертности. СИОЗС могут увеличивать риск внутренних кровотечений, включая внутричерепные, в силу ингибирования агрегации тромбоцитов [13, 22, 23]. Поэтому ведется поиск более безопасных антидепрессантов. К числу новых антидепрессантов относится вортиоксетин, обладающий мультимодальными свойствами и прокогнитивным действием. Но необходимы дальнейшие исследования для выяснения его роли в лечении постинсультной депрессии.
В нашем исследовании показано, что применение при реабилитации пациентов с ИИ антидепрессанта вортиоксетина позволяет стабилизировать эмоциональный фон, изменить отношение пациентов к болезни и восстановительному лечению, повысить самооценку больного. У пациентов основной группы положительные изменения касались шкал как эмоционального, так и физического функционирования, что выражалось в улучшении постуральной устойчивости, увеличении объема выполняемых повседневных обязанностей, улучшении эмоционального фона.
К концу наблюдения статистически значимо изменился уровень повседневной активности пациентов, что объективно подтверждалось позитивной динамикой по шкалам Бартел и EuroQol 5D. Нужно отметить, что в группе вортиоксетина двигательные функции и остальные исследуемые показатели восстанавливались быстрее и более полноценно.
Таким образом, включение вортиоксетина в комплексную программу медицинской реабилитации потенцирует эффект проводимых восстановительных мероприятий, что обосновывает его применение в реабилитации пациентов с инсультом.
Заключение
Проведенное исследование продемонстрировало высокую эффективность применения вортиоксетина в комплексной реабилитации пациентов в позднем восстановительном периоде ИИ. Улучшение эмоционального статуса при включении вортиоксетина в терапевтический комплекс сопровождается улучшением функции ходьбы, когнитивного статуса, повышением функциональной независимости, повседневной активности и качества жизни. Клинически значимая редукция эмоциональных и КН, а также показателей постуральной устойчивости проявляется к 12-й неделе постоянного приема препарата. Препарат имеет хороший профиль переносимости.
Применение современных антидепрессантов в комплексе реабилитационных программ считается важным и неотъемлемым компонентом для достижения максимально возможных результатов реабилитации, направленных на улучшение функционирования и независимости пациента.


