Введение
Атеросклеротические поражения коронарных артерий (ишемическая болезнь сердца – ИБС, инфаркт миокарда – ИМ) и периферических артерий (брахиоцефальных, артерий нижних конечностей) служат серьезной причиной заболеваний и смертности населения [1]. Основным значимым фактором риска развития таких атеросклеротических заболеваний является широко распространенная в настоящее время гиперхолестеринемия (ГХС) [2, 3]. Поэтому в современной клинической врачебной практике важны выявление ГХС в более раннем возрасте, правильная диагностика фенотипа гиперлипидемии (ГЛП), определение наследственных семейных ГХС (СГХС) или умеренных (полигенных), особенно в доклиническом периоде [4, 5]. Критерии диагностических уровней холестерина (ХС) варьируются в зависимости от дополнительных факторов риска (уровень артериального давления, наличие курения, пол и возраст) у пациента, что позволяет определить рекомендуемые «целевые» уровни липопротеидов низкой плотности (ЛПНП) для конкретного человека [6]. В последнее десятилетие для населения широко доступно определять уровни ХС и ТГ самостоятельно или по программам диспансеризации, скрининга, что способствуют более раннему выявлению лиц с ГХС [7, 8]. Это также расширяет возможности первичной и вторичной профилактики сердечно-сосудистых заболеваний (ССЗ) атерогенного генеза и применения своевременной коррекции ГХС с помощью статинотерапии [9]. В клинической практике в соответствии с рекомендациями [6] применяют широкую линейку гиполипидемических препаратов группы статинов (различных по эффективности и в разных дозах) индивидуально у пациента в зависимости от градации групп риска: очень высокого, высокого, умеренного и низкого. Однако следует учитывать не только градацию по группам риска, но и исходный уровень ХС для выявления пациентов с высоким уровнем ХС (>7,5ммоль/л) как возможный диагноз СГХС [7], в то время как пациенты с умеренным повышением уровня ХС (<7,5ммоль/л) – это многочисленные полигенные ГХС [4, 5, 10]. Умеренное или высокое повышение уровня ХС в последующем определяет возможности назначения липидснижающей терапии, эффективности терапии и применения препаратов группы статинов разной активности и дозы с учетом различия препаратов по переносимости и эффективности [11, 12].
Пациенты с ГЛП разных фенотипов, с ГХС полигенной и семейной наследственной: выявление, диагностика и тактика ведения
Программы диспансеризации и доступность самостоятельного скрининга пациентов для определения уровня ХС способствуют активному выявлению лиц с ГЛП, ГХС, умеренного (полигенного) и высокого (наследственного) уровня ХС в доклиническом бессимптомном периоде [13, 14]. Для получения приверженности терапии статинами таким пациентам в реальной клинической практике при выявлении ГЛП необходимо проводить дополнительные обследования для определения возможных атеросклеротических бессимптомных заболеваний, уточнения сопутствующих заболеваний для исключения вторичных форм ГЛП [5, 15–17]. В зависимости от рассчитанной группы риска и формирования индивидуальной программы проведения первичной или вторичной профилактики определяют необходимость приема фармакологической группы и дозы статина для достижения «рекомендуемой нормолипидемии» [18]. Особое внимание следует уделять молодым пациентам с ГЛП, ГХС без клинических проявлений атеросклерозом, проведения у них дифференциальной диагностики фенотипа ГЛП (IIА, IIБ) в соответствии с Международной классификацией болезней 10-го пересмотра (МКБ-10) и роли наследственного фактора, определения возможной СГХС для назначения адекватной липидснижающей терапии статинами [18, 12].
Основа назначения адекватной липидснижающей терапии – четкая диагностика фенотипа ГЛП (IIA, IIБ), выявление СГХС (высоких уровней ХС) или умеренной (полигенной) ГХС. Диагностика ГХС в популяции и больных атеросклеротическими заболеваниями имеет свои особенности [19, 20]. Популяционная граница нормы уровня ХС менялась с годами, в настоящее время определена как уровень ХС 5,2 ммоль/л. Поэтому при уровне ХС>5,2ммоль/л, учитывая нормальный или повышенный уровень триглицеридов (ТГ), проводим диагностику и классификацию фенотипа ГЛП и код по МКБ-10. Пациенты с ГХС составляют две группы: с чистой ГХС – ЧГХС (Е.78.0) и смешанной (комбинированная) ГЛП (СмКГЛП) в сочетании с гипертриглицеридемией (Е.78.2) [5]. Эти группы по биохимической классификации D.S. Fredrickson [14] соответствуют фенотипам ГЛП IIA и IIБ, III. Эти две группы ГЛП: Е78.0/ЧГХС/ГЛП IIA и Е78.2/СмКГЛП/ГЛП IIБ типов наиболее широко распространены в популяции. Одна группа включает пациентов как с умеренным повышением уровня ХС (<7,5 ммоль/л) с разными уровнями ТГ (ГЛП IIA и IIБ), так и со значительным повышением уровня ХС (>7,5 ммоль/л) и с СГХС с уровнем ТГ<4,5ммоль/л, другая группа – пациенты с вторичными симптоматическими ГЛП с уровнем ТГ>4,5 ммоль/л [21, 22]. Заболевание СГХС является редким случаем моногенной гомозиготной формы (1:1 000 000) и более распространенной гетерозиготной (до 0,2–0,5% в популяции), обе формы существуют у человека с рождения [5, 21]. Диагностику таких генетических форм (СГХС) в реальной клинической практике на первом этапе проводят по клинико-биохимическим критериям, по баллам С. Брума [7]. Кроме моногенных СГХС существуют полигенные ГХС также с высоким уровнем ХС, они также могут быть наследственно обусловленными первичными ГХС, втречаются до 20–30% в популяции и реализуются в более поздние возрастные периоды под влиянием других факторов среды, в т.ч. питания [4, 5, 21]. Еще есть группа с высокими уровнями ХС в сочетании или без высоких уровней ТГ. Это вторичные (симптоматические) ГЛП, которые формируются как метаболические нарушения при декомпенсации ряда заболеваний (эндокринные, иммунные, печени и др.) и при которых необходима терапия основного заболевания [17, 21] и только потом – специфическая липидснижающая.
СГХС – моногенные формы с высоким риском ССЗ, в популяции чаще (0,2–0,5%) наблюдаются гетерозиготные формы. В семьях с выявленной СГХС рекомендуется обязательно проводить каскадный семейный скрининг, определять уровень ХС у родственников любого возраста, начиная с детского, на этапе доклинической формы атеросклероза [5, 7, 20]. Так как такие нарушения липидного обмена существуют с рождения, то и выявлять их надо с детства, чтобы как можно раньше начинать липидснижающую терапию, пожизненно независимо от наличия или отсутствия клиники атеросклероза и применять высокоэффективные и в максимальной дозе препараты группы статинов [6, 7, 20, 23, 25]. Конечно, диагноз СГХС по возможности желательно подтверждать с помощью ДНК-диагностики, определять мутации генов (ЛПНП рецептора, апопротеина апо В-100 и фермента-конвертазы рецептора ЛПНП – PCSK9) [5]. Но диагноз СГХС надо устанавливать уже по клинико-биохимическим критериям С. Брума [7], учитывая уровень ХС>7,5 ммоль/л или ЛПНП>4,9 ммоль/л для взрослых. У обследуемого пациента возможно наличие ксантом или у родственников 1-й степени наличие ГХС, ксантом, раннего развития ИБС, ИМ. Это группа высокого риска. По баллам определяют варианты диагноза СГХС: «определенный»(>8 баллов), «вероятный» (6–8 баллов) и «возможный» (3–5 баллов) [7].
Полигенная группа ГХС – это группа с умеренным или высоким уровнями ХС, IIA и IIБ фенотипов. Их в популяции от 20–30 до 60%. При умеренном повышении ХС пациенты с атеросклеротическими процессами составляют группу высокого риска, у пациентов без проявлений атеросклероза проводят оценку риска сердечно-сосудистых осложнений (ССО) по группе риска: умеренного, высокого или очень высокого у лиц без ССЗ [1, 6, 7]. Полигенные ГЛП также могут иметь наследственную предрасположенность с разной степенью пенетрантности и экспрессивности вовлеченных минорных генов, которые реализуются под влиянием других генов и средовых факторов риска не с рождения (как моногенные), а в более поздние возрастные периоды [5, 21, 24]. Это генетически разнообразная группа по многочисленным генетическим дефектам и гетерогенная по клиническим и биохимическим показателям. Реализуются полигенные ГХС через экспрессию генов, влияющих на аполипопротеины (их активность, структуру и функцию), транспортные белки, мутации генов, определяющих их функции [5], и зависят от внешних факторов (в т.ч. питания) [17, 26].
Вторичные (симптоматические) ГЛП с высоким уровнем ХС. Это обычно группа смешанных комбинированных нарушений липидного обмена (ГХС и ГТГ), как умеренные повышения, так и выраженные, возникает как симптом в виде метаболического нарушения при декомпенсации ряда заболеваний, особенно эндокринных и гастроэнтерологических и только компенсация заболеваний восстанавливает нарушение липидного обмена [17, 21, 26].
Липидснижающая коррекция ГХС: алгоритмы при высоком и умеренном повышении уровня ХС
Как представлено в Российских рекомендациях по диагностике и коррекции нарушений липидного обмена с целью профилактики и лечения атеросклероза (VI пересмотр, 2016) [6], коррекция ГХС проводится для достижения рекомендуемых «целевых» уровней ХС и ЛПНП для разных групп риска (очень высокого, высокого или умеренного и по шкале SCORE (Systematic COronary Risk Evaluation) [6]. Учитывают наличие атеросклеротических заболеваний, возраст, пол, уровень систолического артериального давления, уровень ХС, курение. При оценке 5% и более проводят общие профилактические мероприятия, борьбу с выявленными факторами риска и гиполипидемическую терапию по факторам питания, возможно статинотерапию [12, 17]. По данным эпидемиологического исследования [8, 15], распространенность ГХС в РФ составляет: при уровне общего ХС (ОХС) более 5,0 ммоль/л – 62%, при ОХС более 6,2 ммоль/л – 44%; при ОХС>7,5 ммоль/л – 6% (возможные СГХС) [6]. Это разные группы для проведения гиполипидемической терапии. Основной метод коррекции высокой ГХС в клинической практике проводят с помощью терапии статинами, ингибиторами синтеза ХС [27]. Статины представлены группами разной эффективности, разными дозами: от минимальных до максимальных [11, 28]. В клинической практике применение липидснижающей терапии статинами необходимо проводить при врачебном контроле, отсутствие которого уменьшает приверженность пациентов лечению, применению эффективных доз и эффективных групп статинов в разных группах риска ССО атеросклеротического генеза (ССО АГ) [15, 19]. После установления диагноза по МКБ-10 ГХС (ЧГХС или СмКГЛП), фенотипа ГЛП (IIА, IIБ), его формы (первичной или вторичной), проведения тестирования диетологической коррекции в соответствии с фенотипом [26], исходно определив базовые уровни ХС и ТГ, далее определяют специфическую медикаментозную гиполипидемическую терапию статинами определенной группы эффективности, адекватной дозы для переносимости [19, 28].
Статины – основная группа специфической коррекции ГХС
Специфическая медикаментозная терапия ГХС базируется на препаратах группы статинов, которые являются ингибиторами синтеза ХС, но с разной степенью эффективности, синтезированных в разных поколениях и с разной переносимостью. Наиболее часто в настоящее время назначают аторвастатин и розувастатин, которые более эффективны при высоких уровнях ХС, в т.ч. при СГХС, при наличии значимых клинических атеросклеротических поражениях [13, 28–31]. Показано, что розувастатин, статин IV поколения, действует как один из наиболее эффективных статинов с хорошей переносимостью и эффективностью [32, 33]. Таким образом, для снижения высокого уровня ХС крови применяют наиболее эффективные статины, при умеренном повышении ХС могут быть эффективными статины всех групп. Статины эффективны при ГХС (ГЛП IIA, IIБ), но не эффективны при высокой ГТГ (IIБ, III, IY типы), в этом случае применяют другие препараты [5, 17, 21]. Действие статинов основано на специфическом конкурентном обратимом ингибировании активности HMG-СoA-редуктазы (фермента – катализатора биосинтеза ХС) [27, 34, 35]. Статины разных поколений имеют одинаковый механизм действия, но отличаются химической структурой, фармакокинетическими свойствами, разной переносимостью и эффективностью гиполипидемического действия [35]. Механизм действия статинов (ингибиторов HMG-CoA-редуктазы) включает также плейотропные действия в виде стабилизации атеросклеротических бляшек, улучшения функции эндотелия, противовоспалительного действия и т.д. [36, 37].
В настоящее время в клинической практике применяют следующий ряд статинов: симвастатин, аторвастатин, розувастатин, они разной степени гиполипидемической эффективности, которую следует учитывать в зависимости от исходного уровня ХС и ЛПНП, группы риска, шкалы SCORE [13, 19, 38]. По данным европейских и американских рекомендаций, для снижения ХС применяют статины разной степени интенсивности для достижения «целевых» уровней ЛПНП:
а) высокоинтенсивная терапия (аторвастатин 40–80 мг, розувастатин 20–40 мг);
б) умеренно интенсивная терапия (аторвастатин 10–20 мг, розувастатин 5–10 мг, симвастатин 20–40 мг);
в) низкоинтенсивная терапия (симвастатин 10 мг) [18].
Конечно, назначение статинов рассматривают всегда индивидуально, в зависимости от разных групп риска пациентов, для женщин детородного возраста, для молодых людей, особенно при диагнозе СГХС, как при наличии, так и без клинических проявлений атеросклеротических заболеваний [6].
Высокоэффективный розувастатин – базовая терапия пациентов с СГХС и полигенной ГХС высокого уровня ХС
Имеются многочисленные рандомизированные многоцентровые данные об эффективности и безопасности высокоинтенсивной липидснижающей терапии розувастатином пациентов с высоким и очень высоким риском ССО АГ [8, 13, 18, 39]. Применение розувастатина в клинической практике представлено в исследованиях отдельных групп контингента наблюдения [1, 15, 19, 32, 40]. Однако не представлены сравнительные данные о применении статинов пациентами в группах умеренного и высокого уровня ХС, особенно нуждающихся в активной статинотерапии (СГХС). При применении именно розувастатина необходимый уровень ЛПНП достигается довольно высоким процентом пациентов (в некоторых исследованиях – 80%) [32]. В клинической практике рекомендованные (высокие) дозы препарата розувастатин принимает, к сожалению, ограниченное число пациентов по разным причинам непереносимости. Ограничения приема высоких доз из-за опасения непереносимости зависят от взаимодействия с другими препаратами, которые пациенты принимают по необходимости при наличии многочисленных сопутствующих заболеваний. Физико-химические свойства розувастатина определяются его гидрофильностью, поэтому поступает внутрь гепатоцитов при участии активной системы переноса [27], что в меньшей степени приводит к миотоксичности [40, 41]. Как правило, непереносимость статинов может возникать у пациентов при наличии у них патологии щитовидной железы, приеме тиреоидных препаратов или на фоне применения нестероидных противовоспалительных средствв. Ферменты системы изоформы CYP3A4 отвечают за метаболизм симвастатина, аторвастатина, в то время как розувастатин имеет небольшое сходство с ферментами системы цитохромов-Р450 [27, 35]. Эти различия между ингибиторами HMG-CoA-редуктазы очень важны с точки зрения потенциального взаимодействия различных препаратов и влияния на метаболизм мышц, особенно при физических нагрузках разных пациентов. Это также определяется сопутствующей терапией (ферментные ингибиторы CYP3A4: кетоконазол, флуконазол, циметидин, эритромицин, кларитромицин, дилтиазем, верапамил, циклоспорин, ритонавир и др.), которые в сочетании со статинами могут приводить к возникновению побочных эффектов (особенно миотоксичности). Надо учитывать расширенные положительные действия розувастатина, плейотропные (нелипидные) эффекты в виде антиоксидантных, противовоспалительных свойств, активации тромбоцитов, стабилизации атеросклеротических бляшек [30, 36].
Розувастатин многофункционален по действию и эффективен при первичной и вторичной профилактике ССЗ
Эффективность розувастатина в первичной профилактики ССЗ изучена в рандомизированном исследовании JUPITER (1315 центров 26 стран). Показано статистически значимое снижение риска нефатального или фатального ИМ (отношение рисков [ОР]=046), фатального или нефатального инсульта (ОР=0,52), нестабильной стенокардии (ОР=0,53). Преимущества лечения розувастатином наблюдались во всех подгруппах,независимо от возраста, пола, расы, страны рождения, наличия традиционных факторов риска [42]. В клиническом исследовании [39] у пациентов очень высокого сердечно-сосудистого риска (80 человек) применение розувастатина 40 мг уже при краткосрочной (12 недель) интенсивной терапии по сравнению со стандартной терапией другими статинами отмечено не только снижение уровня липидных показателей, но и достоверное уменьшение объема атеросклеротических бляшек в сонных артериях. Эффективность применения розувастатина показана пациентам с тяжелой гетерозиготной СГХС [43].
В рандомизированном двойном слепом плацебо-контролируемом исследовании METEOR получено при терапии розувастатином 40 мг в течение 2 лет снижение уровня ЛПНП на 49% и замедление прогрессирования и/или регресс атеросклероза (на основании показателя толщины комплекса интима-медиа) у лиц с низким риском и субклиническим атеросклерозом (984 мужчин и женщин в возрасте 45–70 лет) без ИБС, с умеренной ГХС, где фактором риска был возраст или 10-летний фатальный риск менее 10% по Фрамингемской шкале [44].
Методы
В НИИ кардиологии им. А.Л. Мясникова ФГБУ НМИЦ кардиологии МЗ РФ в течение многих лет (с 1980 г.) сотрудниками отдела проблем атеросклероза проводятся текущие амбулаторные консультации по обращаемости лиц разного возраста с ГЛП разных форм, фенотипов, с признаками атеросклеротических заболеваний и без них. Сформирован текущий клинический регистр лиц с ГЛП по обращаемости «ЛИПИД-ПРАКТИК». Причина обращений на консультацию: уточнение диагноза ГЛП, неэффективность проводимой терапии статинами, непереносимость, уточнение необходимости приема статинов. В течение 2009–2016 гг. обратились 1173 человека (из них 40,3% мужчин) в возрасте 18–84 лет (средний возраст – 49,6±10,5 лет).
На 1-м этапе диагностики проводили фенотипирование ГЛП по критериям уровней ХС>5,2 ммоль/л и ТГ более или менее 2,3 ммоль/л, для кодирования диагноза по МКБ-10 (Е78,0, Е78,1, Е78,2 и др.). Пациенты с ЧГХС (Е78.0), фенотип IIА ГЛП составили 55,9%, включая лиц с высоким и умеренным повышением уровня ХС. Другую группу составили пациенты (37,9%) со СмКГЛП, фенотип IIБ (Е.78.2). В этой группе были пациенты не только с высоким и умеренным повышением ХС, но и с разным уровнем ТГ (от 2,3 до 4,5 ммоль/л и ТГ> 4,5 ммоль, максимально до 150 ммоль/л). Группа пациентов с чистой гипертриглицеридемией (Е78.1) в наш анализ не включена, т.к. это группа другой медикаментозной терапии (фибраты).
Пациентов с СГХС общей группы с ГХС при IIА и IIБ ГЛП фенотипах выявляли при уровне ТГ<4,5 ммоль/л. По клинико-биохимическим критериям С. Брума (более 8 баллов) их было 574 (48,9%) человека, что очень много, учитывая, что в популяции они составляют 0,2–0,5%. По клинико-биохимическим критериям диагностики СГХС (ХС>7,5 ммоль/л и ТГ<4,5 ммоль/л) лиц с ГЛП IIА (Е78.0) было 398 (69,3%) человек, с ГЛП IIБ (Е78.2) – 186 (30,7%). Они составили группу СГХС высокого риска, этим пациентам необходимы высокоэффективные статины в высокой дозе (розувастатин 40 мг, аторвастатин 80 мг).
Среди пациентов с полигенными формами ГЛП (459/39,1%) с умеренным повышением уровня ХС при ГЛП IIА были 241/52,5% и ГЛП IIБ – 218/47,5% человек. Полигенная ГЛП IIБ группа – очень гетерогенная по уровням ХС и ТГ, им также показана статинотерапия, но применение статинов может быть в более широком диапазоне по их эффективности и дозам. При этом в группе ГЛП IIБ часть пациентов (исключая СГХС), а это 196 (89,9% от всех полигенных ГЛП IIБ) человек, имели не только высокие уровни ХС, но и ТГ>4,5 ммоль/л. Этой группе пациентов требуется комбинированная терапия (статины и фибраты) и коррекция сопутствующих заболеваний (панкреатиты, сахарный диабет, заболевания щитовидной железы) коррекция питания (см. таблицу).
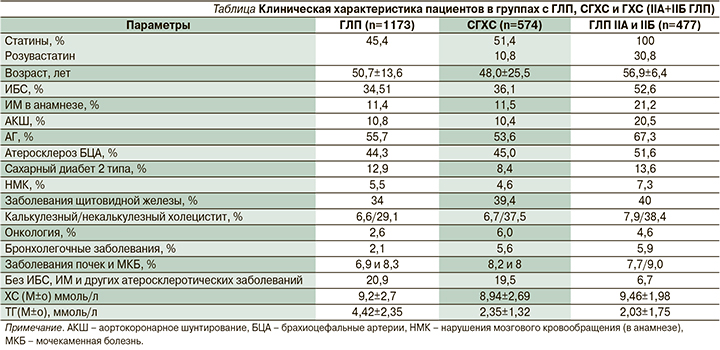
Пациенты с ГЛП IIБ (Е78.2) составили 37,9% от всей выборки. Это очень гетерогенная группа (полигенная, СГХС, умеренная и высокая ГХС, повышенный и высокий уровни ТГ). Таким пациентам была необходима дополнительная диагностика многочисленных сопутствующих заболеваний, которые были либо в стадии декомпенсации, либо не были выявлены вообще, т.к. они затрудняют гиполипидемическую терапию.
В группу пациентов с умеренной ГХС (ХС<7,5ммоль/л, полигенные) вошли 506 (43,1%) человек. Группа включала два фенотипа ГЛП: ЧГХС (Е78.0) и СмКГЛП (Е78.2) IIА и IIБ. Пациентов с ТГ<4,5ммоль/л, у которых можно оценить ЛПНП, было 75,3% в выборке, среди полигенных – 381 (32,5%) человек. В группе полигенных ГЛП статины принимали 128 (25,3%) человек и при ТГ<4,5 ммоль/л – 33,6%. Остальные пациенты не были настроены на прием статинов из-за возможных побочных эффектов или недостаточной информированности.
Группа пациентов с высокой ГХС (ХС>7,5ммоль/л) состояла из 645 (55%) человек, среди них СГХС (при уровне ТГ<4,5 ммоль/л) была выявлена у 574 человек, остальные (71 человек) были с высокими уровнями и ХС и ТГ от 4,5 до 10 ммоль/л. Клинико-биохимическая характеристика всех групп представлена в таблице. Показана высокая частота атерогенных заболеваний во всех группах пациентов, различных проявлений атеросклероза (ИБС, ИМ в анамнезе), перенесенных вмешательствах на коронарных артериях (АКШ и стентирование коронарных артерий), частота АГ, атеросклеротические поражения БЦА (гемодинамически значимые и незначимые, атеросклеротических бляшек более 25% в общих сонных, внутренних сонных, наружных сонных артериях). Получены данные о наличии у этих пациентов большой нагрузки коморбидных (сопутствующих) заболеваний, (полученных по данным представленных документов и дополнительных инструментальных обследований). Клинические характеристики различных атеросклеротических поражений, сопутствующих заболеваний во всех группах не выявили значимых различий по частоте атеросклеротических поражений при сравнении этих групп. Вероятно, это объясняется тем, что обращались за консультацией в основном пациенты уже с наличием атерогенных или сопутствующих заболеваний. Однако данных о назначение терапии липидснижающими препаратами (статины) было недостаточно в общей выборке, всего 45,5%, несмотря на то что наличие ГХС определяет тактику обязательного назначения терапии статинами.
Статинотерапии в данной группе вообще и в частности терапии розувастатином было не только недостаточной, но не охватывало всех нуждающихся пациентов или применялась в малых дозах. В общей группе пациентов с умеренным и высоким уровнем ХС из 956 человек при ТГ менее 10 ммоль/л (это IIА и IIБ типы) статины принимали 533 (45,5%) человека. При этом не наблюдалось гиполипидемического эффекта, рекомендуемые уровни ХС и ЛПНП не были достигнуты.
Среди пациентов с ГХС (умеренной и высокой) около 19% были в возрасте до 30 лет без признаков атеросклеротических заболеваний, обратившихся за консультацией по поводу необходимости терапии статинами.
Результаты
После уточнения диагноза ГЛП, выявления СГХС, проведения дополнительных обследований брахиоцефальных артерий (выявление атеросклеротических бляшек), расчета группы риска по шкале SCORE каждому пациенту были даны рекомендации и определена необходимость приема статина, перспективы достижения рекомендуемых уровней ХС и ЛПНП, что формировало приверженность пациента лечению.
Терапия статинами в отдельных группах
Пациенты с ГХС ГЛП IIА и IIБ, принимавшие статины (477 человек, среди них 48,8% лиц с СГХС, остальные полигенные), были распределены на прием разных статинов (в разных дозах): симвастатин – 25,5%, аторвастатин – 43,7%, розувастатин – 30,8%. При этом среди лиц, принимавших розувастатин, у большинства (63,7%) пациентов была минимальная доза 10 мг, среднюю дозу 20 мг принимали 17,6%, максимальную дозу 40 мг – только 18,7%. В группе пациентов, принимавших розувастатин, лиц с СГХС было 67%, все они должны были принимать розувастатин в дозе 40 мг, чего ранее не было. Частота заболеваний в этой группе была следующая: ИБС у 45%, перенесли ИМ – 19,8%, атеросклероз БЦА был у 42,9%. При этом 7,7% пациентов с СГХС, принимавших розувастатин, не имели каких-либо атеросклеротических проявлений (ИБС, ИМ, атеросклероз периферических артерий). Эти пациенты составили группу очень высокого риска, с высоким уровнем ХС, им была рекомендована терапия статинами высокой интенсивности профилактически. В группе пациентов с СГХС (574 человека) принимали статины разных групп в разных дозах только 59,7%: розувастатин – 43,2%, аторвастатин –33,8%, симвастатин – 23%. Остальные 40,3% лиц с СГХС не принимали статины по разным причинам (невозможность приобретения лекарства из-за высокой стоимости препарата, предубеждение, боязнь побочных эффектов, отсутствие клинических проявлений атеросклероза, молодой возраст).
В группе лиц с СГХС, принимавших розувастатин, исходно средний уровень ЛПНП был 10,7±2,8 ммоль/л, на фоне терапии получено снижение уровня ЛПНП до 6,28±2,04 ммоль/л, что не достигло рекомендуемого уровня ХС менее 4,5 и ЛПНП менее 1,7 ммоль/л. Уровень ЛПНП оставался на фоне терапии выше 4,9 ммоль/л в 69,4% случаев, рекомендуемый уровень ЛПНП для данной группы риска не был достигнут. Однако для этой группы значимо снижение уровня ЛПНП даже на 50% от исходного значения, что было получено от 64%. У пациентов, принимавших именно розувастатин, уровень ЛПНП оставался выше 4,9 ммоль/л, у 31,2%, однако, он был выше 3,0 ммоль/л.
Обсуждение
Таким образом, пациентам с умеренной ГХС и высокой ГХС (в т.ч. СГХС, этим широко распространенным фактором риска атеросклеротических заболеваний), рекомендовано активное применение высокоэффективных статинов, в т.ч. для пациентов с СГХС, подтвержденной ДНК-диагностикой [45] и высоким риском, наиболее активного розувастатина [28, 33].
В нашем клиническом наблюдении у 37,9% пациентов была СмКГЛП IIБ-типа, из них у 199 человек уровень ТГ был выше 4,5 ммоль/л: у них невозможно было определить уровень ЛПНП, поэтому эффективность липидснижающей терапии оценивали по ОХС и снижению уровня ТГ [1, 7, 15].
Лиц с критериями СГХС из групп IIА и IIБ ГЛП было 49,8%, среди них принимали статины только 51,4%, в т.ч. розувастатин – 10,8%.
Умеренная ГХС при ХС<7,5 ммоль/л и ТГ<4,5 ммоль, ЧГХС (ГЛП IIА) наблюдалась у 35,7%. В этих группах применяли разные подходы к гиполипидемической терапии. При этом для пациентов с ГХС (ЧГХС и СмКГЛП) розувастатин был активным средством медикаментозной гиполипидемической терапии, являясь эффективным и безопасным препаратом для снижения уровня ХС крови.
Несмотря на результаты многочисленных исследований статинотерапии с хорошим гиполипидемическим эффектом, отмечается недостаточное применение статинов и боязнь использования адекватных необходимо высоких доз статинов и высокоактивных статинов [9, 10, 15]. Из-за применения низкодозовой терапии и низкоэффективных статинов не достигаются рекомендуемые уровни ЛПНП. Однако к этому надо стремиться, надо объяснять пациенту алгоритм терапии статинами разной эффективности и дозы при умеренной ГЛП, высокой СГХС или высокой СмКГЛП [13, 23]. При этом у пациентов с СГХС, которые относятся к группе очень высокого риска ССО АГ, в настоящее время имеются дополнительные резервные, усиливающие гиполипидемический эффект препараты новой группы моноклональных антител к PCSK9 [7], однако их применяют дополнительно к базовой терапии статинами.
Особое внимание следует уделять молодой части населения без атеросклеротических заболеваний, когда ранняя диагностика ГХС у них остается нераспознанной или вне лечебного процесса у кардиологов, терапевтов. Это контингент неопознанной невидимой части «айсберга», невидимая, тревожная по риску ССЗ часть населения с высоким риском атеросклероза, которая нуждается в активном применении эффективной терапии статинами (первичная профилактика атеросклероза). В поле зрения специалистов такие пациенты попадают, как правило, уже после сердечно-сосудистых событий (вторичная профилактика).
По британским рекомендациям NICE (National Institute for Health and Care Excellence), статины должны использоваться как часть стратегии первичной профилактики ССЗ у взрослых при 10-летнем риске развития такого заболевания ≥20% [7, 12]. В соответствии с Российскими рекомендациями по лечению дислипидемии к назначению статинов следует подходить дифференцированно и индивидуально по группам риска [6, 7]. Эффективность раннего вмешательства с проведением статинотерапии, по данным многочисленных клинических исследований, показали значительное снижение числа случаев ССЗ и смертности от них при использовании статинов при вторичной профилактике [12, 18, 19] в результате замедления прогрессирования коронарного атеросклероза [31, 37]. С другой стороны, терапия статинами в молодом возрасте неизбежна для профилактики развития ССЗ при генетических формах ГХС [12, 31, 42, 45]. Для первичной профилактики атеросклероза необходимо активно поддерживать желание обследоваться на определение уровня ХС в крови в молодом возрасте, выявление высокой ГХС (СГХС), особенно каскадным семейным скринингом, и своевременное начало липидснижающей терапии [5–7, 16]. Следует учитывать, что ГЛП длительно могут быть не только без клинических проявлений атеросклероза, но и без ксантомных поражений кожи и сухожилий [5–7]. Поэтому скрининг популяционный и каскадный должен быть более активным, особенно среди лиц молодого возраста, детей, определение уровня ХС крови – раннего предиктора атеросклероза, для ранней профилактической статинотерапии [10, 15, 16].
При высокой ГХС необходимо применение статинов, в т.ч. наиболее эффективно – розувастатина, лицами с высокой ГХС. При наличии атеросклеротических поражений сердца и сосудов это должно быть обязательным [10]. Назначение липидснижающих препаратов должно быть адресным для пациентов с ГХС с учетом наличия признаков атеросклероза и факторов риска атеросклероза, возраста, пола пациента, сопутствующих заболеваний [23, 33]. Одной из главных особенностей розувастатина следует считать его высокую гиполипидемическую эффективность уже в начальной суточной дозе (10 мг/сут), которая возрастает с повышением дозы до максимальной. Установлено, что в дозе 10 мг/сут розувастатин снижает уровень ЛПНП на 42–52% от исходного уровня и на 63% – при назначении максимально разрешенной дозы (40 мг/сут). Однако для групп высокого риска розувастатин необходимо назначать в максимально переносимой дозе [8, 32, 39]. Было показано, что перевод на розувастатин в дозе 10 мг позволил пациентам значительно быстрее достичь целевого уровня ЛПНП по сравнению с теми пациентами, которые продолжили лечение аторвастатином в дозе 10 мг (86 против 80%), симвастатином в дозе 20 мг (86 против 72%) и правастатином в дозе 40 мг (88 против 66%) [12].
Побочные эффекты встречались с одинаковой частотой во всех группах, и только 3% всех пациентов прекратили лечение из-за побочных эффектов. Сопутствующие заболевания могут уменьшать приверженность терапии из-за возможных взаимодействий с другими препаратами, создающих картину непереносимости [15, 27].
Определение липидных показателей крови в настоящее время является рутинным исследованием, и все больше пациентов молодого возраста без признаков атеросклероза активно выявляют у себя ГХС, обращаются для получения рекомендаций о необходимости приема липидснижающей терапии и активной статинотерапии при выявленных СГХС [5–7].
Заключение
- Рекомендовать активное выявление лиц с ГХС, СГХС, особенно в доклинический период, при диспансеризации и в текущей клинической практике, определять необходимость своевременной липидснижающей терапии.
- Обязательно проводить диагностику: фенотипа ГЛП (ГХС, ГТГ), умеренного и высокого уровней ГХС и диетотерапии в соответствии с типом ГЛП.
- Активно выявлять пациентов с СГХС по клинико-биохимическим критериям С. Брума, формировать у пациентов высокого риска мотивацию терапии сопутствующих заболеваний до начала активной статинотерапии.
- Персонифицированное назначение статинов разной эффективности и дозы в группах умеренного и высокого уровней ГХС для первичной и вторичной профилактики атеросклероза.
- Высокоэффективные статины розувастатин и аторвастатин в адекватных переносимых дозах определить как препараты первого ряда при СГХС, высокой ГХС. Учитывать уровень ТГ при назначении комбинированной терапии.


