Введение
Осложнения цирроза печени (ЦП) и смертность, с ними ассоциированная, потенциально предотвратимы. Из методов лечения, предотвращающих прогрессирование ЦП, наибольшую доказательную базу имеют противовирусная терапия при гепатитах С и В [1–3], комплекс мероприятий, направленных на прекращение употребления алкоголя с вредными для здоровья последствиями [4]. Вместе с тем в ряде случаев ЦП своевременно не диагностируется в общеврачебной сети или, даже если он диагностируется на ранних стадиях, пациенты не получают патогенетически обоснованной терапии, направленной на снижение частоты развития и скорости прогрессирования осложнений [5]. Не вызывают сомнений существенные различия в стоимости и клинической эффективности схем терапии пациентов с компенсированным и декомпенсированным ЦП, в связи с чем основные усилия системы здравоохранения должны быть сосредоточены на ранней диагностике ЦП и профилактике развития его осложнений. Медиана выживаемости пациента с компенсированным ЦП варьируется от 9 до 12 лет, в то время как медиана выживаемости лиц с декомпенсированным ЦП не превышает 2 лет [6, 7]. Развитие таких осложнений ЦП, как асцит, печеночная энцефалопатия (ПЭ) и варикозное расширение вен пищевода (ВРВП), свидетельствует о декомпенсации ЦП и сопровождается ростом показателей смертности [7, 8]. Таким образом, своевременная диагностика ЦП, разработка и широкое внедрение алгоритмов ведения этого сложного контингента больных, соответствующих стандартам и национальным клиническим рекомендациям [9], будут способствовать снижению показателей смертности от болезней органов пищеварения.
Цель исследования: оптимизация медицинской помощи пациентам с ЦП на основании анализа системных ошибок в тактике ведения этой группы больных в реальной клинической практике.
Методы
Рецензированию подверглись 523 медицинские карты пациентов, получавших медицинскую помощь в амбулаторных и стационарных условиях и умерших от ЦП в 2015–2019 гг. в районах Краснодарского края.
Результаты исследования
Были установлены особенности ведения пациентов с ЦП, выявлен и проанализирован ряд системных ошибок в тактике ведения этой группы больных (табл. 1–4)
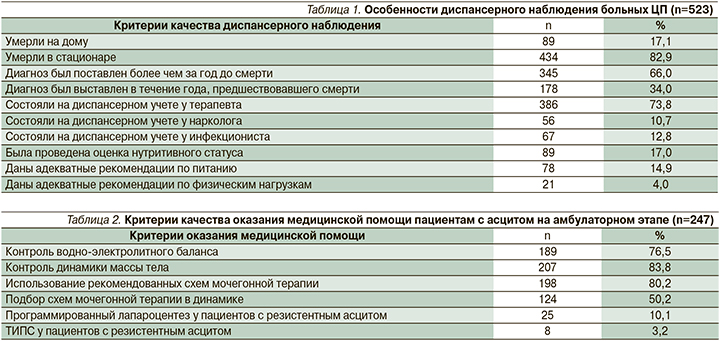
Из табл. 1 следует, что у 345 (66,0%) пациентов диагноз ЦП был поставлен более чем за год до смерти на стадии компенсации и субкомпенсации заболевания; медиана выживаемости в этой группе составила 3,4 года.
К сожалению, 178 (34,0%) больным диагноз был установлен в течение года, предшествовавшего летальному исходу – в большинстве случаев на стадии декомпенсации ЦП; медиана выживаемости составила 2,3 месяца. Как и следовало ожидать, большинство (386 человек [73,8%]) пациентов состояли на диспансерном учете у врача-терапевта и только 12,8% – у врача-инфекциониста и 10,7 % – у врача-нарколога. Не может не тревожить тот факт, что 17,1% пациентов с ЦП умерли на дому.
Из ошибок диспансерного наблюдения в поликлиниках по месту жительства обращает на себя внимание то обстоятельство, что только у 89 (17,0%) человек был адекватно оценен нутритивный статус и еще меньшему количеству больных (n=78) даны адекватные рекомендации по характеру питания. Вместе с тем амбулаторной гастроэнтерологической службой Краевой клинической больницы № 2 Министерства здравоохранения Краснодарского края ежеквартально проводятся школы для пациентов, в которых принимают участие 15–20 больных ЦП и их родственники. Врачи-гастроэнтерологи дают развернутые рекомендации по характеру питания этого сложного контингента больных с акцентом на необходимость поддержания адекватного баланса калорий и белкового обмена, важность вечернего перекуса, рассказывают о современных подходах к дозированным физическим нагрузкам больных ЦП. Это крайне важное направление вторичной профилактики, поскольку оно способствует улучшению показателей выживаемости пациентов и параметров их качества жизни [10, 11].
Не менее важным направлением профилактики декомпенсации ЦП и мероприятий по снижению смертности является адекватная терапия уже развившихся осложнений ЦП. На основании рецензирования карт амбулаторного пациента выявлен ряд системных ошибок в тактике ведения больных асцитом, ВРВП и клинически выраженной ПЭ (табл. 2–4).


Из табл. 2 следует, что в ряде случаев ведение пациентов с асцитом не соответствовало национальным клиническим рекомендациям [9]: только у 207 (83,8%) больных в динамике оценивалась масса тела, еще реже (76,5%) контролировался водно-электролитный баланс; у половины больных эффективность мочегонных схем корректировалась в динамике. Пациенты с асцитом, резистентным к стандартной медикаментозной терапии, как правило, подвергались программированным лапароцентезам, и только восьмерым в связи с резистентным асцитом выполнено трансъюгулярное портосистемное шунтирование (ТИПС).
Согласно данным табл. 3, только чуть больше половины (53,8%) больных выявленным ВРВП подвергались скрининговым эзофагогастродуоденоскопиям (ЭФГДС). При выявлении ВРВП 32 (22,1%) человека получали β-адреноблокаторы, 15 (10,3%) – нитраты, 32 (22,1%) проведено лигирование ВРВП, 15 (10,3%) человек получали комбинированное лечение (лигирование ВРВП и медикаментозную терапию). Важно отметить, что первичная и вторичная профилактика кровотечений из ВРВП не проведена каждому третьему пациенту (n=51). Проведенные в нашей клинике школы для пациентов и их родственников были направлены на обучение титрованию дозировок получаемых препаратов. Подчеркивается, что прием лекарств следует прекращать при снижении систолического артериального давления ниже 90 мм рт.ст. Этим подходам обучаются пациенты, находящиеся на курсовом лечении в амбулаторной службе ГБУЗ ККБ № 2 Министерства здравоохранения Краснодарского края. Следует помнить, что терапия β-адреноблокаторами может снижать выживаемость больных рефрактерным асцитом, спонтанным бактериальным перитонитом, артериальной гипотензией, гепаторенальным синдром, сепсисом, алкогольным гепатитом [12, 13].
В нашей клинике метод эндоскопического лигирования используется с 2008 г.
Для лигирования ВРВП применяют многозарядные лигаторы производства компаний «CookMedical», «EzyShoot» и «BostonScietific». С 2009 по ноябрь 2019 г. эндоскопическое лигирование выполнено 832 пациентам. Количество процедур лигирования составило 1149. Число этапов лигирования одному пациенту могло составлять от 1 до 8. Наиболее частыми сопутствовавшими эндоскопическими находками оказались портальная гастропатия (48,6%) и эрозивно-язвенные поражения верхних отделов желудочно-кишечного тракта (31,9%). Из 1149 выполненных за указанный период лигирований эффективными были 1134. В 15 случаях потребовалась установка зонда Блэйкмора. В четырех отмечены летальные исходы для пациентов с массивным кровотечением из вен кардии и дна желудка. Роль гастроэнтеролога заключается в назначении адекватной медикаментозной терапии сопровождения после эндоскопического лигирования. После процедуры лигирования больные находились в стационаре от 3 до 9 суток. После вмешательства в первые сутки рекомендуется только питьевой режим, далее со 2-х суток назначали 03 стол (хирургический) с последующим расширением до стола ЩД (щадящая диета), пища не должна быть горячей. Пациентам с белково-энергетической недостаточностью к рациону добавляли смеси для энтерального лечебного питания, рекомендовали пить их медленно через трубочку, маленькими глотками. После лигирования назначали ингибиторы протонной помпы внутривенно в течение 3 суток, далее с переходом на прием препаратов внутрь в стандартной дозе 2 раза в сутки в течение 1 месяца (до проведения контрольной ФГДС). Дополнительно в первые 10 дней использовали жидкие антациды 4–5 раз в сутки в интервалах между приемами пищи и на ночь. Контролировали регулярное опорожнение кишечника; для достижения мягкого стула 2–3 раза в сутки, не требоавшего натуживания, назначали лактулозу по 20–30 мл 1–2–3 раза в сутки (дозу подбирали индивидуально). Пациентам, не имевшим противопоказаний, возобновляли прием пропранолола, титруя дозу начиная с 10 мг в сутки.
Не меньше ошибок выявлено в тактике ведения пациентов с клинически выраженной ПЭ на амбулаторном этапе (табл. 4). Только 89 (57,1%) больным проводилось тестирование на ПЭ в динамике. Был выявлен ряд факторов, спровоцировавших и усугубивших течение ПЭ: нерациональная мочегонная терапия (23,1%), хронический запор (17,9%), пищевые нарушения, прием алкоголя (35,9%), прием психотропных препаратов (12,2%), бактериальная инфекция (21,8%). Из числа патогенетически обоснованных методов терапии для данной группы пациентов чаще применялись препараты лактулозы (66,7%), несколько реже – препараты LOLA (48,7%) и кишечные антисептики (19,9%).
В качестве методов первичной и вторичной профилактики ПЭ на амбулаторных школах пациентов с ЦП подробно обсуждаются факторы риска, провоцирующие и усугубляющие ПЭ, с родственниками больных ЦП проговаривается алгоритм действий при появлении или усугублении симптомов ПЭ.
Обсуждение результатов
Проведенный анализ выявил ряд существенных ошибок в тактике ведения пациентов с ЦП. На амбулаторном этапе участковые терапевты не уделяют достаточного внимания нутритивному статусу пациентов и дают неадекватные рекомендации по физическим нагрузкам. Вместе с тем хорошо известно, что дефицит массы тела, а у пациентов с ЦП в исходе неалкогольной жировой болезни печени и ожирение, саркопения закономерно часто встречается у больных терминальными стадиями заболеваний печени и служит независимым предиктором смертности [14–15]. Помимо снижения выживаемости мальнутриция и саркопения ассоциированы с повышением частота развития таких осложнений ЦП, как асцит, ПЭ и бактериальные инфекции [16–18].
К сожалению, крайне редко участковые терапевты дают развернутые рекомендации по физическим нагрузкам этому контингенту больных. Проведенные клинические исследования неоднократно демонстрировали, что дозированные резистентные физические нагрузки для больных ЦП способствуют увеличению мышечной массы и снижают риск развития ПЭ [19, 20].
Представленные данные выявили не меньшее количество ошибок в терапии таких осложнений ЦП, как асцит, ВРВП и ПЭ. Известно, что наличие асцита у пациента свидетельствует о плохом прогнозе [21], а медикаментозная терапия может быть ассоциированной с рядом нежелательных явлений. При проведении мочегонной терапии дозы диуретиков должны подбираться в динамике в соответствии с национальными и международными клиническими рекомендациями [9, 21] под контролем динамического измерения массы тела, окружности талии, пульса, артериального давления, с оценкой в динамике показателей электролитного обмена, креатинина и мочевины. К наиболее значимым осложнениям неадекватной мочегонной терапии относится острая почечная недостаточность, существенно снижающая выживаемость пациентов с декомпенсированным ЦП [22].
Из литературы известно, что ВРВП выявляется у 50% пациентов с ЦП, подвергшихся скрининговым ЭФГДС, а новые ВРВП обнаруживаются с частотой 8% в год среди лиц, ранее не имевших варикозно расширенных вен [23, 24]. Малые ВРВП прогрессируют в большие вариксы с частотой 8%, а кровотечения из ВРВП развиваются с частотой 12–15% в год [23, 24]. Смертность в связи с каждым эпизодом кровотечения в мире в настоящее время не ниже 15–20% [23]. Приведенные данные обосновывают клиническую значимость проведения первичной и вторичной профилактики кровотечений из ВРВП. Следует тщательно мониторировать гемодинамические показатели при назначении β-адреноблокаторов, что осуществлялось только в отношении 17,9% пациентов. Препараты целесообразно назначать в дозе, снижающей частоту пульса в покое на 25% либо до 55 ударов в минуту при исходно низком пульсе. Дозы пропранолола могут варьироваться от 10 внутрь (начальная) до 320 мг/сут (максимальная) и подбираются индивидуально. Более эффективно назначение препарата в вечернее время. Терапия должна проводиться в постоянном режиме, поскольку ее отмена возвращает угрозу риска кровотечения из ВРВП к исходному уровню. Возможно сочетание неселективных блокаторов β-адренорецепторов с нитратами (изосорбида-5-мононитратом) [9]. Для оптимизации тактики ведения этого сложного контингента больных следует проводить обучающие мероприятия как среди врачей первичного звена здравоохранения, так и в рамках школ для пациентов с ЦП.
Заключение
Представленный анализ продемонстрировал ряд системных ошибок в комплексной терапии ЦП в реальной клинической практике. Выявленные при рецензировании историй болезней стационарных и амбулаторных больных ошибки в тактике ведения регулярно обсуждаются на врачебных конференциях и комиссиях по разбору летальности. Данные разборы направлены на улучшение качества оказания медицинской помощи пациентам с терминальными заболеваниями печени. Важно подчеркнуть, что оптимизация качества оказания медицинской помощи этому сложному контингенту больных возможна только на основании мультидисциплинарного подхода с привлечением врачей-терапевтов, гастроэнтерологов, диетологов, хирургов, эндоскопистов, специалистов ЛФК.


