Введение
Язвенный колит (ЯК) – хроническое аутоиммунное заболевание неизвестной этиологии, характеризующееся диффузным воспалением слизистой оболочки толстой кишки, распространяющимся от прямой кишки в проксимальном направлении, и внекишечными (системными) проявлениями. Язвенный колит относится к тяжелым заболеваниям терапевтического профиля по причине рецидивирующего или непрерывного течения, частых осложнений, иногда требующих хирургического вмешательства и сомнительного прогноза [1].
Эпидемиологические исследования свидетельствуют о значительном росте заболеваемости ЯК в последние десятилетия, а также о больших расходах на лечение больных. В США, где распространенность ЯК составляет 286 на 100 тыс. человек, общая годовая стоимость лечения варьируется от 8,1 до 14,9 млрд долл. США [2, 3]. Самый высокий уровень заболеваемости ЯК отмечен в странах Северной Европы – до 505 на 100 тыс. населения при стоимости лечения, которая колеблется от 12, до 29,1 млрд евро. Мужчины и женщины болеют одинаково часто, причем пик заболеваемости приходится на социально активный возраст – от 20 до 40 лет [4].
Выбор консервативного или хирургического лечения определяется тяжестью атаки, протяженностью поражения толстой кишки, наличием внекишечных проявлений, длительностью заболевания, эффективностью и безопасностью ранее проводимой терапии, а также риском развития осложнений ЯК. Для сохранения длительной ремиссии больной ЯК должен оставаться на постоянной противорецидивной терапии [5, 6]. Тем не менее у половины больных ЯК рецидивирует в течение первого года после установления диагноза, ремиссия в течение 3–7 лет сохраняется лишь у 1/4 больных, а ежегодные рецидивы наблюдаются у 1/5 из них. Только у половины больных после первой атаки ЯК ремиссия сохраняется на протяжении 5 лет. Примерно 20% больных переносят колэктомию в течение 10 лет, 30% – в течение 25 лет. В среднем оперативные вмешательства при ЯК выполняются 10–20% пациентов [7].
Появление генно-инженерных биологических препаратов (ГИБП) значительно повлияло на продолжительность ремиссии, частоту рецидивов и развитие осложнений ЯК. Внедрение их в лечебную практику позволило эффективнее преодолевать гормонорезистентность и гормонозависимость ЯК, увеличить продолжительность безрецидивного периода, снизить риск развития рецидива, уменьшить частоту оперативных вмешательств и улучшить качество жизни больных [8]. Однако многие пациенты с ЯК не отвечают на терапию блокаторами фактора некроза опухоли α (ФНО-α). У 10–20% пациентов с ЯК отсутствует первичный ответ на терапию блокаторами ФНО-α, что расценивается как первичная неэффективность терапии [9, 10]. Кроме того, по данным некоторых авторов, пациенты, первоначально ответившие на терапию блокаторами ФНО-α, прекращают лечение в 17–22% случаев в связи с вторичной потерей ответа на терапию или с развитием нежелательных явлений (НЯ) [9, 10], в 19–40% случаев пациентам требуется повышение дозы препарата или уменьшение интервалов между введением [9]. Похожие сведения отображены в систематическом обзоре ученых Великобритании, по данным которого 26–37% пациентов прекращают лечение блокаторами ФНО-α в течение первого года, 28–41% – во 2-й год терапии [10], что расценивается как вторичная неэффективность терапии.
В случае неудачи терапии первым препаратом анти-ФНО-α пациента чаще всего переводят на другой блокатор ФНО-α. Ответ на второй блокатор ФНО-α после неудовлетворительных результатов лечения иным препаратом того же класса зависит от многих факторов, в первую очередь от того, по какой причине врач переводит пациента с одного ингибитора ФНО-α на другой. Причина перевода может быть связанной с непереносимостью препарата, первичной или вторичной неэффективностью терапии. Анализ объединенных данных свидетельствует, что в случае первичной неэффективности терапии ремиссия на втором препарате анти-ФНО-α достигается в 30% случаев, при развитии вторичной неэффективности терапии первым анти-ФНО-α ремиссия на втором анти-ФНО-α достигается в 45% случаев, при появлении НЯ на приеме первого анти-ФНО-α ремиссия после перевода пациента на другой препарат той же группы достигается в 61% случаев [9]. Также имеет место проблема гормонозависимости и гормонорезистентности, которая развивается почти у 50% пациентов [11].
Из сказанного выше понятно, что существует потребность в разработке новых видов лекарственных препаратов для лечения больных ЯК, которые позволили бы добиться быстрой индукции клинической ремиссии, снизить риск иммуногенности и иных побочных эффектов [12], иметь наименьшее число побочных эффектов [13].
Таким препаратом является тофацитиниб (ТФ) – синтетический селективный иммунодепрессант, первый представитель ингибиторов семейства янус-киназ (JAK). Тофацитиниб ингибирует JAK-1, JAK-3, в высокой концентрации – JAK-2 и тирозинкиназу-2 [14–16]. В России препарат впервые зарегистрирован в 2018 г. для лечения больных ЯК. В настоящее время опыт применения ТФ в реальной клинической практике невелик.
Цель: оценить эффективность и безопасность терапии тофацитинибом больных ЯК средней и тяжелой степеней в реальной клинической практике, выявить частоту и причины необходимости пролонгирования индукционного курса тофацитиниба больным ЯК.
Методы
В отделении воспалительных заболеваний кишечника ГБУЗ «Московский клинический научно-практический центр им. А.С. Логинова» Департамента здравоохранения Москвы наблюдали 35 больных активным ЯК, получавших тофацитиниб с ноября 2018 по декабрь 2019 г. Протокол исследования был утвержден Ученым советом и согласован с локальным этическим комитетом МКНЦ им А.С. Логинова.
Проанализированы следующие характеристики: пол, возраст пациента на момент начала терапии тофацитинибом, возраст на момент постановки диагноза, длительность заболевания, тяжесть и протяженность ЯК, наличие кишечных осложнений, наличие и локализация внекишечных проявлений (табл. 1), предшествовавшее лечение: терапия препаратами 5-аминосалициловой кислоты, иммуномодуляторами, глюкокортикостероидами (ГКС), биологическими препаратами; их количество в анамнезе, показатели активности воспалительного процесса перед началом терапии (табл. 2).
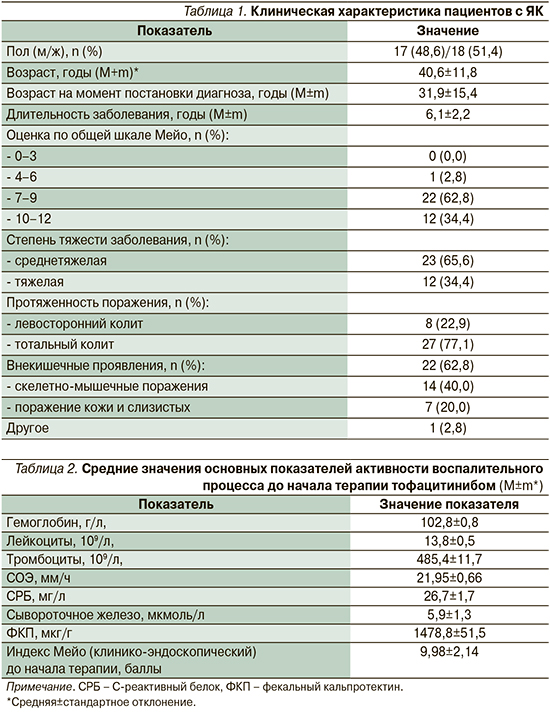
Большинство пациентов, включенных в исследование, имели длительный анамнез ЯК (более 6 лет), среднетяжелое (65,6%) и тяжелое (34,4%) течение заболевания, 77,1% диагностировано тотальное поражение кишечника, у 62,8% пациентов выявлены внекишечные проявления. Ни в одном наблюдении не было отмечено кишечных осложнений.
Показанием к назначению тофацитиниба служили стероидорезистентность – 6 (17,1%) пациентов, стероидозависимость – 12 (34,4%), первичная неэффективность или потеря ответа на ГИБП – 25 (71,4%).
До начала исследования большинство больных получали препараты 5-АСК (94,3%), иммуносупрессоры (51,4%) и ГКС (97,1%). Различные ГИБП в анамнезе получали 2/3 пациентов – 25 (71,4%), в т.ч. 6 (17,1%) – 2 (5 (14,3%)) или 3 (1 (2,8%)) препарата. Чаще назначался инфликсимаб (40,0%), другие ингибиторы ФНО-α применялись реже, преимущественно во 2-й и 3-й линиях биологической терапии: по 3 (8,6%) пациента с ЯК получали ведолизумаб и адалимумаб, 5 (14,3%) – голимумаб.
Тофацитиниб назначали по стандартной схеме: для индукционного курса по 10 мг 2 раза в сутки в течение 8 недель с последующим снижением дозы до поддерживающей (по 5 мг 2 раза в сутки). Согласно инструкции по медицинскому применению пациентами с неполным ответом на индукционный курс, возможно продление терапии еще на 8 недель в индукционной дозе 10 мг 2 раза в сутки.
Критерии оценки лечения:
- быстрый клинический ответ – уменьшение выраженности или исчезновение клинических симптомов после 1-й недели лечения;
- ранний клинический ответ – положительная динамика клинических симптомов и эндоскопической картины, внекишечных проявлений после индукционного курса на 8-й неделе лечения;
- клиническая ремиссия – исчезновение примеси крови в стуле и снижении частоты дефекаций до 3 раз в сутки и менее;
- стойкая ремиссия – достижение и поддержание клинической ремиссии на протяжении 12 недель после начала терапии.
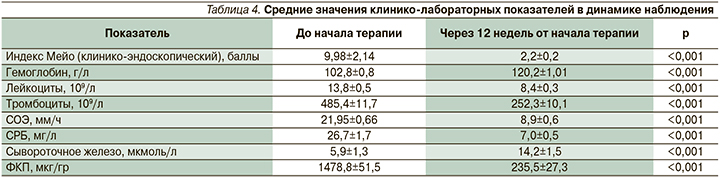
Оценивали динамику клинических симптомов и показателей активности воспалительного процесса на 12-й неделе лечения.
Ответом на лечение считали уменьшение оценки по шкале Мейо не менее, чем на 30%, а ремиссией – оценку по шкале Мейо 0–3 баллов (табл. 3). Об эндоскопической ремиссии судили по шкале оценки состояния слизистой оболочки по Schroeder [17].
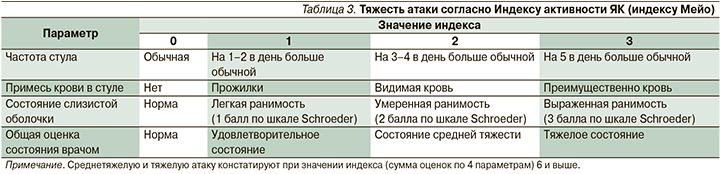
Отсутствие значительного улучшения состояния, прекращение лечения тофацитинибом или перевод на ГИБП считали неудачей терапии. Оценивали необходимость пролонгации до 16 недель индукционного курса ТФ пациентам с недостаточным клиническим ответом на 8-й неделе терапии (снижение частичного индекса Мейо менее 30%) и отсутствием нормализации лабораторных показателей (СОЭ, СРБ, гемоглобин, ФКП).
Статистический анализ выполняли с помощью компьютерной программы IBM SPSS Statistics 24.0. Анализ качественных параметров проводили по частотам встречаемости. Для описания количественных переменных использовали методы описательной статистики: среднее (Mean), стандартное отклонение (Std. Deviation).
Результаты
Всем пациентам с ЯК был назначен тофацитиниб в индукционной дозе 10 мг 2 раза в сутки. Быстрый ответ на терапию ТФ оценивали на 1-й неделе. Быстрый клинический ответ на 3-й день лечения, характеризующийся урежением частоты стула, уменьшением крови в стуле, был отмечен у 18 (51,4%) из 35 пациентов. Скорость достижения клинического ответа в нашем анализе коррелирует с данными, полученными при анализе опросников пациентов, включенных в исследование OCTAVE Induction 1,2: на 3-й день терапии статистически значимо ниже были показатели частоты стула и ректального кровотечения у пациентов, получавших тофацитиниб, по сравнению с теми, кто принимал плацебо [18].
У 26 (74,3%) пациентов на 8-й неделе терапии была отмечена клиническая ремиссия по шкале Мейо, 8 (22,8%) пациентов достигли показателей клинического ответа, у 1 (2,8%) – положительной динамики не выявлено.
Ни одному пациенту с ЯК, ранее не получавшему препаратов анти-ФНО-α (n=10), не потребовалось пролонгирования индукционного курса тофацитиниба. Оценивали необходимость пролонгации до 16 недель индукционного курса тофицитиниба пациентам с недостаточным клиническим ответом на 8-й неделе терапии (снижение частичного индекса Мейо менее 30%) и отсутствием нормализации лабораторных показателей (СОЭ, СРБ, гемоглобин, ФКП). В целом в подгруппе пациентов (n=25), ранее принимавших препараты анти-ФНО-α, пролонгированный индукционный курс тофацитиниба потребовался 10 (40,0%) пациентам (χ2=5,6; р=0,018).
Обсуждение
Все 35 (100,0%) пациентов к моменту анализа данных завершили 12 недель терапии. Из них у 26 (74,3%) сохранялась достигнутая клиническая ремиссия, у 7 (20%) отмечен клинический эффект, у 2 (10%) клиническая картина не улучшилась. В связи с отсутствием ответа на проведенную терапию: сохраняющейся или незначительно уменьшившейся кровавой диареей, анемией, лейкоцитозом, высоким уровнем СРБ, СОЭ, прокальцитонина и ФКП, пациентам были назначены ГИБП по схемам в соответствии с клиническими рекомендациями [6].
Большинству пациентов с клинической ремиссией на 8-й и 12-й неделях также удалось достичь заживления слизистой оболочки. На 8-й неделе эндоскопическое исследование было проведено 28 пациентам, из них у 20 (71,4%) была констатирована ремиссия. На 12-й неделе обследованы 33 пациента и у 22 (66,6%) из них зафиксировано заживление слизистой. Среди 11 пациентов, которым не удалось достичь полной клинико-эндоскопической ремиссии, большинство было тех, кто ранее получал ГИБП, – 9 (81,8%) человек. Следует отметить, что все пациенты, достигшие эндоскопической ремиссии после индукционного курса, сохранили ее к 12-й неделе.
Данные опубликованных в настоящее время наблюдений в условиях реальной клинической практики не позволяют провести сравнение с нашими результатами в связи с различиями анализируемых параметров эффективности и предикторов пролонгирования индукционного курса ТФ [20–23].
Через 12 недель у всех пациентов, ответивших на терапию тофацитинибом, индекс Мейо в среднем снизился с 9,98±2,14 до 2,2±0,2 (табл. 4).
Внекишечная манифестация ЯК до начала терапии тофацитинибом отмечена у 22 (62,8%) пациентов. У большинства из них (14 [40%]) имелись мышечно-скелетные проявления (артралгии, периферические артриты, аксиальные поражения), у 7 (20%) отмечено поражение кожи и слизистых, у 1 (2,8%) – заболевание печени (первичный склерозирующий холангит). На 8-й неделе лечения уменьшение выраженности симптомов поражения суставов отмечено у 10 (71,4%) из 14 пациентов, регресс признаков поражения кожи и слизистых – у 4 (57,1%) из 7 пациентов, без динамики – у 4 (28,6%) и 3 (42,8%) пациентов соответственно. К 12-й неделе положительная динамика наблюдалась уже у 85,7% (12 из 14) и 71,4% (5 из 7) обследованных соответственно. Утяжеления симптомов внекишечных проявлений любой локализации не наблюдалось ни у одного пациента.
В целом препарат характеризовался хорошей переносимостью. Ни в одном случае не отмечено НЯ, которые могли бы служить причиной отмены препарата. Результаты мета-анализов показали, что частота побочных эффектов (анемия, активация вируса герпеса) и серьезных НЯ не различалась в группах пациентов, получавших тофицитиниб и другие методы лечения [24, 25].
В опубликованных на сегодняшний день исследованиях в условиях реальной клинической практики профиль безопасности тофацитиниба был приемлемым, частота и спектр НЯ соответствовали таковым, полученным ранее в регистрационных и постмаркетинговых исследованиях [20–23].
Заключение
В диагностике и лечении ЯК был достигнут значительный прогресс, но не теряет актуальности разработка новых терапевтических подходов, опций, которые могут помочь уменьшить клинические последствия, повысить качество жизни пациентов, снизить экономические расходы, связанные с заболеванием, в идеальном случае – изменить естественное течение болезни. Тофацитиниб как первый зарегистрированный для терапии ЯК препарат в классе ингибиторов янус-киназ представляет собой новую перспективную альтернативу в лечении ЯК.
Наше исследование, как и предшествовавшее многоцентровое открытое проспективное неконтролируемое когортное исследование, проведенное в городах РФ, продемонстрировало высокую эффективность препарата в индукционной и поддерживающей терапии в когорте больных тяжелыми и среднетяжелыми, резистентными к базисным и генно-инженерным биологическим препаратам формами ЯК [26]. В нашем исследовании было установлено, что необходимость в пролонгировании до 16 недель индукционного тофацитиниба больным ЯК достоверно выше у пациентов, получавших ранее один или несколько анти-ФНО-α препаратов. Необходимы дальнейшие исследования для изучения долгосрочной эффективности и безопасности тофацитиниба в реальной клинической практике.


