Введение
Рак желудка остается одной из главных проблем здравоохранения в различных странах мира [1]. В 2018 г. на планете было зарегистрировано более 1 млн новых случаев и 783 тыс. смертей от этой патологии [2]. Отчетливой тенденции к снижению заболеваемости раком желудка до сих пор не отмечено [3]. В связи с этим предпринимаются большие усилия для решения этой проблемы [4]. Одним из наиболее очевидных решений в этом плане служит создание градации предраковых изменений в желудке [5] для совершенствования вторичной профилактики новообразований [6]. Наша работа направлена на поиск факторов, позволяющих стратифицировать выраженность проявлений атрофического гастрита (АГ).
Цель исследования: изучение показателей иммунного статуса в крови больных в зависимости от стадии АГ по системе OLGA.
Методы
Работа выполнена на базе НИИ медицинских проблем Севера ФИЦ КНЦ СО РАН. В исследование были включены 125 пациентов в возрасте от 18 до 80 лет: 52 практически здоровых добровольцев и 73 больных АГ.
Критерии исключения из исследования: наличие в анамнезе выраженных хронических заболеваний органов дыхания, сердечно-сосудистой системы, органов пищеварения, мочеполовой, нервной и эндокринной систем, опорно-двигательного аппарата, диффузных болезней соединительной ткани, гематологических заболеваний, новообразований, ВИЧ-инфекции, туберкулеза; любые сопутствующие острые и хронические заболевания в фазе обострения; отказ от участия в исследовании.
Контрольная группа была сформирована из 52 здоровых лиц (26 мужчин и 26 женщин, средний возраст – 48,2±4,0 года), проходивших плановую диспансеризацию в НИИ МПС ФИЦ КНЦ СО РАН. Здоровые пациенты определены на основании отсутствия гастроэнтерологического анамнеза и клинических симптомов заболеваний органов пищеварения, содержания пепсиногена-1 (ПГ-1) в крови >50 мкг/л, соотношения ПГ-1/ПГ-2 >3.
У всех пациентов результат определения инфекции Helicobacter pylori был положительным.
Вторая группа состояла из 73 пациентов (38 мужчин и 35 женщин, средний возраст – 49,9±4,6 года) с АГ тела желудка, обследованных в клинике НИИ МПС ФИЦ КНЦ СО РАН. Диагноз установлен врачом-гастроэнтерологом на основании клинического обследования, наличия инфекции H. pylori и атрофии слизистой оболочки желудка при гистологическом исследовании.
Исследование проведено с разрешения этического комитета НИИ МПС ФИЦ КНЦ СО РАН (протокол № 11 от 11.11.2013). В работе с обследованными пациентами соблюдались этические принципы, предъявляемые ст. 24 Конституции РФ и Хельсинкской декларацией Всемирной медицинской ассоциации. Каждый участник подписывал форму информированного согласия на обследование, подтвердившее его добровольное участие в исследовании.
Всем пациентам проведен стандартный клинический осмотр врача-гастроэнтеролога, результаты которого регистрировались в специально разработанной анкете. Анкета содержала вопросы, в которых фиксировались жалобы, анамнез, результаты объективного осмотра, анализировались назначения. В дизайн исследования для уточнения наличия сопутствующей патологии входили обследования по стандарту для пациентов с гастритом, включившие развернутый и биохимический анализы крови, общий анализ мочи, анализ кала на скрытую кровь, на яйца глистов и копрологическое исследование, а также ультразвуковое исследование органов брюшной полости. Лабораторные анализы проведены в клинико-диагностической лаборатории НИИ медицинских проблем Севера.
Пациентам контрольной группы проведено определение пепсиногенов и антител к H. pylori в сыворотке крови с помощью иммуноферментного анализа (ИФА) на ИФА-анализаторе «СтатФакс-3000» с использованием тест-системы «Гастропанель» («Биохит», Финляндия). Нормальными считали уровень ПГ-1 >50 мкг/л и соотношение ПГ-1/ПГ-2 >3. Титры антител к H. pylori ≥30 EIU считали положительным, <30 EIU – отрицательным результатом определения H. pylori.
Фиброэзофагогастродуоденоскопия (на аппарате Olimpus-10) и морфологическое исследование биоптатов желудка осуществлены 73 пациентам с АГ на базе клинико-диагностического отделения НИИ медицинских проблем Севера. Во время эндоскопического исследования осуществлен забор пяти биоптатов из слизистой оболочки желудка – два кусочка из антрального отдела, один из передней стенки, один из задней стенки тела желудка и один биоптат из incisura angularis. Оценка АГ осуществлена по системе OLGA [7] в гистологических препаратах, окрашенных гематоксилином и эозином. H. pylori определен гистологическим методом в препаратах, окрашенных по Романовскому–Гимзе.
Исследование иммунного статуса включило определение количества лейкоцитов и лимфоцитов, показателей клеточного иммунитета методом непрямой иммунофлуоресценции лимфоцитов с помощью моноклональных антител к CD3, CD4, CD8, CD16, CD19 (ТОО «Сорбент», Москва). Для дополнительной характеристики Т-клеточного звена иммунной системы вычислено соотношение (CD4+/CD8+).
По результатам исследования на персональном компьютере в пакете электронных таблиц MSExcel-2010 сформирована база данных. Статистическая обработка данных проведена с помощью пакетов прикладных программ Statistica for Windows 8.0 (StatSoftInc.; США, 2008) и Microsoft Excel, 2007 (Microsoft, США). Обработка полученных данных включила подсчет непараметрических данных: медиану (Me) и квартили (С25-С75). Статистическую значимость различий определяли с использованием критерия Манна–Уитни. Достоверным считался уровень значимости при р≤0,05.
Результаты
У пациентов с АГ III–IV стадий по системе OLGA отмечено уменьшение как общего количества лейкоцитов, так и абсолютного содержания лимфоцитов в крови по сравнению с контрольной группой (табл. 1). При этом определены достоверные различия между пациентами с атрофией I стадии по системе OLGA по сравнению с больными АГ IV стадии по системе OLGA относительно абсолютного содержания лейкоцитов (р=0,03) и лимфоцитов (р=0,006). Эти данные указывают на угнетение клеточного звена иммунитета у больных АГ.
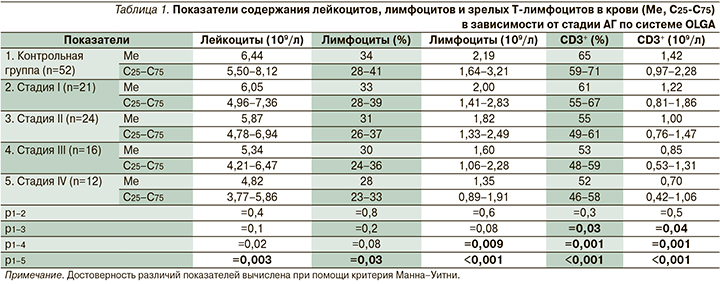
CD3 служит маркером зрелых Т-лимфоцитов, в функции которого входит передача сигналов в клетку, а также стабилизация Т-клеточного рецептора на поверхности мембраны [8]. Относительные и абсолютные показатели CD3+-лимфоцитов в крови были значительно ниже у пациентов с АГ II–IV стадий по системе OLGA по сравнению с группой здоровых лиц, при этом количество Т-лимфоцитов было более низким у пациентов с более высокой стадией АГ по системе OLGA (табл. 1).
CD4+-лимфоциты (Т-хелперы) выполняют важную роль в клеточном и гуморальном иммунных ответах, главной их функцией считается активация других иммунных клеток и выделение цитокинов [9]. Нами было зарегистрировано снижение как абсолютного количества Т-хелперов в крови, так и их относительного содержания у пациентов с АГ III–IV стадий по системе OLGA по сравнению с контрольной группой (табл. 2). При этом имелись достоверные отличия между пациентами с атрофией I стадии по системе OLGA и больными АГ IV стадии по системе OLGA относительно абсолютного (р=0,001) и относительного (р=0,004) содержания Т-хелперов в крови.
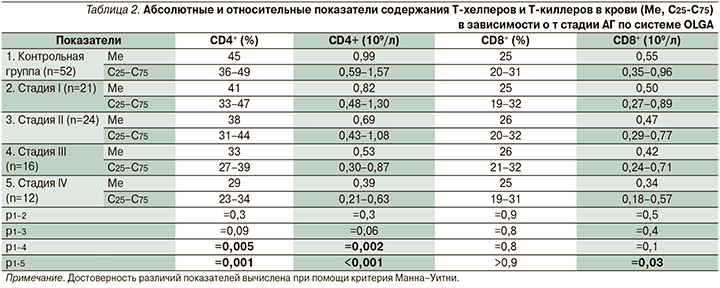
CD8+-клетки (Т-киллеры или Т-цитотоксические клетки) – субпопуляция эффекторных Т-лимфоцитов, осуществляющих лизис поврежденных клеток организма (пораженные внутриклеточными паразитами и опухолевые клетки) [10]. По относительному содержанию CD8+-клеток в крови не обнаружено достоверных различий между пациентами со всеми стадиями АГ по системе OLGA и контрольной группой. Наблюдалось снижение абсолютного содержания CD8+-лимфоцитов у пациентов с АГ IV стадии по системе OLGA по сравнению со здоровыми лицами (табл. 2).
Важное значение в исследовании показателей иммунного статуса имеет иммунорегуляторный индекс, определяемый по соотношению CD4+/CD8+ (Т-хелперы/Т-киллеры). Этот коэффициент был равен 1,8 у лиц контрольной группы; 1,64 при атрофии I стадии по системе OLGA (р1-2=0,6), 1,47 при II стадии (р1-3=0,1); 1,26 при III стадии (р1-4=0,02) и 1,15 при IV стадии АГ по системе OLGA (р1-5=0,004; р2-5=0,03). Обнаруженные закономерности свидетельствуют об очевидном наличии иммунодефицита у пациентов с АГ по сравнению с контрольной группой, который усугубляется при увеличении стадии атрофии по системе OLGA.
Относительное содержание CD16+-клеток (натуральных киллеров, NK-клеток) было достоверно ниже у пациентов с атрофией IV стадии по системе OLGA по сравнению с контрольной группой (табл. 3) и лицами с АГ I стадии по системе OLGA (р=0,03). Абсолютное содержание NK-клеток было относительно низким у больных АГ III–IV стадий по системе OLGA по сравнению со здоровыми лицами (табл. 3) и пациентами с атрофией I стадии по системе OLGA (р2-4=0,047; р2-5=0,003). Это имеет важное значение в связи с тем, что натуральные киллеры обладают противоопухолевой активностью [11]. Данная ассоциация соответствует логике каскада Корреа и указывает на то, что риск рака желудка повышается у пациентов с выраженным АГ, подтверждая эффективность системы OLGA для определения риска развития рака желудка.
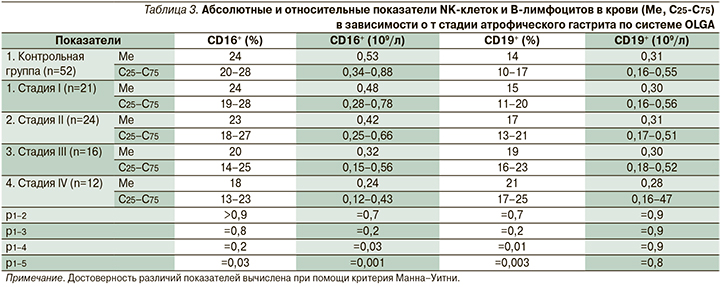
CD19 представляет собой специфичный для B-лимфоцитов антиген. B-лимфоциты являются главными клетками, обеспечивающими гуморальный иммунитет путем трансформации в плазматические клетки, которые продуцируют антитела. Помимо продукции антител В-лимфоциты превращаются в B-клетки памяти, выступать в качестве антигенпрезентирующих клеток, продуцировать цитокины и т.д. [12]. Относительное содержание CD19+-клеток было повышено в крови у больных АГ III–IV стадий по системе OLGA по сравнению со здоровыми лицами (табл. 3) и пациентами с атрофией I стадии по системе OLGA (р2-4=0,03; р2-5=0,007). При этом по абсолютному содержанию этих клеток достоверных различий у исследуемых групп выявлено не было. Это может быть обусловлено тем, что вследствие угнетения Т-клеточного звена иммунитета увеличивается относительная доля В-лимфоцитов без существенного изменения их абсолютного содержания.
Обсуждение
Следует подчеркнуть, что механизмы развития рака желудка до настоящего времени остаются недостаточно ясными [13]. На развитие патологии влияют три основные группы факторов: восприимчивость и реакция макроорганизма, условия окружающей среды и свойства бактерии H. pylori [14]. Некоторые штаммы H. pylori характеризуются повышенной выживаемостью, способностью к адгезии, что увеличивает повреждение клеток эпителия желудка и позволяет уклоняться от иммунного ответа макроорганизма [15]. После адгезии H. pylori нарушают внутриклеточные процессы в эпителии, вызывая воспаление и эпигенетические модификации [16]. Ответ организма хозяина сопровождается привлечением иммунных клеток в очаг воспаления, выделением ими цитокинов и при определенных условиях – образованием активных форм кислорода, которые приводят к оксидативному стрессу, способствуя повреждению ДНК и канцерогенезу [17]. В инфицированных H. pylori клетках возможен запуск процессов, препятствующих активации ответа иммунной и антиоксидантной систем организма хозяина [18, 19].
Несмотря на определенные достижения и многочисленные международные рекомендации, принятые в последнее время [20–22], ответа на вопрос, почему рак желудка возникает только у небольшой группы лиц с АГ, нет до настоящего времени. Рационально считать, что повышение эффективности профилактики рака желудка возможно при определении факторов, влияющих на прогрессирование атрофии и метаплазии в дисплазию и рак [21–23]. Возникновение изменений иммунного статуса и оксидативного стресса может иметь важное значение в определении выраженности предраковых изменений и установлении риска развития онкологического заболевания, что в свою очередь будет способствовать и разработке нового направления диагностических и лечебно-профилактических мероприятий.
Заключение
Таким образом, у больных хроническим АГ III–IV стадий по системе OLGA по сравнению со здоровыми лицами отмечалось угнетение Т-клеточного звена иммунитета, проявившееся в снижении абсолютного количества лейкоцитов и лимфоцитов; уменьшении абсолютного и относительного содержания зрелых Т-лимфоцитов, CD4+-клеток, иммунорегуляторного индекса (CD4+/CD8+) и NK-клеток. Нарушение клеточного звена иммунитета было ассоциировано с увеличением стадии атрофии по системе OLGA. В целом эти данные позволяют считать, что комбинация применения морфологической системы OLGA с определением иммунных показателей повышает возможность стратификации АГ по определению риска развития рака желудка.


