Введение
В настоящее время врачам-интернистам все чаще приходится сталкиваться с проблемой коморбидности и необходимостью назначения массы лекарственных препаратов. С одной стороны, коморбидность сама по себе является независимым фактором риска летального исхода и неблагоприятного прогноза для заболевания и жизни [1]. С другой стороны, неизбежная полипрагмазия при коморбидной патологии сопряжена с многочисленными неблагоприятными последствиями, что требует тщательного анализа рисков межлекарственных взаимодействий, а также риска поражения других органов и систем. Наиболее часто в клинической практике встречаются лекарственное поражение печени и повреждение слизистых оболочек пищеварительного тракта.
Хорошо известен негативный эффект нестероидных противовоспалительных препаратов (НПВП) и антиагрегантов на верхние отделы желудочно-кишечного тракта. Кроме того, не только НПВП, но и ряд других препаратов, таких как антикоагулянты, антибиотики, химиотерапевтические средства, ингибиторы протонной помпы, блокаторы рецепторов к ангиотензину II, могут вызывать повреждение слизистых оболочек пищеварительного тракта.
Целью данного обзора является систематизация и актуализация сведений о поражениях кишечника, связанных с приемом вышеуказанных лекарственных средств.
Истинная распространенность поражений кишечника на фоне приема лекарственных препаратов не известна. Данные отдельных эпидемиологических исследований довольно разнородны и колеблются в пределах 3–22% от всех случаев обращений за медицинской помощью по поводу кишечных симптомов [2]. Пожилой возраст, наличие сопутствующих заболеваний и количество принимаемых пациентом препаратов служат основными факторами, связанными с повышением риска развития лекарственно-индуцированного поражения кишечника [3].
Поражение кишечника на фоне приема лекарственных средств может сопровождаться различными морфологическими и функциональными изменениями. В большинстве случаев клинические проявления лекарственно-индуцированного поражения кишечника включают вздутие, абдоминальную боль и диарею, сохраняющиеся в ночные часы. Иногда могут отмечаться лихорадка и появление крови в кале. Выраженность симптомов может широко варьироваться от невыраженных до интенсивных, имитирующих картину острого живота. Данные физикального обследования также достаточно вариабельны и неспецифичны. Важным диагностическим критерием лекарственно-индуцированного колита является то, что отмена препарата быстро приводит к улучшению самочувствия пациента [4].
Необходимо отметить, что некоторые лекарственные препараты в силу своего фармакологического действия могут обусловливать различные нарушения функции кишечника, не вызывая при этом поражения слизистой оболочки кишки. Так, сердечный гликозид дигоксин, ингибируя Na+/K+ обмен, может стать причиной потери натрия на уровне кишки и развития секреторной диареи. Осмотическая диарея без признаков стеатореи может возникать при использовании осмотических слабительных, таких как лактулоза или макрогол (полиэтиленгликоль), с наличием признаков стеатореи — на фоне применения ингибитора липазы орлистата или секвестранта желчных кислот холестирамина. Диарею вследствие повышенной моторной активности кишечника вызывают препараты с прокинетическим действием, которые повышают активность мигрирующего моторного комплекса желудка и кишечника (макролиды, агонисты рецепторов серотонина 5-НТ4). Напротив, замедление моторики кишечника и как следствие – запоры могут возникать в результате применения блокаторов кальциевых каналов, антихолинергических препаратов, трициклических антидепрессантов, препаратов висмута, железа, опиоидных анальгетиков [2, 5, 6].
Патогенетические механизмы, лежащие в основе развития поражения слизистой оболочки кишечника вследствие воздействия лекарственных средств, до конца не раскрыты. Общеизвестно, что заболевания пищеварительного тракта формируются в результате дисбаланса между факторами защиты и агрессии по отношению к слизистой оболочке. В последнее десятилетие появились новые представления о патофизиологии заболеваний пищеварительного тракта с позиции участия в их формировании повреждения мукозального барьера. Неотъемлемой частью и центральным регулятором мукозального барьера является микробиота [7]. Установлено, что нарушение целостности мукозального барьера и изменение состава кишечной микробиоты повышают восприимчивость слизистой оболочки кишечника к повреждающему действию различных агрессивных факторов, в т.ч. лекарственных препаратов [2, 8].
Нестероидные противовоспалительные препараты, антиагреганты и антикоагулянты
Среди всего многообразия лекарственных препаратов, которые могут вызывать поражение органов пищеварительного тракта, лидирующее место занимают НПВП.
Нестероидные противовоспалительные препараты были и остаются самым популярным классом обезболивающих средств. На российском фармакологическом рынке имеется широкий выбор НПВП – порядка 30 лекарственных молекул, многие из которых представлены десятками генериков. При этом ряд НПВП относятся к безрецептурным, а следовательно, доступны массе лиц, о чем можно судить по объему их реализации. Так, по данным Росстата, только за 2017 г. в России было продано 125 млн упаковок различных НПВП [9].
Анальгетический и противовоспалительный эффект НПВП реализуется за счет ингибирования фермента циклооксигеназы (ЦОГ), участвующей в распаде арахидоновой кислоты до простагландинов, простациклина и тромбоксана. Известно две изоформы фермента ЦОГ: ЦОГ-1 и ЦОГ-2. Поражение слизистых оболочек пищеварительного тракта объясняется блокадой ЦОГ-1 и снижением синтеза защитных простагландинов (простагландин Е2, простациклин) [10]. Большинство НПВП являются неселективными ингибиторами как ЦОГ-1, так и ЦОГ-2. Считается, что селективные ингибиторы ЦОГ-2 (целекоксиб, эторикоксиб) в меньшей степени вызывают поражение слизистых оболочек. Однако следует отметить, что селективность в отношении ЦОГ-2 не есть понятие абсолютное и не исключает повреждающего действия даже «высокоселективных» препаратов.
Широкий спектр побочных эффектов, характерный для НПВП, особенно при бесконтрольном их применении, побудил экспертов Ассоциации ревматологов России, Российского общества по изучению боли, Российской гастроэнтерологической ассоциации, Российского научного медицинского общества терапевтов, Ассоциации травматологов-ортопедов России, Российской ассоциации паллиативной медицины к созданию клинических рекомендаций по рациональному использованию НПВП с целью снижения частоты потенциально опасных «класс-специфичных» осложнений [9].
Наиболее изученным НПВП-индуцированным поражением пищеварительного тракта является поражение слизистой оболочки желудка и двенадцатиперстной кишки. Показано, что длительный прием НПВП повышает риск развития язвы желудка в 3–4 раза и с ним связаны не менее 40–50% кровотечений из верхних отделов желудочно-кишечного тракта, требующих хирургического или эндоскопического гемостаза [9–12]. При этом установлено, что частота НПВП-индуцированного поражения кишечника сопоставима с частотой гастропатии (см. таблицу) [9]. Тем не менее осведомленность врачей об НПВП-индуцированной энтеро- и колопатии остается крайне низкой, и на практике при необходимости назначения НПВП все сводится лишь к профилактике поражения гастродуоденальной зоны.
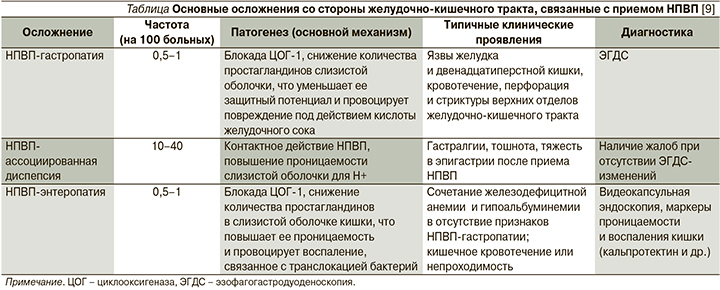
Основными критериями НПВП-гастропатии являются хронологическая связь с приемом препарата, зачастую отсутствие клинических проявлений и манифестация язвенным кровотечением, наличие острых множественных эрозий, как правило в антральном отделе желудка, фовеолярная гиперплазия слизистой оболочки, отсутствие воспалительного вала вокруг язвенного дефекта, быстрое заживление после отмены препарата [13].
К сожалению, при приеме НПВП имеется риск повреждения не только слизистой оболочки верхних отделов пищеварительного тракта, но и кишечника, что было показано в ряде крупных рандомизированных клинических исследований, проведенных после появления метода капсульной эндоскопии [10, 14, 15].
Механизмы, посредством которых НПВП повреждают кишечник, не совсем понятны. Безусловно, они отличаются от тех, которые реализуются в верхних отделах пищеварительного тракта. Повреждающее действие НПВП на слизистую оболочку кишечника может быть опосредовано прямым токсическим эффектом после перорального приема, рецидивирующим токсическим эффектом, обусловленным энтерогепатической рециркуляцией препарата, и системным эффектом после этапа кишечной абсорбции. Известно, что НПВП увеличивают проницаемость кишечника, вызывая развитие т.н. феномена дырявой кишки, в результате чего токсины, бактерии, желчные кислоты, секрет поджелудочной железы из просвета кишки могут проникать под слизистую оболочку и вызывать воспалительные реакции с формированием эрозивно-язвенных дефектов (см. рисунок) [10, 13].
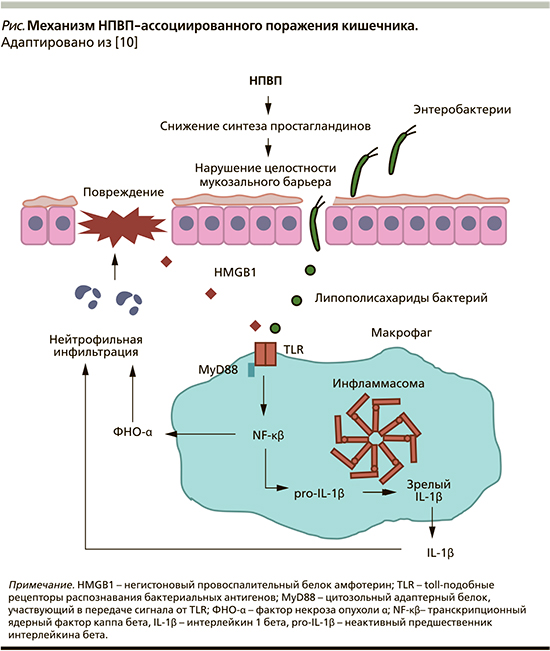
Предполагается участие кишечной микробиоты в появлении повреждений слизистой оболочки кишечника. В эксперименте введение Lactobacillus acidophilus и Bifidobacteria adolescentis уменьшает вызванное НПВП изъязвление подвздошной кишки, а пробиотическая смесь VSL#3 поддерживает нормальные уровни кальпротектина у здоровых добровольцев, получающих индометацин [16]. Также у пациентов, получающих Lactobacillus casei и низкие дозы аспирина, были отмечены значительно меньшие размеры эрозий слизистой оболочки тонкой кишки [17].
Морфологическая картина и степень выраженности поражения кишечника зависят как от самой молекулы НПВП, так и от состояния пациента: возраста, сопутствующей патологии, приема других лекарственных препаратов [14, 15, 18].
Несмотря на то что НПВП-индуцированным поражениям кишечника клиницистами не уделяется должного внимания, они могут стать причиной острых и жизнеугрожающих осложнений, таких как кровотечение, перфорация или кишечная непроходимость [9–12].
Отсутствие должной осведомленности врачей о поражении кишечника на фоне приема НПВП связано прежде всего с тем, что ни НПВП-энтеро-, ни НПВП-колопатия не имеют характерных клинических или эндоскопических признаков. Наиболее часто НПВП-энтеропатия сопровождается скрытой кровопотерей и развитием хронической железодефицитной анемии, которая усугубляет течение кардиоваскулярных заболеваний, бронхолегочной патологии, повышает риск тромбоэмболических осложнений. Реже встречается НПВП-энтеропатия, сопровождающаяся потерей белка и гипоальбуминемией [9, 10]. Иногда первым проявлением НПВП-энтеропатии становится кровотечение или перфорация тонкой кишки [2, 9, 10].
По данным видеокапсульной эндоскопии, в большинстве случаев НПВП-энтеропатия проявляется наличием геморрагий, эрозий на слизистой и небольших (до 3–5 мм в диаметре) неглубоких язв [9, 13]. Единственным патогномоничным признаком поражения тонкой (реже толстой) кишки, ассоциированным с длительным применением НПВП, считается формирование циркулярных, диафрагмоподобных стриктур в исходе хронического воспалительного процесса с выраженной лимфогистиоцитарной инфильтрацией и фиброзом. Данные стриктуры чаще локализуются в подвздошной кишке и могут стать причиной кишечной непроходимости [9, 10, 19].
При НПВП-индуцированной колопатии в патологический процесс обычно вовлекаются правые отделы толстой кишки. Проявления НПВП-индуцированной колопатии могут варьироваться от острого воспаления и эрозивно-язвенных дефектов до хронического колита с развитием фиброза и стриктур [2, 3]. Показано, что приблизительно 3–10% вновь диагностированных колитов ассоциированы с применением НПВП [20]. Тяжесть поражения слизистой оболочки толстой кишки безусловно зависит от длительности приема препарата, при этом НПВП-индуцированный колит может развиваться уже через несколько дней от начала приема [21]. Установлено, что развитие эрозивно-язвенных поражений толстой кишки одинаково часто встречается как при пероральном, так и при парентеральном способе введения НПВП. Использование ректальных суппозиториев нередко сопровождается поражением слизистой оболочки прямой кишки [2, 20, 21]. В литературе описано даже формирование стриктур прямой кишки в результате длительного использования ректальных свечей с ибупрофеном [22].
В ряде исследований показано, что НПВП повышают риск развития кровотечения и перфорации толстой кишки на фоне уже имеющейся дивертикулярной болезни [2, 3, 23]. К тому же НПВП могут играть роль триггера при лимфоцитарном и коллагенозном колите, а также провоцировать дебют или обострение ишемического колита и воспалительных заболеваний кишечника (ВЗК) [2, 13, 18]. Последнее особо актуально для пациентов, у которых ВЗК сочетаются с ревматологическими заболеваниями, такими как анкилозирующий спондилоартрит или ревматоидный артрит, часто требующими длительной противовоспалительной терапии.
Увеличение продолжительности жизни пациентов, появление новых интервенционных и хирургических методов лечения сердечно-сосудистых заболеваний (стентирование, аортокоронарное шунтирование, радиочастотная аблация, протезирование клапанов и т.д.) привело к повышению числа лиц, которым показан длительный прием антиагрегантов (ацетилсалициловая кислота) или антикоагулянтов (клопидогрел, прасугрел, тикагрелол, варфарин, ривароксабан, апиксабан, эндоксабан, дабигатран), а нередко их комбинации — двойной и тройной антитромботической терапии. Одним из главных и самых грозных побочных эффектов этих препаратов является риск возникновения гастроинтестинальных кровотечений [24]. При этом механизм поражения слизистых оболочек пищеварительного тракта на фоне приема ацетилсалициловой кислоты более понятен и сопоставим с таковым при терапии НПВП, тогда как механизм повреждающего действия антикоагулянтов в настоящее время не изучен.
Химиотерапевтические средства
Частота развития поражений кишечника на фоне проведения химиотерапии достигает 50–80% при некоторых режимах [2, 3]. Тонкая кишка более уязвима к повреждающему действию химиотерапевтических агентов, поскольку именно в ее слизистой сосредоточено наибольшее количество быстропролиферирующих клеток. Как правило, поражение кишечника, связанное с приемом химиотерапевтических средств, клинически проявляется диареей и признаками синдрома мальабсорбции.
Учитывая иммунносупрессивный механизм действия химиотерапевтических средств, нередко на фоне их применения развивается диффузный или сегментарный колит, требующий назначения глюкокортикостероидов [3, 25].
Для колита данной этиологии характерными эндоскопическими признаками являются отек, эритема, экссудация и эрозии. В некоторых случаях на фоне изъязвления может возникать перфорация толстой кишки. При морфологическом исследовании в собственной пластинке слизистой чаще всего обнаруживаются лимфоцитарные инфильтраты, богатые Т-клетками, эозинофилами и плазматическими клетками, а также нейтрофильные инфильтраты с криптитом и формированием крипт-абсцессов [25].
Риск развития и тяжесть поражения кишечника при проведении химиотерапии зависят от молекулы препарата, его дозы и схемы назначения. Наиболее часто развитие лекарственно-индуцированного поражения кишечника отмечается на фоне применения 5-фторурацила и иринотекана, широко используемых для лечения колоректального рака, а также ипилимумаба – в химиотерапии меланомы [2, 25].
Антибиотики
Известно, что антибиотики оказывают огромное влияние на качественный и количественный состав микробиоты кишечника независимо от частоты и длительности приема [26]. Многочисленные исследования подтвердили, что терапия антибактериальными препаратами у10–20% пациентов сопровождается развитием диареи вследствие снижения количества сахаролитических бактерий на фоне размножения условно-патогенных и патогенных штаммов, в т.ч. устойчивых к антибиотикам [26, 27]. Так, антимикробные агенты могут способствовать пролиферации Clostridium difficile, токсины которой оказывают прямое повреждающее воздействие на эпителиальные клетки кишечника вплоть до развития фульминантного колита и токсической дилатации толстой кишки. Как правило, инфекция Clostridium difficile возникает у пожилых пациентов, находящихся на стационарном лечении и принимающих помимо антибиотиков ингибиторы протонной помпы, иммуносупрессивные средства.
Наиболее часто развитие инфекции Clostridium difficile ассоциировано с приемом цефалоспоринов, фторхинолонов, нитрофуранов. Клинически заподозрить развитие инфекции Clostridium difficile можно по появлению абдоминальной боли и диареи, сопровождающихся выраженными симптомами интоксикации и лейкоцитозом, на фоне антибактериальной терапии или после ее завершения [28]. Диагностика колита, ассоциированного с Clostridium difficile, основывается на характерных эндоскопических и морфологических признаках (эрозивно-геморрагическое поражение, чаще локализующееся в прямой или сигмовидной кишке, формирование фибринозных пленок — псевдомембран) и выявлении токсинов Clostridium difficile А и В в кале [28, 29].
Необходимо еще раз подчеркнуть, что некоторые антибиотики, например макролиды, а также клавулановая кислота в составе бета-лактамных антибиотиков обладают способностью стимулировать мотилиновые рецепторы кишечника и приводить к диарее, не вызывая при этом поражения слизистой оболочки [2, 3].
Ингибиторы протонной помпы (ИПП)
Препараты данной группы представляют собой производные бензимидазола, оказывающие мощное ингибирующее действие на секрецию соляной кислоты париетальными клетками желудка посредством блокады фермента H+/K+-АТФазы [29].
Важно отметить, что ИПП, широко используемые для лечения и профилактики НПВП-гастропатии, напротив, повышают риск поражения нижележащих отделов пищеварительного тракта. Изменение кислотности желудочного сока при длительном приеме ИПП способствует чрезмерной бактериальной колонизации тонкой кишки с последующим развитием синдрома избыточного бактериального роста, а также нарушению состава микробиоты толстой кишки [30]. В эксперименте кислотосупрессупрессивная терапия ИПП ассоциировалась со снижением представительства актинобактерий в толстой кишке и увеличением частоты НПВП-энтеропатии [31].
Кроме того, длительное применение ИПП может приводить к изменению состава анаэробов толстой кишки и возникновению инфекции Clostridium difficile, которая ассоциируется с высокой смертностью [28]. По данным мета-анализа с включением более 300 тыс. пациентов показано увеличение относительного риска инфекции Clostridium difficile при длительном назначении ИПП в 2,79 раза, а при сочетании ИПП с антибиотиками — до 5 раз [32].
Блокаторы рецепторов ангиотензина II
В 2012 г. впервые появились данные о том, что антигипертензивный препарат олмесартан, относящийся к группе блокаторов рецепторов ангиотензина II, способен вызывать поражения кишечника, сходные с таковыми при целиакии [33]. Энтеропатия, связанная с приемом олмесартана, клинически проявляется диареей, прогрессирующим снижением массы тела, нормохромной анемией и гипоальбуминемией. Морфологическим признаком поражения кишечника данной этиологии является атрофия ворсинок тонкой кишки.
В качестве возможного механизма данного эффекта рассматривается клеточно-опосредованный иммунный ответ: олмесартан повышает уровень ангиотензина II, который способствует повышению экспрессии трансформирующего фактора роста (TGF-β), ответственного за активацию иммунной системы и повреждение слизистой оболочки кишки [34].
Диагностика и лечение поражений кишечника, связанных с приемом лекарственных средств
Клинические проявления лекарственно-индуцированного поражения кишечника нередко могут имитировать другие заболевания пищеварительного тракта – целиакию, непереносимость углеводов, функциональные гастроинтестинальные расстройства, хронический панкреатит, воспалительные заболевания кишечника, злокачественные новообразования. Учитывая это, поражения кишечника, связанные с приемом лекарственных средств, по сути являются диагнозом исключения, что требует назначения массы обследований.
Тактика ведения пациентов с лекарственно-индуцированным поражением кишечника в настоящее время не определена. При наличии выраженных клинических проявлений рекомендуются щадящая диета с ограничением или полным исключением пищевых волокон, регидратация, назначение спазмолитиков, месалазина, кишечных антисептиков, пробиотиков [2, 3]. Если это возможно, то необходимо прекратить прием препарата с потенциально повреждающим действием и назначить альтернативную молекулу. В том случае, когда отмена препарата невозможна, следует попробовать снизить дозу.
Заключение
Поражение кишечника, ассоциированное с приемом лекарственных средств, представляет собой спектр различных морфологических и функциональных изменений в результате применения тех или иных фармакологически активных соединений. Чаще всего повреждение кишечника вызывают НПВП, антибиотики, химиотерапевтические средства, ИПП, блокаторы рецепторов к ангиотензину II.
Риск развития лекарственно-индуцированного поражения кишечника и степень его повреждения определяются рядом факторов: возрастом пациента, сопутствующими заболеваниями, целостностью кишечного барьера, составом кишечной микробиоты, дозой лекарства, временем воздействия, межлекарственным взаимодействием. Отсутствие специфических симптомов и маркеров затрудняет диагностику заболевания. Постановка диагноза должна прежде всего основываться на тщательном сборе лекарственного анамнеза и исключении альтернативных причин. Ключевым диагностическим признаком лекарственно-индуцированного поражения кишечника является хронологическая связь симптомов с началом приема препарата и его отменой.
К сожалению, в настоящее время медикаментозные средства для лечения лекарственно-индуцированных поражений кишечника с доказанной эффективностью отсутствуют, также не определена тактика ведения данной когорты больных. В связи с этим особенно актуальным представляется тщательная оценка рисков развития поражений кишечника и их профилактика до начала терапии.
Источник финансирования
Статья подготовлена в рамках выполнения работ по государственному заданию Минздрава России № 056-00096-20-00.


