Введение
Скелетно-мышечная боль – широко распространенное состояние, возникающее у 80% общей популяции, причем 10–20% случаев относятся к хроническим [1–3]. К двум наиболее распространенным формам скелетно-мышечной боли, с которыми сталкиваются неврологи в повседневной практике, относятся фибромиалгия (ФМ) и миофасциальный болевой синдром (МБС).
ФМ – это синдром, характеризующийся хронической мышечно-скелетной болью и наличием пальпируемых болезненных точек (ПБТ) [4–5]. ПБТ – ограниченные области мягкой ткани, болезненные при нажатии с небольшим усилием (менее 4 кг), в остальном никак не отличимые от окружающей здоровой ткани. ФМ обычно развивается в среднем возрасте, но в целом может наблюдаться в любой возрастной категории [5]. Общая распространенность ФМ в клинической популяции варьируется в широких пределах, составляя от 9 до 85% [6, 7] и обычно выше в США (1,1–6,4%) и Европе (1,4–3,7%), несколько ниже в Азии (0,6–3,6%), что, вероятно, отражает культурные различия в восприятии боли и соответствующих жалобах [8]. Распространенность ФМ традиционно выше у женщин (1,0–12,5%), чем у мужчин (0,1–5,1%; соотношение 3:1) [8], что, вероятно, связано с более высокой распространенностью коморбидных психиатрических расстройств у женщин. Кроме того, женщины при одинаковой выраженности симптомов с мужчинами склонны тяжелее переносить болевой синдром [9]. Наиболее широко принятые и применяемые критерии для диагностики ФМ были разработаны и пересмотрены Американским колледжем ревматологии (ACR) [10–11]. Критерии ACR значительно различаются в зависимости от версии. Самое значимое расхождение между критериями 1990 г., где наибольшее внимание уделяется результатам физикального осмотра, и критериями 2010 и 2011 гг., которые делают больший упор на имеющиеся симптомы.
МБС в отличие от ФМ обычно проявляется регионарным мышечным болевым синдром, связанным как с нарушениями двигательной, так и чувствительной функций [12–14]. Определяющая характеристика МБС – это физическое появление миофасциальных триггерных точек (МТТ), представляющих собой чувствительные при пальпации узелки, обнаруживаемые в волокнах скелетной мышцы [13]. Руководство по диагностике триггерных точек, написанное авторами D.G. Simons и J.G. Travell, – это самый часто используемый набор критериев для диагностики МБС [15]. Согласно этому руководству, диагностические критерии преимущественно основаны на физикальном осмотре и выявлении МТТ.
Значительное сходство между МБС и ФМ представляет серьезную диагностическую сложность и часто приводит к неверному становлению диагноза МБС в случае ФМ [16–17]. Неверная диагностика любого из этих состояний приводит к ряду отрицательных последствий, включая назначение ненужных анализов и обследований у разных специалистов, отсутствие уменьшения выраженности симптомов, удлинение времени до постановки диагноза, ненужную фрустрацию пациента и повышение нагрузки на систему здравоохранения. Ранее проведенные исследования показали, что затруднения в дифференциальной диагностике двух указанных состояний объясняются схожестью клинических проявлений МБС и ФМ [18], отсутствием надежных дифференциально-диагностических лабораторных исследований [19–20], потенциальной коморбидностью ФМ и МБС [21] и вариабельностью клинических проявлений МБС по сравнению с ФМ [22].
Патофизиология МБС и ФМ: общее и различное
Этиология и патофизиология МБС до сих пор мало изучены. Наиболее широко распространенное среди врачей-клиницистов представление об МБС характеризуется наличием регионарной мышечной боли и пальпируемых гиперчувствительных областей, называемых МТТ. В соответствии с обобщенной гипотезой [15] МТТ формируются в области концевой пластинки мышцы [6, 15]; патологический процесс предположительно запускается после локальной травматизаци или повторных микротравм [6, 18]. Местное повреждение приводит к избыточному высвобождению ацетилхолина, что в результате приводит к повышению активности концевой пластинки, проявляющемуся образованием пальпируемой гипервозбудимой области на периферической мышце [6, 15, 23, 24]. Стойкое сокращение приводит к каскаду биохимических реакций, включая высвобождение вазоактивных компонентов и провоспалительных факторов [15, 18, 23, 24], включая брадикинин, который способствует возникновению локальной мышечной боли. Одновременно с этим стойкий ноцицептивный стимул с периферии приводит к высвобождению субстанции Р в заднем роге спинного мозга и последующим нейропластическим изменениям (повышенной возбудимости) центральной нервной системы, известной как центральная сенситизация [23, 25]. В соответствии с альтернативной гипотезой важную роль в патофизиологии формирования МТТ и МБС играют нейрогенные механизмы, включая экспрессию сенситизированных спинальных проводящих путей [26] и сенситизированных мотонейронов в результате центральной сенситизации [27]. Недавно проведенное исследование указывает на возможность инициации и облегчения формирования локализованных гипервозбудимых МТТ в отсутствие повреждения периферических мышц в результате нейрогенного воспаления, возникающего как следствие центральной сенситизации [28].
Патофизиология ФМ также слабо изучена. В отличие от регионарно возникающей боли и пальпируемых болезненных узелков при МБС, по согласованному мнению врачей-клиницистов, диагноз ФМ устанавливается при наличии обширной зоны болезненности с симметричным распределением ПБТ в мышце [18] в течение более 3 месяцев [10, 11, 29]. Хотя этиология ФМ изучена слабо [18, 17, 29], предполагается, что в основе формирования клинических проявлений заболевания лежит нарушение центральной обработки сигнала [18]. Данная концепция подтверждается частым выявлением генерализованной болезненности мышц [18] и симметричным распределением ПБТ у пациентов с ФМ [10, 18, 30, 31]. В соответствии с этой теорией ПБТ располагаются в областях вторичной гиперальгезии [32, 33], т.к. в пробах спинномозговой жидкости обнаруживается повышенный уроень синаптических модуляторов, включая субстанцию Р [34, 35]. Потенциальным ключевым фактором дифференциальной диагностики ФМ и МБС может стать тот факт, что в ПБТ обычно не обнаруживается экспрессии провоспалительных факторов [18], в то время как при МБС в области МТТ обнаруживается изменение биохимического окружения [23].
Клинические проявления МБС и ФМ
МБС и ФМ различаются по характеру анатомического расположения и клиническим характеристикам болевого синдрома (см. таблицу).
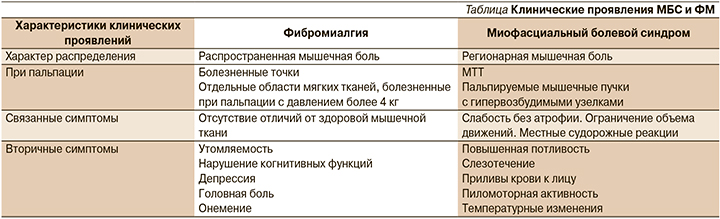
МБС обычно проявляется регионарными мышечными болями [35], связанными с нарушением как двигательной, так и чувствительной функций. Клинически МБС проявляется наличием пальпируемых напряженных пучков мышечных волокон с гипервозбудимыми узелками, называемыми МТТ [6, 35, 36]. В мышцах с МТТ также отмечается нарушение функции – мышцы становятся слабыми в отсутствие явлений атрофии или изменения объема движений [13]. При выявлении МТТ также часто отмечаются местные судорожные реакции – быстрые кратковременные подергивания отдельных напряженных пучков мышечных волокон в ответ на физические стимулы или внутримышечное введение иглы [15, 35]. Некоторые исследователи считают местные судорожные реакции подтверждением наличия МТТ [15], в то время как другие рассматривают этот критерий как ненадежный [37]. Напротив, ФМ характеризуется распространенными скелетно-мышечными болями и наличием ПБТ [29–31, 35, 36]. В отличие от МТТ при пальпации они не определяются как узелковые структуры в мышечной ткани. ПБТ не отличимы на ощупь от окружающей мышечной ткани, за исключением наличия локального повышения болевой чувствительности. Таким образом, важным клиническим отличием МБС от ФМ является обнаружение при пальпации МТТ в отличие от ПБТ при ФМ. Другое клиническое различие ФМ и МБС заключается в наличии сопутствующих проявлений при ФМ, включая нарушения сна, синдром раздраженного кишечника, синдром нейрогенного мочевого пузыря, утомляемость, когнитивные нарушения, тревогу, депрессию, головные боли, заболевания височно-нижнечелюстного сустава, онемение, ощущение покалывания и синдром Рейно [31–32, 38]. Эти состояния вносят значительный вклад в снижение качества жизни пациентов с ФМ [29–32] по сравнению с МБС. У пациентов с МБС хотя и редко, но также возникают сопутствующие вегетативные нарушения, включая избыточное потоотделение, слезотечение, приливы крови к лицу, дермографию, активацию пиломоторных рефлексов и изменения температуры кожи [6], что вносит дополнительные затруднения в дифференциальную диагностику ФМ и МБС.
Диагностика ФМ и МБС
Современные диагностические критерии ФМ. В 1990 г. ACR разработал широко применявшиеся в клинической практики критерии классификации [10]. В соответствии с этими критериями для диагностики ФМ требовалось наличие хронической распространенной боли на обеих сторонах тела как выше, так и ниже талии, с вовлечением верхней и/или нижней части позвоночника, а также наличия более 11 из 18 определенных областей, болезненных при пальпации. Более современные критерии ACR (2010) подразумевают, что ФМ характеризуется наличием хронической распространенной боли в сочетании с утомляемостью, нарушениями сна и когнитивных функций, а также широким спектром соматических симптомов [30]. Критерии подразумевают использование шкалы распространенной боли и шкалы для оценки степени тяжести утомляемости, нарушений сна, когнитивных нарушений и 41 возможного соматического симптома. В модифицированной версии 2010 г. устранена оценка степени выраженности соматических симптомов врачом и заменена на общий балл трех симптомов, что облегчает применение критериев при сохранении необходимой чувствительности [11].
Современные диагностические критерии МБС. В знаковой публикации J.G. Travell и D.G. Simons «Руководство по триггерным точкам» [15] был предложен набор диагностических критериев МБС, включивших ключевые симптомы и такие признаки, как наличие болезненных точек в пальпируемом мышечном волокне, локальных судорожных реакций, отраженной боли, мышечной слабости без атрофии, вегетативных симптомов и ограничения объемов движения. Основой диагностики является наличие МТТ – пальпируемых гипервозбудимых узелков в мышце. Несмотря на эти четко определенные симптомы и признаки, до сих пор не существует повсеместно принятого протокола диагностики МБС, а надежность предложенных диагностических критериев МБС преимущественно основана на клинической оценке [39, 40]. В настоящее время результаты физикального осмотра не являются достаточно надежным методом диагностики МТТ при МБС. Результаты современных исследований в сфере диагностики МБС ограничены и крайне вариабельны [36, 37, 40–42]; исследования характеризуются значительными ограничениями по дизайну, препятствующими получению однозначного заключения о надежности результатов физикального осмотра. Два основных рекомендуемых для использования критерия – местная болезненность и воспроизводимость болевой реакции, в то время как наличие напряженных мышечных волокон и местных судорожных реакций характеризуется низкой диагностической надежностью [40, 41]. По этой причине исследования в сфере диагностики и лечения МТТ ограничены [39], а физикальное обследование не должно использоваться как самостоятельный диагностический метод в случае хронической скелетно-мышечной боли.
Сложности дифференциальной диагностики МБС и ФМ. Несмотря на наличие и клиническое применение определенного спектра диагностических критериев ФМ и МБС, валидизированные дифференциально-диагностические критерии, которые могли бы применяться в качестве «золотого» стандарта, не разработаны [7, 39, 43]. По этой причине возникают определенные сложности в дифференциальной диагностике ФМ и МБС. Клинические различия этих двух состояний в настоящее время выявляются при тщательном сборе анамнеза или физикальном осмотре. При физикальном осмотре клиницисты стараются выявить отдельные гипервозбудимые области в мышечном волокне, ключевую особенность, отличающую МТТ от ПБТ. Хотя отличия МТТ от ПБТ служат ключевым дифференциально-диагностическим ориентиром в соответствии с критериями ACR 1990 г. [10], клинически отличить эти два типа точек бывает сложно [39]. Ключевая отличительная особенность – наличие напряженного мышечного волокна с МТТ, а не ПБТ; однако ранее проведенные исследования продемонстрировали, что напряженные мышечные волокна не рассматриваются в качестве ключевого критерия диагностики МБС [7], кроме того, их выявление при пальпации характеризуется широкой вариабельностью у разных исследователей [7, 36, 39–41]. Дополнительным затруднением в дифференциальной диагностике ФМ и МБС становится тот факт, что локализованная болезненная точка и связанная боль не считаются особенными только для данного состояния и могут быть проявлением широкого спектра клинических состояний, связанных с хронической скелетно-мышечной болью. Кроме того, МБС, обычно рассматриваемый как локализованный болевой синдром, может становиться распространенным, а также сохраняться более 3 месяцев, что более характерно для ФМ [29]. Хотя некоторые группы исследователей и клиницистов полагают, что ФМ и МБС – это два совершенно разных состояния [7, 44], существует мнение, будто ФМ и МБС могут возникать одновременно [7, 45]. Предположение о возможном одновременном существовании МБС и ФМ приводит к дальнейшим затруднениям дифференциальной диагностики [44, 46].
Сочетание описанных факторов ограничивает надежность использования только физикального осмотра для дифференциальной диагностики МБС и ФМ. Современные критерии ACR для диагностики ФМ (2010) [11] направлены на устранение необходимости в использовании данных физикального осмотра для дифференциальной диагностики. Кроме того, существует необходимость выявления и разработки новых объективных диагностических критериев, которые могли бы быть использованы для дифференциальной диагностики видов хронической скелетно-мышечной боли.
Заключение
Скелетно-мышечная система является самым крупным по массе органом человеческого организма и состоит более чем из 400 скелетных мышц. Проблемы, связанные с болевым синдромом или утомляемостью этой системы, слжат частой причиной обращения за медицинской помощью. За последние десятилетия изучение этих патологий прибрело новые направления: сенситизация центральной нервной системы на уровне спинного и головного мозга как механизм хронификации нарушений локального тонуса при МТТ и боли при фибромилагии, неадаптивная перестройка механизмов подавления боли как существенный фактор ее поддержания благодаря нейропластичности нервной системы, нейрогенное воспаление как возможная реакция ирритации корешков с выделением брадикинина, CGRP и поддержания МТТ. Также существенным можно считать фактор наличия у многих пациентов с ФМ тревожно-депрессивных расстройств и изучение патологии явления МТТ как периферической реакции на нейромедиаторные изменения головного мозга. Однако в настоящее время дифференциальная диагностика этих состояний основывается на неточных и субъективных критериях, что требует поиска новых диагностических методов и разработки более современных и надежных клинических алгоритмов дифференциальной диагностики.



