Введение
Ревматоидный артрит (РА) – иммуновоспалительное (аутоиммунное) ревматическое заболевание, характеризующееся тяжелым прогрессирующим поражением суставов и широким спектром внесуставных проявлений, развитие которого определяется сложным взаимодействием факторов внешней среды и генетической предрасположенности, ведущих к глобальным нарушениям в системе гуморального и клеточного иммунитета [1, 2].
К числу внесуставных-системных проявлений РА относится кожный ревматоидный васкулит (РВ, язвенно-некротический васкулит, инфаркты ногтевого ложа, дигитальный артериит, ливедо-ангиит).
Одной из причин развития РВ может считаться отложение иммунных комплексов в стенках сосудов. Данная концепция основывается на обнаружении у большинства больных РА с РВ высоких титров ревматоидного фактора, циркулирующих иммунных комплексов (ЦИК), а также криоглобулинов. Кроме того, иммунофлуоресцентные методы исследования позволили выявить отложение иммуноглобулина М (IgM), IgG и компонентов комплемента в пораженных сосудистых стенках [3, 4].
Классификация РВ
Существует классификация РВ, основанная на клинико-гистологических данных:
- Тип 1 – дигитальный артериит с пролиферацией интимы сосудов и формированием тромбов. У пациентов с этим типом РВ наблюдается поражение ногтевых фаланг.
- Тип 2 – воспаление венул, мелких артерий, артериол и капилляров кожи с фибриноидным некрозом и инфильтрацией их стенки мононуклеарными клетками, лейкоцитоклазией и экстравазацией эритроцитов. При этом клинические проявления включают кожные язвы и пальпируемую пурпуру.
- Тип 3 – некротизирующий артериит с вовлечением артерий мелкого и среднего калибра, приводящий к поражению висцеральных органов и периферических нервов, часто неотличимый от классического узелкового полиартериита.
РВ влияет на прогноз заболевания. До внедрения в клиническую практику ранней терапии базисными противовоспалительными препаратами 5-летняя выживаемость больных РВ варьировалась в пределах 28–40% [3, 4]. В подавляющем большинстве случаев РВ не является самостоятельным заболеванием и, соответственно, специальной терапии не требует. РВ считается экстраартикулярным проявлением РА и позиционируется как неблагоприятный прогностический фактор. Специальное лечение кожного васкулита требуется только при наличии трофических язв. Наряду с базисной противовоспалительной терапией немаловажное значение играет наружное местное лечение.
Принципы местного лечения трофических язв
Основные принципы местного лечения:
- купирование воспалительного процесса;
- очищение язвы от гнойно-некротических тканей;
- стимулирование процессов регенерации.
Одним из главных критериев эффективности местной терапии является рубцевание или тщательная санация язвенного дефекта. Для достижения этой цели в клинической практике используют разнообразные влажно-высыхающие повязки с лекарственными средствами и различные раневые покрытия. В результате проведенных многочисленных исследований доказана их высокая эффективность при лечении язв, в частности венозных.
Недавно сформулирована концепция обработки основания раны с целью перевода хронической формы раны в острую с последующим удалением как некротической ткани, так и фенотипически измененных клеток края и основания раны. Основу данной концепции составили результаты исследования клеточного состава краев хронических ран. Так, было обнаружено фенотипическое изменение клеток, выражающееся в резистентности клеток к действию цитокинов, факторов роста, снижение митотической активности. Экссудат, продуцируемый фенотипически измененными клетками, подавляет пролиферацию и функциональную активность кератиноцитов и фибробластов, кроме того, протеазы, содержащиеся в нем, разрушают экстрацеллюлярный матрикс. Фибробласты, выделенные из хронических ран, отличаются низкой пролиферативной активностью, при этом у них отсутствует чувствительность к действию цитокинов, включая факторы роста. Нарушено образование экстрацеллюлярного матрикса. Следует отметить, что именно обработка дна раны способствует переводу хронической раны в состояние острой и ведет к активации эндогенных процессов регенерации тканей [5, 6].
Тактика агрессивной обработки хронических ран диктуется рядом причин:
- наличие некротических тканей, фибринной пленки является потенциальным субстратом развития инфекционных осложнений;
- клеточный состав, выделенный из краев хронической раны, претерпевает фенотипические изменения, ведущие к нарушению процессов регенерации.
Использование любых перевязочных материалов – от самых простых, до ультрасовременных – не даст положительных результатов без предварительной подготовки раны. Существует несколько вариантов обработки раны: хирургический метод, аутолитическая и химическая очистка раны.
Удаление некротических тканей и экссудата занимает одно из ключевых мест в реализации препарирования раневого ложа. Для этого широко используют разнообразные протеолитические ферменты. Одним из первых начали применять растительный фермент папаин, затем препараты, созданные из продуктов жизнедеятельности стрептококка (рибонуклеаза, гиалуронидаза, нуклеотндаза и нуклеозидаза, ультрализин).
Еще недавно были весьма популярными выкристаллизованные трипсин и химотрипсин. Несмотря на оптимистические прогнозы, кристаллическая форма протеолитических ферментов не нашла широкого клинического применения: они активны лишь во влажной среде при фиксированном значении pH=6 [7], расщепляют только компоненты раневого экссудата, не оказывая никакого действия на коллаген, а также повреждают компоненты регенерирующего соединительно-тканного матрикса [6]. Коллагеназа – водорастворимый фермент, избирательно расщепляет лишенный мукополисахаридного футляра «поврежденный» коллаген на границе живых и девитализированных тканей, которые быстро и атравматично отделяются от раневого ложа. Коллагеназа не только не повреждает компоненты соединительнотканного матрикса, но и увеличивает пролиферацию кератиноцитов [6].
Существенное влияние на нормальное течение репаративных процессов на территории язвы оказывают местные физико-химические условия.
С одной стороны, избыточная влажность служит причиной гибели клеток эпителия. С другой, недостаток влаги приводит к высыханию и замедлению процесса эпителизации. Доказано, что влажная среда необходима для самоочищения раны, пролиферации и миграции эпителиоцитов. При достаточном количестве жидкости в экстрацеллюлярном матриксе образуется более рыхлая фиброзная ткань с формированием в последующем менее грубого, но более прочного рубца.
Выбор того или иного перевязочного средства требует обязательного учета фазы течения раневого процесса и степени экссудации. Так, повязки, применение которых рационально в фазу воспаления благодаря структуре своего материала способны инактивировать раневой экссудат способствуют необратимой элиминации микроорганизмов, токсинов и тканевого детрита, стимулируя при этом процесс отторжения некротизированных тканей. В свою очередь покрытия, используемые при лечении «чистых» заживающих язв, поддерживают необходимую влажность и аэрацию, надежно защищают от механических повреждений и вторичной контаминации, стимулируют репаративные процессы.
В настоящее время в международной практике доминирует концепция заживления трофических язв во влажной среде. Для этого применяют разнообразные раневые покрытия, обеспечивающие:
- аутолитическую очистку язвы и поглощение раневого экссудата;
- влажную среду для миграции клеток, пролиферации, дифференциации и образования новых сосудов;
- термозащиту и температурную стабильность язвенной поверхности;
- защиту от внешней суперинфекции;
- безболезненное и атравматичное удаление повязки;
- гипоаллергенность;
- простоту в использовании, экономичность по стоимости и затратам времени.
Таким требованиям удовлетворяют т.н. интерактивные повязки. Их действие на рану происходит без участия традиционно известных химических и биологических компонентов группы антисептиков и стимуляторов заживления, а реализуется за счет механических и физических свойств самой повязки. Эти повязки обладают комплексным патогенетически направленным действием, способны в течение продолжительного срока создавать и поддерживать в патологическом очаге оптимальную для заживления среду.
Они обеспечивают одновременное очищение, поддержание необходимой влажности и нормализацию репаративно-регенераторных процессов в ране.
Раневые покрытия в зависимости от их состава, физико-химических свойств и особенностей клинического применения разделены на определенные виды (см. таблицу).
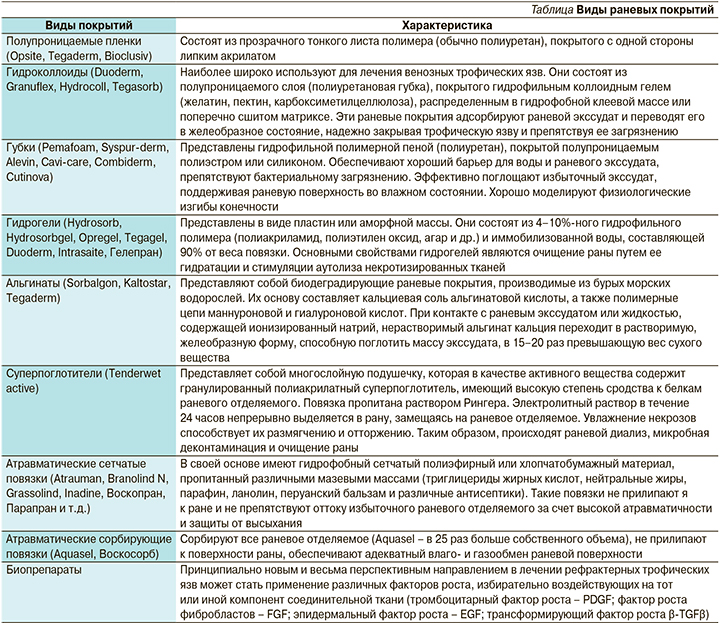
Однако применение факторов роста, а также культивированных клеток в повседневной практике ограничивает их высокая стоимость, отсутствие четкой методологии применения, а также эффективных средств доставки в толщу трофической язвы. Экономически более оправданно применение ксеногенной твердой мозговой оболочки животных, а также обогащенной тромбоцитами плазмы [7].
Заключение
Таким образом, достижение высокой эффективности лечения кожного васкулита у больных РА возможно за счет комбинации адекватной терапии базисными противовоспалительными препаратами и локальными наружными средствами [8–10].


