Введение
По данным ВОЗ, болевые синдромы – одна из ведущих причин (от 11,3 до 40%) обращений к врачу в системе первичной медицинской помощи [1]. В структуре неврологического приема пациенты с хроническими болевыми синдромами составляют до 52,5% [2]. При этом наиболее часто возникает она среди женщин 45–65 лет.
Распространенность хронической боли (ХБ) в популяции составляет от 2 до 40–49% [3]. По результатам изучения эпидемиологии болевых синдромов у взрослого населения России их частота варьируется от 13,8 (боль в животе) до 56,7% (боль в спине и шее), в среднем составляя 34,3 на 100 опрошенных [4]. Наиболее распространенная форма ХБ – это ХБ в спине (ХБС), так же широко распространены головная боль, боль в шее и суставах.
Боль в спине представляет собой большую проблему для здравоохранения, и механизмы, лежащие в ее основе, до сих пор остаются не до конца изученными. ХБС – наиболее частая причина временной нетрудоспособности и ограничения активности среди людей трудоспособного возраста [5]. Пик заболеваемости болями в спине приходится на возраст до 40 лет [6].
В России боли в пояснице составляют от 20 до 80% случаев временной нетрудоспособности в активной социальной группе и 20,4% в общей структуре инвалидности при дегенеративных заболеваниях костно-суставной системы [7].
ХБ часто сочетается с другими соматическими синдромами, такими как слабость, некачественный сон, нарушения в эмоциональной сфере, а также когнитивными изменениями. Когнитивные и эмоциональные факторы оказывают большое влияние на восприятие боли [8]. Известно, что негативное эмоциональное состояние усиливает болевую импульсацию и, наоборот, положительные эмоции уменьшают болевое восприятие [9].
Пациенты с ХБ часто предъявляют жалобы на снижение когнитивных функций, негативно сказывающееся на их социальной жизни и повседневной активности [10–12]. Наиболее частые жалобы пациентов с ХБ различной этиологии звучат следующим образом: я не могу мыслить ясно, у меня проблемы с концентрацией внимания, моя память очень плохая. «Фиброфог», термин, которым в литературе описывается состояние пациентов с фибромиалгией, характерен и для других пациентов с ХБ.
Чаще всего звучат жалобы на снижение памяти и проблемы с концентрацией внимания, трудности с планированием и организацией. По данным исследования, проведенного M. Muñoz et al., показано, что у пациентов, страдающих ХБ, наиболее часты жалобы на расстройство памяти при просмотре фильмов и чтении книг (61%), на забывчивость (44%), на проблемы с выполнением повседневных заданий (38%) и нарушения концентрации внимания (38%). Показана связь этих жалоб с имеющейся депрессией. Такие эмоциональные нарушения, как депрессия, тревожность и неспособность переключить внимание от боли, играют важную роль в структуре нарушения памяти у пациентов с ХБ [13].
В своей работе A.V. Apkarian предполагает, что хроническая боль может быть ассоциированной со специфическим и до конца не ясным когнитивным дефицитом, влияющим на повседневное поведение [14].
При объективной оценке когнитивных нарушений (КН) у пациентов с ХБ были выявлены умеренные нарушения памяти, внимания и исполнительной функции [15]. N. Landrø et al. [16] сообщают о наличии нейропсихологических нарушений среди 20% пациентов с ХБ, способных влиять на выполнение ежедневных обязанностей, требующих повышенного внимания.
В своей работе К.А. Мелкумова показала, что у пациентов с ХБС имели место нарушения когнитивных функций в сфере внимания, памяти, а также регуляторных функций (гибкости мышления, скорости обработки информации). Было выявлено, что с увеличением возраста и при увеличении длительности болевого синдрома отмечается ухудшение результатов выполнения тестов на оценку памяти (тест 12 слов), регуляторных функций и внимания (тест последовательного соединения цифр и букв и тест символьно-цифрового кодирования). Было также продемонстрировано отрицательное воздействие депрессии и тревоги на выраженность когнитивных нарушений при ХБС [17].
Таким образом, ХБ, в т.ч. ХБС, может стать причиной КН, тем самым значительно снизив качество жизни пациента. Однако не до конца понятно, каким именно образом ХБС влияет на когнитивные возможности и замедленность реакций [18].
Цель исследования: изучение распространенности и клинической структуры объективных КН у пациентов с ХБС, а также факторов, имеющих значение для их развития.
Методы
Проведено простое поперечное исследование 31 пациента с ХБС в возрасте от 18 до 59 лет (22 женщины и 9 мужчин). Диагноз устанавливался в соответствии с МКБ-10. Все пациенты обследовались в период наименее выраженного болевого синдрома, т.е. вне стадии обострения, для уменьшения влияния болевого синдрома на результаты когнитивных тестов. Из исследования были исключены пациенты с тяжелой депрессией и другими психическими заболеваниями, пациенты, принимавшие антидепрессанты, т.е. с наличием факторов, способных влиять на когнитивные функции.
Всем пациентам проведено клиническое неврологическое исследование и анкетирование с использованием опросника демографических и клинических характеристик, госпитальной шкалы тревоги и депрессии HADS (Hospital Anxiety and Depression Scale). Кроме того, проведено исследование когнитивных функций участников с помощью Монреальской шкалы оценки когнитивных функций (MoCA), теста замены цифр символами (DSST) и теста Рея на слухоречевое заучивание (RAVLT).
DSST позволяет оценивать скорость обработки информации, концентрацию и поддержание внимания, исполнительную функцию и рабочую память [19]. Легенда содержит 9 пар «цифра–символ». Далее следует последовательность цифр, под каждой из которых испытуемый должен вписать соответствующий символ в течение 90 секунд. Оценивается общее количество правильных пар.
RAVLT – тест Рея на слухоречевое заучивание. Нейропсихологический тест широко применяется для оценки вербальной памяти и обучаемости [20]. Оценивают способность пациента кодировать, консолидировать, запоминать, извлекать вербальную информацию. Участникам предъявляют список из 15 не связанных между собой слов. Испытуемый должен повторить те из них, которые удалось запомнить, и сделать пять попыток воспроизвести показанный список. Затем предлагается перечень из других 15 слов, которые пациент должен воспроизвести 1 раз, затем вспомнить слова из первоначального списка. Через 20 минут участник исследования снова воспроизводит первоначальный список. Оцениваются три показателя: общее запоминание (Total Learning, сумма всех запомненных слов в первых 5 попытках), забывание (Delayed Recall, разница между первой и последней попытками через 20 минут) и обучение (Learning Rate, разница между пятой и первой попытками).
Полученные результаты обрабатывали в программе Statistika 10 (Statsoft) с использованием теста Стьюдента для независимых выборок. Данные представлены в виде «среднее±стандартное отклонение». Корреляционные взаимосвязи оценивали при помощи анализа Пирсона. Влияние различных факторов на риск развития КН оценивали с помощью теста множественного регресса. Статистически значимыми считали различия при р<0,05.
Результаты
Средний возраст наших пациентов с ХБС составил 42±10 лет, при этом соотношение женщин и мужчин было 22 к 9. Из их числа 7 пациентов страдали цервикалгией, 24 – люмбалгией (23/77%). Длительность заболевания в группе пациентов с ХБС составила 11±7 лет, среднее число обострений – 0,82 в год (табл. 1).
Средний балл по шкале депрессии HADS составил 6,3, по уровню тревоги – 8,7. Анализ степени выраженности аффективных нарушений по HADS выявил, что у большинства обследованных пациентов с ХБС депрессия отсутствовала (71%); показатели, соответствовавшие субклинической и клинически выраженной депрессии, наблюдались лишь в 19 и 11% случаев соответственно. В данной группе пациентов превалировали тревожные расстройства субклинического (35%) и клинически выраженного характера (30%; табл. 2). 63% пациентов предъявляли жалобы на КН (нарушения памяти и внимания).
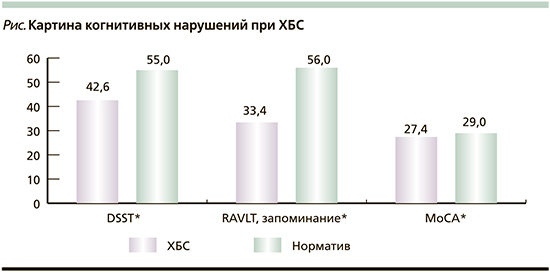
При объективной оценке результатов когнитивных тестов выявлено значительное снижение результатов теста DSST – 42,6±10,2, что существенно ниже нормативов для данной возрастной группы. Показатели обучения и забывания в тесте RAVLT были -0,58 и 1,06 соответственно. Общее запоминание слов в тесте RAVLT составило 38,3±9,3 слова, что также снижено по сравнению с нормативами для данной возрастной группы (56 слов). Показатель по шкале MoCA находился на нижней границе нормальных значений (27,4±2,3 балла) и значимо отличался от среднего показателя для здоровых людей в возрасте 40–50 лет (см. рисунок). При этом в объективных показателях когнитивных функций пациентов, предъявлявших и не предъявлявших жалоб на КН, различий не выявлено.
Для изучения факторов, оказывающих влияние на развитие КН у пациентов с ХБС, проведен тест множественной регрессии. В качестве зависимой переменной использован результат теста DSST как общий показатель рабочей памяти и внимания, в качестве независимых переменных – длительность анамнеза ХБС, возраст, уровень депрессии и тревоги. Получено статистически значимое уравнение регрессии.
Отмечена высокая распространенность субъективных и объективных нарушений когнитивных функций пациентов с ХБС; выявлена отрицательная корреляция результата по тесту DSST с возрастом r=-0,57 (p<0,005), длительностью заболевания r=-0,58 (p<0,005) и уровнем депрессии r=-0,52 (p<0,005), но не было отмечено корреляции уровня тревоги с показателями тестов когнитивных функций.
Обсуждение
Проведенное нами объективное исследование когнитивных функций пациентов с ХБС показало, что средний результат по тесту DSST был существенно ниже опубликованного норматива для данной возрастной группы. Общее запоминание в тесте RAVLT также было значительно снижено по сравнению с популяционными нормативами. Показатель по шкале MoCA находился на нижней границе нормальных значений и достоверно отличался от среднего показателя для здоровых людей в возрасте 40–50 лет.
Интересно, что у пациентов, не предъявлявших жалоб на нарушение памяти и внимания, выявлены аналогичные нарушения когнитивных функций. Это говорит о том, что для выявления КН необходимо проводить активный расспрос пациентов.
В литературе мало исследований о влиянии хронического болевого синдрома на когнитивные функции у пациентов с ХБС. В то же время проведены исследования о влиянии снижения внимания, памяти, исполнительных функций на повседневную активность и качество жизни пациентов с ХБС [10–12, 14], а также показано, что для более старшей возрастной группы они могут способствовать развитию более выраженного когнитивного дефицита [17].
J.L. Etherton et al. выявили лишь некоторое снижение скорости мышления у пациентов с ХБС [21]. Weiner’s-команда продемонстрировала значительные различия в результатах нейропсихологического тестирования пациентов с ХБС по сравнению со здоровыми: были объективно нарушены мгновенная память, отсроченная память, гибкость мышления и язык [22]. Также в группе с ХБС была выше частота жалоб на нарушения и снижение памяти [23]. Средний балл по депрессии и тревоге у обследованных пациентов имел тенденцию к увеличению, но не доходил до уровня, необходимого для диагностики депрессии и тревоги. Это может говорить о следующем: причиной КН у пациентов с ХБС служит не депрессия и тревога, а непосредственно ХБ. В других исследованиях, наоборот, выявлена взаимосвязь интенсивности боли и депрессии/тревоги с рабочей памятью, соответственно, тесная взаимосвязь между болью, депрессией/тревогой и КН [24].
Известно, что при депрессии у пациентов наблюдаются аналогичные вышеописанным изменения в когнитивной сфере: нарушения памяти, внимания, скорости обработки информации. Их наличие считается доказанным, и они высококоморбидны с ХБ [25, 26]. КН, описанные как сниженная способность к сосредоточению и вниманию, служат критерием диагноза депрессивного эпизода в современных классификациях DSM-5 (Diagnostic and Statistical Manual of Mental Disorders 5) и МКБ-10. Таким образом, депрессия сама по себе и сопутствующие ей нарушения сна могут быть причиной когнитивных проблем у пациентов с ХБ.
В нашей работе у пациентов с ХБС выявлена корреляция результатов теста DSST с уровнем депрессии, однако депрессия не была выявлена у большинства (71%) пациентов. Таким образом, мы показали, что депрессия не есть главный фактор развития КН при ХБС, но ее присоединение может приводить к усугублению ситуации. Похожие результаты получены и другими авторами, исследовавшими различные виды ХБ [27–29]. В частности, в работе, посвященной КН при хронической мигрени, показано, что наличие хронической головной боли, а не депрессия служит независимым и негативным прогностическим фактором развития КН [30].
Мы предполагаем, что в основе хронического болевого синдрома у пациентов с ХБС лежит феномен центральной сенситизации. Вследствие постоянной дисфункции ноцицептивных структур и центральной сенситизации происходит формирование дезадаптивной нейропластичности в определенных отделах головного мозга (ГМ), в т.ч. принимающих участие в когнитивных процессах.
За последние годы появилось множество работ, описывающих структурные изменения в определенных отделах ГМ, участвующих в обработке болевого импульса, при наличии ХБ. Выраженность этих изменений коррелирует с длительностью болевого синдрома. К этим структурам относятся поясная извилина, орбитофронтальная кора, инсула и дорзальная часть ствола. Также изменения выявлены в таламусе, дорсолатеральной префронтальной коре (ПФК), базальных ганглиях и гиппокампе. Бόльшая часть этих структур также участвует в процессах когниции. Таким образом, становится понятно, каким именно образом развивается когнитивная дисфункция: ХБ использует когнитивные ресурсы, влияет на нейромедиаторную активность в сложной сети взаимосвязанных отделов ГМ, общих для когниции и ноцицепции. Данные процессы приводят к формированию дезадаптативной нейропластичности в вышеперечисленных структурах, что ведет к появлению устойчивых КН.
Таким образом, развитие КН у пациентов с ХБС может объясняться как механизмами самой ХБ, так и общностью локализации и нейрохимии процессов в отделах ГМ, отвечающих за антиноцицептивные и когнитивные функции. Это ПФК, амигдала, островковая область и передняя поясная извилина. Этим также можно объяснить высокую коморбидность депрессии и КН. Таким образом, общность структур, участвующих в патогенезе ХБ, эмоциональном контроле и когнитивных процессах, в первую очередь объясняет высокую коморбидность этих нарушений.
Используя методы высокотехнологичного морфометрического анализа, A.V. Apkarian et al. (2004) выявили у пациентов с ХБС снижение объема неокортекса на 5–11% по сравнению со здоровыми испытуемыми. За каждый год присутствия ХБC объем серого вещества уменьшается на 1,3 см3. При ХБС выявлена атрофия серого вещества с двух сторон в дорсолатеральной ПФК, в правом таламусе [31]. A. May предполагает, что изменения серого вещества ГМ, отмеченные у пациентов, страдающих ХБС, служат следствием постоянной ноцицептивной импульсации и, таким образом, эти изменения могут быть обратимыми при оптимальном лечении болевых синдромов. Наличие ХБС сопровождается также нарушениями в биохимии ГМ, в частности нарушениями в системе N-ацетил-аспартат – креатинин в ПФК, что приводит к дисфункции и потере нейронов в этом регионе, соответственно –к КН [32].
На фоне терапии ХБ описанная выше патологическая нейропластичность (причина КН и ХБ) может быть обратимой, но только частично и до определенной, пока еще не до конца изученной степени. В нашей работе показана связь КН с длительностью течения ХБС. Предполагаем, что длительная персистенция ХБ приводит к структурным и биохимическим изменениям в отделах ГМ, отвечающих за когницию, которые с течением времени становятся необратимыми. Следствие этих изменений – трудности терапии хронического болевого синдрома и появление устойчивых КН. H. Conradi в своей работе показал, что у 40% пациентов с депрессией в ремиссии КН сохраняются [33], то же может происходить и при ХБ.
Антидепрессанты широко используют в терапии депрессии и ХБ, однако некоторые современные антидепрессанты помимо основного эффекта оказывают и прокогнитивное действие. Прием антидепрессантов приводит к коррекции нейромедиаторных изменений в вышеписанных отделах ГМ, соответственно – к развитию адаптативной нейропластичности. Длительный прием антидепрессантов увеличивает концентрацию моноаминов (норадреналина и серотонина), повышающих экспрессию GluR1-субъединиц AMPA-рецепторов, усиливая их функцию и тем самым запуская процессы защитной нейропластичности в гиппокампе, ПФК и миндалевидном теле. Норадреналин, помимо прочего, регулирует выделение субстанции Р, играющей важную роль в генезе центральной сенситизации: известно, что ее концентрация повышена у пациентов с депрессией [34]. В генезе ХБ важное значение имеет также дофамин (D2-рецепторы). Агонисты дофамина, активируя HT1A-рецепторы, приводят к усилению нейрогенеза в гиппокампе, регулируют синаптогенез и межнейрональные связи в гиппокампе, блокируют эффект стресса [35]. Однако антидепрессанты различаются как по механизму действия, так и по спектру клинического воздействия на пациента.
В своей работе С. Shilyansky et al. показали отсутствие положительной динамики в КН у пациентов, принимавших сертралин, эсциталопрам и венлафаксин МВ [36].
Вортиоксетин – антидепрессант нового поколения. Он обладает множеством механизмов действия, соответственно, оказывает влияние на массу патологических процессов, происходящих в структурах ГМ, задействованных в процессах когниции, ноцицепции и эмоций. В своей работе Baune et al. показали статистически значимое улучшение когнитивных функций на фоне терапии вортиоксетином в отличие от остальных классов антидепрессантов. Вортиоксетин служит антагонистом 5-HT7 и 5-HT3-серотониновых рецепторов и агонистом 5-HT1A-рецепторов, благодаря чему повышается активность лобной коры [37]. В отличие от селективных ингибиторов обратного захвата серотонина (СИОЗС) вортиоксетин повышает концентрацию глутамата. Прокогнитивный эффект, которым вортиоксетина обладает помимо антидепрессивного, реализуется благодаря антагонистическому действию на HT3 серотониновые рецепторы, что в свою очередь приводит к отмене блокирующего влияния ГАМК и увеличению выделения глутамата в ПФК и гиппокампе. Также выделение глутамата повышается за счет блокирующего влияния вортиоксетина на супрессию активности пирамидных нейронов ПФК и гиппокампа под влиянием серотонина. Благодаря этому повышается активность и длительность потенциации, а также нейрональная пластичность, усиливается формирование воспоминаний. При этом концентрация глутамата повышается только в стратегически значимых для когниции областях ГМ [38]. Важной особенностью вортиоксетина, отличающей его от СИОЗС, является антагонистическое воздействие на серотониновые HT3-рецепторы, благодаря чему реализуется антиноцицептивное действие при ХБ. В отличие от СИОЗС вортиоксетин повышает концентрацию ацетилхолина, гистамина, дофамина и норадреналина, тем самым оказывая прокогнитивное воздействие и усиливая антиноцицептивное. В отличие от флуоксетина вортиоксетин активирует экспрессию генов, обеспечивающих нейропластичность [39].
Важно своевременно начать лечение ХБС антидепрессантами, т.к. длительное существование ХБ приводит к развитию патологического процесса в стратегически важных областях ГМ, которые со временем становятся необратимыми. Таким образом, учитывая тесную взаимосвязь в ГМ механизмов реализации когниции, ноцицептии и эмоций, вортиоксетин занимает особое место. Прием препарата оказывает андидепрессивное действие, антиноцицептивный и доказанный прокогнитивный эффект при существенно лучшей переносимости по сравнению с другими антидепрессантами.
Заключение
У пациентов с ХБС выявлены существенные КН. Вероятность их повышается при длительном течении ХБС и присоединении коморбидной депрессии, усугубляющей имеющиеся КН. Длительный анамнез существования ХБС – независимый прогностический фактор развития КН. Основным патогенетическим механизмом КН при ХБС является центральная сенситизация, которая приводит к формированию дезадаптивной нейропластичности в определенных отделах ГМ, в т.ч. принимающих участие в когнитивных процессах. Пациенты с ХБС требуют своевременного и адекватного лечения болевого синдрома до появления и усугубления уже имеющихся КН, что в конечном итоге может приводить к их персистенции. Коррекция КН может существенно повыщать качество жизни пациента. Необходимы дальнейшие исследования, касающиеся КН у пациентов с ХБС, их коррекции и возможности их обратимости при своевременном и адекватном лечении.


