Введение
Ишемический инсульт (ИИ) является одной из ведущих причин заболеваемости, стойкой утраты трудоспособности в России и занимает первое место среди причин первичной инвалидности, обусловленной резидуальными неврологическими нарушениями, для бóльшей части пациентов, представленными стойким двигательным дефицитом разной степени выраженности [1]. До 90% выживших после инсульта больных имеют парез верхней конечности, причем в 40% случаев двигательные расстройства в руке остаются пожизненно [2, 3], существенно влияя на систему произвольной двигательной активности и полностью изменяя моторный стереотип у пациентов после ИИ [4]. Наиболее значимо при этом нарушается мелкая моторика кисти – многокомпонентный акт, состоящий из согласованных, высококоординированных и точных двигательных паттернов разной степени сложности.
В частности, у 70% пациентов после ИИ не происходит восстановления активной моторики верхней конечности на момент окончания курса стационарного лечения, а у половины больных не наблюдается существенных изменений двигательных функций кисти и через полгода после острого нарушения мозгового кровообращения [5]. Нарушение тонкой моторики в кисти пациентов после инсульта влечет за собой стойкую утрату профессиональных навыков, значительные сложности или невозможность самообслуживания, социальную дезадаптацию, что в итоге приводит к существенному снижению качества жизни этой категории больных [6, 7].
Реабилитационные мероприятия имеют первостепенное значение при ведении пациентов после ИИ, и современные программы медицинской реабилитации кисти и пальцев у этих больных, направленные на восстановление точных и координированных движений, базируются на следующих принципах: раннее начало, адекватная продолжительность, комплексный и мультидисциплинарный подход с соблюдением преемственности на всех этапах проводимой реабилитации [7]. Несмотря на несомненные достижения в области нейрореабилитации, в т.ч. современную методологию восстановления двигательной функции в паретичной руке у больных после ИИ с использованием виртуальной реальности (ВР) на основе принципа биологической обратной связи (БОС), в частности «сенсорной перчатки» [8–12], проблема восстановления моторного дефицита в кисти у этой категории больных продолжает оставаться актуальной. Одной из возможных, на наш взгляд, причин стойкого резидуального дефекта у пациентов после ИИ является преимущественное реабилитационное воздействие на паретичную конечность. Показано, что у больных после полушарного инсульта наблюдается вовлечение в патологический процесс нейрональных структур обеих гемисфер и связанных с ними сенсомоторных систем, как и последующее восстановление всей системы произвольной двигательной активности [13]. Это предполагает бóльшую эффективность восстановительных мероприятий в отношении двигательного дефицита в кисти при применении комплексного билатерального воздействия посредством ВР, эффективность которой не изучена, что и послужило целью настоящего проспективного рандомизированного клинического исследования.
Методы
Были обследованы 42 пациента после первичного ИИ в бассейне средней мозговой артерии в правом (19) и левом (23) полушариях головного мозга, медиана возраста составила 60,9 (50; 70) года, длительность заболевания от 6 до 12 месяцев. Верификация диагноза проводилась с помощью магнитно-резонансной томографии (МРТ) головного мозга: размер очага ИИ от 1 до 3 см. Контрольная группа состояла из 20 сопоставимых по возрасту здоровых испытуемых.
Все пациенты после ИИ были правшами (согласно Эдинбургскому опроснику) и имели нарушение тонкой моторики в кисти в той или иной степени. Критерии отбора больных: возраст от 18 до 70 лет; первичный ИИ в бассейне средней мозговой артерии, размер которого не превышал 3 см (по данным МРТ головного мозга); длительность заболевания – 3–12 месяцев; отсутствие синдрома неглекта, психических, онкологических заболеваний, выраженных когнитивных, речевых, двигательных нарушений, в т.ч. выраженных контрактур и деформаций верхней конечности, и соматических болезней в стадии декомпенсации. Все включенные в исследование пациенты подписали добровольное информированное согласие на участие в нем.
Для объективизации степени выраженности неврологического дефицита использовались общепринятые международные шкалы и опросники: модифицированная шкала Frenchay и тест ARAT (англ. Action Research Arm Test) – для оценки функции верхней конечности, подраздел «H» шкалы исследования функциональных возможностей верхней конечности MAS (англ. Motor Assessment Scale) и тест «девять колышков и девять отверстий» – для анализа тонкой моторики кисти; визуальная аналоговая шкала (ВАШ) – для оценки выраженности болевого синдрома при его наличии; индекс Бартел и шкала FIM (англ. Functional Independence Measure) – для анализа степени функциональной независимости.
Рандомизация пациентов после ИИ проведена методом случайных конвертов в две группы в соответствии со строго определенными критериями, включившими средний возраст, пол, длительность заболевания, патогенетический подтип ИИ, локализацию и размеры ишемического очага и выраженность неврологического дефицита в период отбора. Все больные получали терапию согласно стандартам оказания медицинской специализированной помощи при ИИ. Кроме того, программа физической реабилитации пациентов основной группы (22 человека) включила 10 занятий с использованием реабилитационной перчатки «Аника» как для пораженной, так и для непораженной кисти (около 1 часа 1 раз в день для каждой руки на протяжении 2 недель). В набор инновационного отечественного тренажера с системой БОС «Аника» входит сенсорная перчатка с датчиками положения и скорости, точно регистрирующими движения пальцев, и программное обеспечение с набором игровых стратегий различного уровня сложности в условиях ВР, позволяет формировать определенные двигательные паттерны и адаптировать программу реабилитации в соответствии с реальными возможностями конкретного пациента.
Функциональный статус всех больных оценивался до и после курса восстановительного лечения. Исследование одобрено Локальным Этическим комитетом Академии постдипломного образования Федерального государственного бюджетного учреждения «Федеральный научно-клинический центр специализированных видов медицинской помощи и медицинских технологий» Федерального медико-биологического агентства. Все участники подписали протокол информированного согласия в соответствии с требованиями Хельсинкской декларации.
Статистическая оценка полученных данных осуществлена с помощью параметрических и непараметрических методов статистики и корреляционного анализа на базе компьютерной программы Statistica для Windows 7.0. За величину уровня значимости принято значение 0,05, при котором различия или корреляции считались статистически значимыми.
Результаты исследования
После ИИ у всех пациентов в той или иной степени наблюдалось улучшение двигательной функции паретичной верхней конечности в результате курса реабилитационного воздействия. Вместе с тем больными основной группы достоверно чаще продемонстрировано снижение моторного дефицита, улучшение двигательного навыка и отдельных параметров движения (скорости, точности) в верхней конечности и мелкой моторики кисти, согласно большинству методов оценки функционального статуса исследуемых пациентов. Кроме того, у пациентов основной группы отмечалось статистически значимое улучшение функциональной независимости и активности в повседневной жизни (см. таблицу).
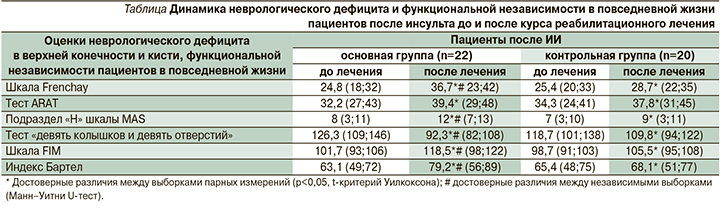
Следует отметить, что в обеих группах наблюдались болевые феномены разной степени выраженности, представленные болью в области плеча и в других суставах паретичных конечностей (59,5%), болезненными мышечными спазмами на фоне выраженной спастичности (23,8%) и головной болью (19,1%). При этом болевые ощущения пациентов основной группы были бóлее интенсивными как до (4,6 [2;8]), так и после лечения (4,2 [(2;8]). Болевой синдром умеренной выраженности у исследуемых контрольной группы наблюдался до (3,8 [2;6]) и после (3,7 [1;6]) лечения соответственно.
После ИИ у пациентов имела место обратная корреляционная связь между выраженностью нарушения тонкой моторики, согласно подразделу «H» шкалы MAS, и интенсивностью болевого синдрома, согласно ВАШ: r=-0,48 при p<0,05. Кроме того, статистически значимая связь отмечена между расстройством тонкой моторики, согласно тесту «девять колышков и девять отверстий», и выраженностью болевых ощущений по ВАШ: r=0,36 при p<0,05.
Обсуждение
ВР – одна из многообещающих реабилитационных технологий последних лет, которая заключается в создании для пациента с помощью автоматизированных, роботизированных устройств и компьютерных стратегий индивидуальной искусственной среды, позволяющей эффективно осуществлять разнообразные программы восстановления двигательных функций [9–11]. В частности, было неоднократно продемонстрировано улучшение функции паретичной верхней конечности и кисти, а также активности пациентов после ИИ в повседневной жизни при использовании «перчатки» или ортеза с системой ВР на основе принципа БОС [8, 10, 12]. Моторное переобучение возможно благодаря большому пластическому потенциалу сенсомоторной системы, обеспечивающей произвольные движения в кисти, и реализуется с помощью интенсивных, часто повторяющихся специфических для кисти двигательных заданий при использовании БОС, а также благодаря повышению мотивации пациентов после ИИ к восстановлению произвольных движений в кисти [5, 7, 8]. Известно, что афферентный поток на всех уровнях центральной нервной системы посредством разных механизмов влияет на обеспечение, видоизменение с учетом текущей двигательной задачи и реализацию двигательного контроля [2, 4, 13]. В первую очередь речь идет о механизмах обратной связи (англ. feedback) и опережающего контроля (англ. feed-forward), действующих на всех уровнях структурно-функциональной мультимодальной динамичной системы двигательного анализатора и обеспечивающих гибкость моторного управления [13].
Проведенное исследование показало более значимое улучшение функционального статуса верхней конечности и целенаправленных высококоординированных движений в кисти пациентов после ИИ, в программе восстановительного лечения которых билатерально использовалась реабилитационная перчатка «Аника». Наличие и выраженность болевого синдрома у исследуемых пациентов после ИИ стали фактором, затрудняющим и замедляющим восстановление сложного интегративного акта моторики кисти, что демонстрируют результаты проведенного корреляционного анализа. В связи с этим следует учитывать наличие болевого синдрома при терапии пациентов после ИИ для наиболее эффективного проведения дальнейшего курса нейрореабилитационного воздействия.
Заключение
Дефицит тонких двигательных навыков имеет такое же важное значение для человека, как и нарушение глобальных движений, оказывая значительное влияние на ежедневную повседневную жизнедеятельность [14], поэтому дальнейшее применение инновационных технологий с системой БОС, в частности реабилитационной перчатки «Аника», для обеих рук будет способствовать оптимизации реабилитационного воздействия и повышению качества жизни этой категории больных. Следует обратить внимание на наличие и выраженность болевого синдрома при определении индивидуальных алгоритмов реабилитационных мероприятий в отношении пациентов после ИИ, что безусловно повысит эффективность проводимого лечения и дальнейшего прогноза восстановления нарушенных функций.


