Введение
Процесс формирования и развития меланомы кожи (МК) остается предметом интереса многих ученых. На сегодняшний день получены данные о гетерогенной генетической природе различных форм опухоли и влиянии экзогенных факторов на появление меланомы [1], имеется представление о начальных проявлениях заболевания, а также накоплен опыт неинвазивной диагностики МК [2]. Многочисленные исследования показали, что опухолевый процесс возникает на фоне существовавшего ранее меланоцитарного невуса не более чем в трети случаев [3, 12], однако биологическая роль «родинок» в данной ситуации остается неясной. В статье приводятся описание клинических случаев МК, возникших на фоне меланоцитарных невусов, обзор литературы и обсуждение данной проблемы.
Клинический случай 1
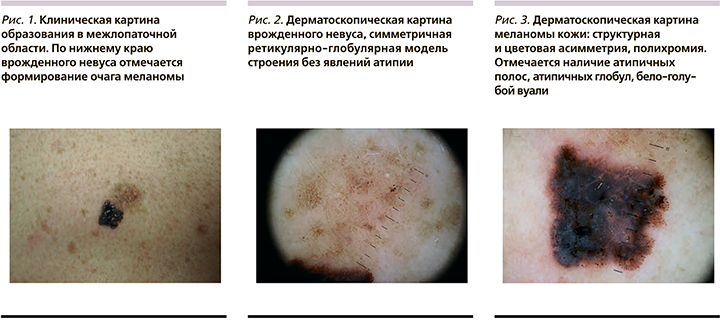
Женщина 37 лет обратилась для осмотра пигментного образования на коже спины. Со слов пациентки, несколько лет назад она заметила изменения со стороны существовавшей ранее «родинки» после неоднократных солнечных ожогов. При клиническом осмотре были выявлены множественные меланоцитарные невусы, в т.ч. клинически атипичные. Меняющееся образование располагалось в межлопаточной области и было представлено бляшкой светло-коричневого цвета с размытыми границами, незначительным гипертрихозом и сохранным кожным рисунком, размером 17×10 мм. По нижнему краю образования отмечалось формирование интенсивно-окрашенной бляшки черного цвета неправильной формы, с резкими границами, нарушенным кожным рисунком, размером 10×7 мм
(рис. 1). При дерматоскопическом осмотре в светлом образовании определялась симметричная ретикулярно-глобулярная модель строения без атипичных структур (рис. 2), в темном – асимметричная, мультикомпонентная модель строения (рис. 3). По результатам осмотра был выставлен предварительный диагноз: «поверхностно-распространяющаяся меланома кожи, возникшая на фоне среднего врожденного меланоцитарного невуса. Гистологическое исследование подтвердило клинический диагноз, толщина опухоли по Бреслоу составила 1,8 мм. Проведенное обследование, включая биопсию сторожевого лимфатического узла, не выявило данных за метастатическое поражение, пациентка оставлена под динамическое наблюдение.
Клинический случай 2
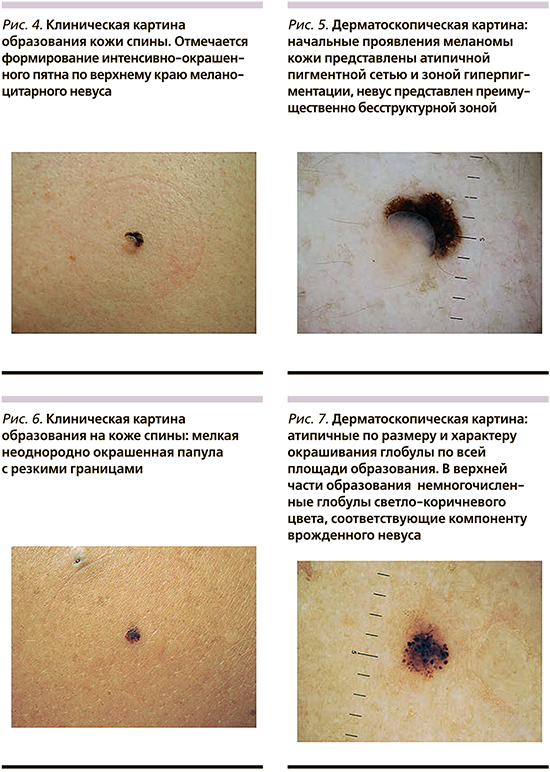
Мужчина 36 лет обратился для осмотра множественных новообразований кожи в рамках скрининговой кампании. На коже спины (рис. 4) было выявлено мелкое, интенсивно окрашенное пятно черного цвета с резкими границами, размером 3×3 мм.
По нижнему краю образования отмечалось наличие папулы телесного цвета, мягкой консистенции, размером 4×3 мм. Дерматоскопическая картина пигментированного участка была представлена атипичной пигментной сетью и зоной гиперпигментации, папулезного – бесструктурной областью телесного цвета и единичными линейными телеангиэктазиями (рис. 5). По результатам осмотра был выставлен предварительный диагноз: «поверхностно-распространяющаяся меланома кожи, возникшая на фоне внутридермального меланоцитарного невуса». Гистологическое исследование подтвердило клинический диагноз, опухоль была представлена исключительно внутриэпидермальным компонентом (меланома in situ).
Клинический случай 3
Женщина 57 лет обратилась на осмотр по рекомендации родственников, которые заметили появление «странной родинки» на коже спины.
В области правой лопатки была выявлена папула темно-коричневого цвета (рис. 6) с неравномерным окрашиванием и резкими границами, размером до 3 мм. По верхнему краю образования была заметна пигментация светло-коричневого цвета. Дерматоскопически образование было представлено атипичным глобулярным рисунком, отмечалась выраженная тенденция к периферическому росту (рис. 7). По результатам осмотра был предположен диагноз формирующейся поверхностно-распространяющейся меланомы кожи. Гистологическое и иммуногистохимическое исследования с маркерами меланоцитарной дифференцировки и пролиферативной активности подтвердили предположительный клинический диагноз, толщина опухоли составила 0,4 мм по Бреслоу. При иммуногистохимическом исследовании был также выявлен компонент мелкого врожденного меланоцитарного невуса, который стал фоновым процессом для развития злокачественной опухоли. Сопоставляя данные гистологии и клинической картины, становится понятно, что пигментация светло-коричневого цвета соответствовала врожденному невусу.
Обзор литературы
Согласно литературным данным, случаи МК, возникающие на фоне меланоцитарного невуса, имеют общие черты: так, опухоль развивается в более молодом возрасте, чаще располагается на коже туловища и отличается меньшей толщиной по Бреслоу [3–9]. Основным фактором риска развития МК на фоне невуса является наличие множественных меланоцитарных невусов, в т.ч. семейный синдром диспластических невусов и МК (FAMMM-синдром) [8, 10].
Клинические проявления данного сочетания зависят от гистологической разновидности формирующейся меланомы, стадии опухолевого процесса и типа меланоцитарного невуса.
В отдельных случаях однозначно предположить наличие фонового доброкачественного образования при осмотре не представляется возможным. Наиболее часто диагностируется поверхностно-распространяющаяся МК, формирующаяся по периферии меланоцитарного невуса, реже – узловая форма, которая может развиваться в пределах невуса [6, 10, 11]. Дерматоскопическая картина в большинстве случаев не представляет сложностей и проявляется «дерматоскопическим островом» – фокусом атипичных или резко отличающихся от модели строения меланоцитарного невуса признаков, позволяющих заподозрить МК [12]. Дифференциальный диагноз следует проводить с некото-рыми разновидностями меланоцитарных невусов (диспластический, комбинированный или пятнистый), формированием пролиферативного узла или развитием некоторых дерматозов в пределах существовавшего ранее невуса (фолликулит, контагиозный моллюск).
В качестве фонового процесса для развития МК могут выступать различные врожденные и приобретенные меланоцитарные невусы, причем нередко «родинки» будут иметь банальные клинические и, что более важно, гистологические проявления [3, 6, 9, 13]. Отмечается прямая корреляция между размером невуса и временем его озлокачествления, а также типом формирующейся МК. Считается, что в пределах гигантских невусов опухоль чаще представлена узловой разновидностью и формируется в первые 10 лет жизни ребенка, в то время как в более мелких образованиях МК возникает после пубертата и располагается в коже поверхностно [14–16]. Развитие опухоли в пределах голубого невуса отличается более глубоким расположением патологического процесса [17].
Прогноз для жизни в случае развития меланомы на фоне меланоцитарного невуса, по разным данным, считается более благоприятным или таким же по сравнению с первично возникающими опухолями [5–7, 11, 18].
Обсуждение
В литературе можно встретить такой термин, как «меланомоопасный невус», подразумевающий возможность развития злокачественной опухоли на фоне существовавшего ранее доброкачественного пигментного образования [19, 20]. Исследователи отмечают, что основными триггерами вероятного озлокачествления могут стать воздействие ультрафиолета, изменение гормонального фона в период полового созревания или беременности, повторяющаяся бытовая травма и др. Нередко и пациенты с выявленной МК указывают, что в области опухоли раньше длительное время существовала «обычная родинка» и по какой-то причине она «переродилась». Устоявшееся мнение о перерождении меланоцитарных невусов нередко приводит к «превентивному» удалению отдельных образований (в частности, диспластических невусов) или элементов, располагающихся на волосистой части головы и в акральных областях.
Однако литературные данные свидетельствуют об отсутствии такой необходимости. Если бы постоянное механическое воздействие или ультрафиолетовое излучение приводили к «перерождению» меланоцитарных невусов, то существенно изменилась бы преобладающая локализация опухолевого процесса. Так, вместо туловища МК на фоне невуса развивалась бы в области повышенного давления (подошв) или на открытых, подверженных длительному воздействию ультрафиолетового излучения участках. Более того, к термину «меланомоопасный невус» стоит относиться критически, учитывая, что ранние проявления МК лишены привычного полиморфизма клинико-дерматоскопической картины, сложны для диагностики и могут имитировать проявления меланоцитарных невусов [2].
Приведенные нами клинические случаи показывают, что формирование злокачественной опухоли на фоне невуса сопровождается заметными изменениями и может быть своевременно выявлено при должной профессиональной подготовке и/или использовании вспомогательных средств (например, искусственного интеллекта). Учитывая банальные внешние проявления меланоцитарных невусов, на фоне которых развилась МК, или случайное обнаружение клеток невуса при гистологическом исследовании, врач не может предсказать, какая именно «родинка» пациента может оказаться «миной замедленного действия». Также встречаются данные о чрезвычайно низкой вероятности озлокачествления отдельно взятого меланоцитарного невуса – ежегодный риск не превышает 0,0005% для людей моложе 40 лет и 0,003% для мужчин старше 60 лет [21]. Таким образом, процесс удаления меланоцитарных невусов в большинстве случаев нужно считать либо диагностической процедурой, при которой врачу не хватает клинических данных для постановки диагноза, либо эстетической, при которой внешний вид образования не устраивает пациента, но никак не профилактической мерой!
С другой стороны, случаи развития МК на фоне меланоцитарного невуса нельзя назвать редкими. Приведенные статистические данные являются обобщенными, но если взять группу пациентов высокого риска, то частота развития МК на фоне меланоцитарного невуса может увеличиться до 54,2% [10]. Более того, на вероятность обнаружения клеток невуса при морфологическом исследовании могут влиять процесс приготовления гистологических препаратов на этапе вырезки материала в лаборатории, квалификации патоморфолога и стадия опухолевого процесса. Молекулярно-генетические исследования показали, что по мере увеличения толщины опухоли снижается вероятность обнаружения клеток существовавшего ранее меланоцитарного невуса при стандартном окрашивании гематоксилин-эозином [22]. Одна из недавних работ показала, что в части невус-ассоциированных опухолей меланоциты невуса и меланомы имеют идентичный генетических профиль [23]. Эти данные поддерживают концепцию «перерождения» и указывают на необходимость дальнейшего изучения проблемы.
Актуальной задачей является определение последовательности событий, запускающих канцерогенез и способствующих его прогрессированию. На сегодняшний день в генетике злокачественной меланомы помимо врожденной предрасположенности к развитию опухоли выделяют возможность формирования локальных соматических мутаций, запускающих канцерогенез [24]. Идеально простая теория «перерождения» предполагает единственный путь эволюции: постепенную трансформацию простого невуса в атипичный (например, диспластический), а далее – в меланому. Но в реальности теория опухолевого прогрессирования, предложенная W.H. Clark [25], не ограничивается только диспластическими невусами как образованиями-предшественниками. Предлагаемые альтернативные теории канцерогенеза [26] также не сопоставляются с клиническими данными, поскольку не учитывают вероятности развития МК на фоне врожденных невусов.
Заключение
Таким образом, процесс формирования невус-ассоциированной меланомы на сегодняшний день правильнее считать случайностью, вероятность развития которой медицинское сообщество не может предсказать. В связи с этим одним из важнейших направлений профилактики поздней выявляемости меланомы кожи может служить своевременное формирование групп повышенного риска и проведение активного динамического наблюдения за пациентами. Важность выявления МК на ранней стадии и наличие видимых признаков развития злокачественной опухоли диктуют необходимость применения дерматоскопической техники с возможностью значительного оптического увеличения и работы с сериями снимков. Трудоемкость анализа серий изображений десятков, а иногда и сотен новообразований у пациентов группы риска на врачебном приеме создает условия для разработки технологий искусственного интеллекта и внедрения автоматизированной обработки цифровых изображений [27].



