Актуальность
Лечение хронических кожных заболеваний ввиду необходимости проведения его в течение длительного периода времени нередко представляет трудную задачу. Вместе с тем в ходе наблюдения возникает потребность в оценке динамики кожного процесса в аспекте эффективности проводимой терапии. Для такой оценки в дерматологической практике был разработан ряд шкал и индексов, позволяющих объективизировать эффект лечения.
Так, для оценки степени тяжести атопического дерматита (АД) применяется индекс SCORAD. С 1990 по 1993 г. Европейской международной группой экспертов из 9 стран разрабатывалась система оценки проявлений и тяжести АД. Результатом этой работы стала публикация обобщающего согласительного документа Severity Scoring of Atopic Dermatitis (дословный перевод с английского – «шкалирование тяжести атопического дерматита») с разработкой и обоснованием внедрения в клиническую практику The SCORAD Index. Практика продемонстрировала высокую эффективность метода SCORAD в связи с его простотой и доступностью применения врачами вне зависимости от их опыта работы и даже специализации. Методика оценки проявлений и степени тяжести АД по индексу SCORAD предусматривает комплексную оценку трех информационных блоков: распространенность кожных поражений (А), их выраженность или интенсивность (В) и субъективные симптомы (С) [1].
Наиболее известным инструментом оценки состояния пациента и динамики кожного процесса в дерматологии служат индексы оценки псориатического процесса различных локализаций. На сегодняшний день разработано несколько шкал, позволяющих определить степень и тяжесть псориатического процесса на коже, поражение ногтевых пластин, суставов, влияние болезни на качество жизни и т.д.: индекс PASI, BSA, NAPSI, PGA, DLQI и др. Согласно классификации Национального фонда псориаза США, степень тяжести псориаза оценивается с определением BSA (Body surfase area) – общей площади поражения тела, при этом 1% площади поверхности тела соответствует площадь ладони пациента. При значении BSA <3 диагностируют легкую степень тяжести псориаза, 3< BSA <10 – среднюю степень, BSA >10 – тяжелый псориаз. Индекс тяжести поражения псориазом PASI (Psoriasis Area and Severity Index) – наиболее часто используемый инструмент определения тяжести и активности псориатического процесса. Критерии расчета индекса были впервые предложены в 1979 г. и в основе своей остаются неизменными. Использование индекса PASI имеет не только научный аспект, но и главным образом прикладной характер. С его помощью определяют тактику и стратегию ведения пациентов с псориазом, ну и конечно же эффективность (адекватность) проводимой терапии. В PASI комбинируются количественные оценки степени выраженности основных клинических проявлений (инфильтрация, зуд, утолщение кожи, отек, гиперемия, шелушение) с оценкой площади поражения по простой линейной шкале. Надо сказать, что, вероятно, для псориаза разработано наибольшее количество различных шкал, индексов и опросников [2–5].
Так, например, оценочная шкала врача sPGA используется для оценки очагов поражения псориазом у конкретного пациента. Она включает три критерия: инфильтрация, шелушение, эритема. Наличие одновременно трех критериев необязательно. Инфильтрация является самым стойким признаком, тогда как наличие шелушения или эритемы варьируется.
Данный индекс складывается из суммы баллов оценки инфильтрации очагов и одного их превалирующих критериев (эритема или шелушение) [6].
Чтобы оценить степень тяжести и результативность назначенной терапии при лечении пациентов с красным плоским лишаем применяется индекс активности и тяжести красного плоского лишая – ILP (index lichen planus). Для подсчета этого показателя оценивают клинические проявления – папулы, инфильтрацию, эритему, ксероз, гиперкератоз, а также анализируют площадь высыпаний, поражение ногтевых пластин и слизистых оболочек. Максимальная сумма баллов составляет 24 балла и соответствует тяжелому течению заболевания. Легкость расчетов этого индекса и возможность оценить тяжесть заболевания делают этот показатель полезным и перспективным диагностическим критерием в дерматовенерологической практике [7].
Приведенные индексы представляют лишь малую часть того большого числа оценочных критериев, которые нашли применение в дерматологии.
В сферу наших интересов входит такая нозология, как склероатрофический лихен вульвы (САЛВ), который считают одной из форм ограниченной склеродермии. В процессе ведения пациентов возникает необходимость динамической оценки как площади поражения, так и выраженности клинических проявлений заболевания на фоне терапии.
Склеродермия занимает особое положение среди дерматологических заболеваний, что обусловлено множеством локализаций патологического процесса, а также возможностью трансформации локализованных форм склеродермии в системный процесс.
Оценка активности заболевания при склеродермии
С современных позиций склеродермия рассматривается как аутоиммунный процесс неясной этиологии. Отсутствие единого эффективного метода лечения привело к поиску комбинаций различных методов, применение которых далеко не всегда позволяет добиваться выраженного клинического эффекта. Трудности определения активности кожного процесса при системной склеродермии обусловлены рядом факторов: во-первых, у многих пациентов, особенно с лимитированной (ограниченной) формой, наблюдается медленнопрогрессирующее течение, в клинике преобладают сосудистые расстройства без четких признаков воспаления. Во-вторых, отсутствует конкретная лабораторная точка наблюдения, т.е. лабораторный признак, один или несколько, повышение референсного уровня которого можно было бы считать точным критерием начала прогрессирования кожного процесса. В литературе встречаются дискуссионные исследования, основным положением которых является то, что пациенты с ССД могут иметь ослабленный острофазовый ответ. Только небольшое количество острофазовых белков повышается у пациентов преимущественно с ранней ССД. В-третьих, клинические признаки ССД, связанные с сосудистыми проявлениями и соединительнотканным фиброзом, наиболее трудны для понимания и количественной оценки. Когда эти изменения становятся измеримыми, болезнь уже зачастую приводит к постоянному повреждению органов и тканей [8–10].
Вместе с тем проводимое лечение склеродермии требует объективизации. Для этих целей в практике применяется несколько индексов.
До настоящего времени нет общепринятого подхода к определению активности системной склеродермии (ССД). В 2001 г. Европейской группой по изучению системного склероза (European Scleroderma Study Group – EScSG) были предприняты попытки создать индекс активности. Исследователями из 19 европейских центров 11 стран был проанализирован набор из 88 клинических и лабораторных показателей 290 последовательно поступавших в клиники пациентов с диффузной или лимитированной формой ССД. В качестве «золотого» стандарта прибегали к экспертной оценке активности по 10-балльной шкале, для чего экспертами независимо друг от друга были оценены все параметры болезни у каждого больного. С целью выявления клинических параметров, коррелирующих с активностью (оцененной экспертами), был проведен унивариантный анализ.
Для определения различных комбинаций признаков как предикторов «золотого» стандарта активности и оценки относительного удельного веса (значимости) каждого параметра применяли метод мультивариантного линейного регресса. При помощи статистического анализа в зависимости от частоты выявляемости и веса каждого признака были отобраны основные параметры, которые включили в общий индекс активности. Наряду с общим индексом были также разработаны индексы активности для диффузной и лимитированной форм ССД. Общий индекс активности включает 10 признаков с весом каждого от 0,5 до 2 баллов. При определении общей активности баллы суммируют, максимально возможный балл – 10. При показателе активности ≥3 баллов заболевание расценивают как активное [11].
Во Франции применяется другой индекс оценки выраженности и степени тяжести склеродермии – индекс Роднана (Score de Rodnan modifie (mRSS)). Индекс позволяет оценивать площадь поражения и выраженность кожного процесса, суммируя очаги поражения и оценивая каждую анатомическую область в градации выраженности симптомов от 0 до3 баллов [12].
Для формализованного описания тяжести патологического процесса при ограниченной (очаговой) склеродермии предложено использовать различные индексы. Например, модифицированный индекс тяжести очаговой склеродермии mLoSSI оценивает эритему, толщину кожи, развитие новых или увеличение старых очагов в 18 анатомических областях по степеням от 0 до 3. [13]
Индекс LoSDI разработан для оценки эффективности лечебных мероприятий при ЛС и дополнен критерием нарушения пигментации от 0 до 3 [14, 15].
Особенности локализации и течения САЛВ не позволяют применять в клинической практике перечисленные индексы. Вместе с тем необходимость длительного применения топических глюкокортикостероидов (ГКС) или топических ингибиторов кальциневрина, обладающих иммуносупрессивным эффектом и повышающих риск малигнизации, а также вероятность отсутствия эффекта от применения вышеперечисленных препаратов требуют наличия инструментов оценки динамики кожного процесса с целью контроля за течением заболевания и принятия своевременного решения о переходе к препаратам системного действия при неэффективности наружных препаратов.
Цель исследования: предложить методы объективной оценки эффективности терапии САЛВ и с их помощью провести оценку этапного лечения данного заболевания.
Методы
Группу наблюдения составила 41 пациентка с установленным клинически и подтвержденным данными гистологического исследования диагнозом склероатрофический лихен вульвы (САЛВ) в возрасте от 19 до 59 лет. Ранее ни одна из пациенток не получала наружную и/или системную терапию по поводу этой нозологии. В возрасте 19 лет было 2 человека, 23 года – 1, 32 года – 12, 35 лет – 8, 36 лет – 2, 37 лет – 6, 52 года – 4, 56 лет– 3, 59 лет – 3.
Для оценки площади поражения – LS-S-индекс (Lichen Sclerosus-S) – мы предложили всю область вульвы разделить на 4 квадранта (по двум сторонам – левая и правая половина и, соответственно, два верхних и два нижних), а поражение каждой их этих зон оценивать в 1 балл: область малых половых губ (слева и справа), область больших половых губ (слева и справа), область клитора и перианальная область, что в итоге дает 10 условных зон.
Таким образом, при начальных проявлениях САЛВ, когда заболевание дебютирует из области клитора, возможно минимальное количество баллов – 1, при поражении всей вульвы и перианальной области максимальное – 10.
Оценку активности процесса и динамику клинических изменений кожи в каждом из квадрантов вульварной области на фоне терапии удобно оценивать по следующим критерия: эритема, отек, уплотнение кожи, белый цвет очагов, гиперкератоз, атрофия, пузыри, пурпура/экхимозы, эрозии, трещины. Каждый из клинических признаков ранжирован по выраженности от 0 до 3, где 0 – признак отсутствует, 1 – выражен незначительно, 2 – выражен умеренно, 3 – признак выражен значительно. Таким образом, при максимальной выраженности клинических проявлений индекс LS-A будет составлять 30 баллов.
Такие индексы включают все формы САЛВ, легко применимы в клинической практике и позволяют провести как пространственную диагностическую оценку очагов, так и определить активность кожного процесса.
В соответствии с оценкой площади поражения по LS-S-индексу 27 женщин имели поражение, оцениваемое в 9 баллов (в этой группе отсутствовало поражение перианальной области), 11 пациенток – в 5 баллов и 3 – в 7 баллов.
Результаты оценки тяжести клинических проявлений представлены в табл. 1.

Все пациентки получали терапию в соответствии с современными подходами к лечению САЛВ: на первом этапе — топические ГКС, на втором – терапию аутологичной плазмой в количестве 4 процедур и на третьем этапе (при замедленном восстановлении пораженных участков кожи) – воздействие на очаги СО2-лазером (2 сеанса c интервалом между процедурами 4 недели).
Продолжительность каждого этапа определялась выраженностью субъективных ощущений и клинических проявлений. Продолжительность первого этапа (терапия топическими глюкокортикостероидами) варьировалась от 2 недель до 1 месяца. На втором этапе в очаги САЛВ вводили аутологичную плазму в объеме 8 мл. Приготовление аутологичной плазмы, обогащенной тромбоцитами, выполнялось по методу Plasmolifting [16]. Интервал между введениями аутологичной плазмы составил 10–12 дней. Применение аутологичной плазмы способствовало восстановлению микроциркуляции в очагах, выражавшемуся в порозовении очагов, уменьшении уплотнения кожи. Применение фракционного CO2-лазера на третьем этапе имело своей целью запуск процессов ремодуляции коллагена в очагах САЛВ. Процедура выполнялась на аппарате Lutronic eCO2: размер луча – 120 микрон, мощность излучения – 30 Вт, плотность точек – 200 точек/см2. Из исследования исключали пациенток, нарушивших сроки этапного лечения и контрольного наблюдения.
Условия проведения: все этапы лечения проходили в ООО «Клиника Игнатовского» по направлениям из женских консультаций и частных клиник Санкт-Петербурга, после получения добровольного инфрмированного согласия на процедуру обследования и лечения.
Контрольные точки наблюдения – 14, 30, 60 и 120±2 дня терапии. В каждой из точек наблюдения проводили оценку с помощью индексов активности САЛВ и площади поражения при САЛВ.
Результаты
Все пациентки перенесли терапию хорошо. Полное исчезновение или уменьшение зуда до незначимого к 14-му дню отмечалось у 42% женщин, остальные отмечали периодическое появление зуда. К 30-му дню терапии топическими ГКС ни одна из пациенток не предъявляла жалоб на зуд. Такая положительная динамика субъективных жалоб сохранялась до конца периода наблюдения.
Нежелательные явления наблюдались на этапе инъекций аутологичной плазмы в виде кратковременной болезненности в местах введения, единичных геморрагиях, а на этапе применения фракционного СО2-лазера — отек, гиперемия тканей, чувство жжения, купированные к концу первых суток после процедуры применением аппликаций сухого холода.
Наиболее выраженными результаты терапии были к 120-му дню наблюдения. Результаты в первоначально определенных группах представлены в табл. 2.
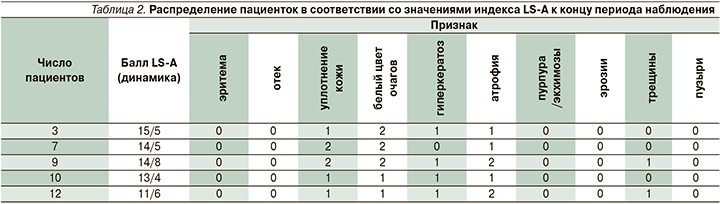
Площадь поражения по LS-S-индексу после лечения у 27 женщин соответствовала 5 баллам (в этой группе отсутствовало поражение перианальной области) у 11 – 2 и у 3 пациенток – 4 баллам.
Обсуждение
Совершенствование терапии САЛВ, который относится к дистрофиям вульвы и рассматривается как предраковое состояние, чрезвычайно актуально. Вместе с тем в руках специалистов, оказывающих помощь пациентам с этой патологией, отсутствовали эффективные инструменты объективной оценки тяжести и динамики кожного процесса. В процессе наблюдения в нашем исследовании наиболее быстро отмечалось улучшение по субьективным показателям: исчезновение или уменьшение зуда, жжения, сухости кожи, тогда как регресс клинических признаков САЛВ имел более замедленную динамику и наиболее выраженные положительные изменения были отмечены к 120-му дню наблюдения. Применение индекса активности кожного процесса при САЛВ позволило врачу получать цифровое выражение положительного результата от проводимого лечения в короткий период наблюдения, тогда как индекс оценки площади поражения при САЛВ позволил провести долгосрочную оценку результата и определить при диспансерном наблюдении группу пациенток, нуждавшихся в раннем повторном визите для оценки клинической картины и планирования реабилитационных или лечебных мероприятий.
Следует отметить, что применение вновь разработанных индексов – индекс оценки площади кожного поражения при САЛВ (LS-S) и индекс активности кожного поражения при САЛВ (LS-A) – показали удобство их применения в медицинской практике как инструмента объективной оценки степени тяжести проявлений САЛВ и динамики кожного поражения в процессе лечения.
Заключение
Отсутствие до настоящего времени инструментов объективной оценки кожного поражения при САЛВ затрудняло оценку как степени тяжести, так и динамики заболевания на фоне проводимого лечения. Проведенное исследование показало, что применение индекса активности кожного процесса при САЛВ (LS-A) и индекса оценки площади поражения при САЛВ (LS-S) является надежным и воспроизводимым инструментом при измерении тяжести САЛВ и терапевтических эффектов и может быть легко внедрено в клиническое обследование пациентов с САЛВ. Представляется перспективным применение индекса активности кожного процесса при САЛВ (LS-A) и индекса оценки площади поражения при САЛВ (LS-S) не только для оценки эффективности проводимого лечения, но и с целью разработки индивидуального плана реабилитационных мероприятий в отношении пациенток с САЛВ.


