Введение
Врожденный буллезный эпидермолиз (ВБЭ) – это группа редких наследственных заболеваний, для которых характерно нарушение межклеточных связей в эпидермисе или эпидермально-дермальном соединении, приводящее к образованию пузырей на коже и/или слизистых оболочках даже при незначительном травмировании [1]. Наиболее тяжелую группу составляют пациенты с дистрофической формой ВБЭ. К основным клиническим проявлениям этой формы заболевания относятся пузыри и/или эрозии на коже и слизистых оболочках. Эпителизация эрозивных дефектов может происходить с формированием рубцовой ткани (чаще атрофической) и милиумов [2]. В желудочно-кишечном тракте процессы рубцевания приводят к заращению вестибулярных складок, утрате уздечки, анкилоглоссии, стриктурам пищевода, сопровождаемым эпизодами дисфагии, явлениями гастроэзофагеального рефлюкса, запорами [3, 4].
Потеря кожей и слизистыми оболочками барьерных свойств обусловливает избыточное поступление антигенов, в т.ч. аллергенов пищевого и непищевого происхождения. Однако вопросы пищевой сенсибилизации и пищевой аллергии для данной категории пациентов изучены недостаточно. Так, поиск публикаций (Web of Science и PubMed) позволил обнаружить лишь одну работу H. Marcelo et al. [5], в которой впервые описан клинический пример ребенка с дистрофической формой ВБЭ и наличием эозинофильных инфильтратов в сочетании с повышенным уровнем общего IgE. Также опубликовано наблюдение контактного дерматита у ребенка с ВБЭ [6]. В то же время одновременное нарушение и кожного, и эпителиального барьеров, которое у детей с ВБЭ имеет место с первых дней жизни, может стать причиной сенсибилизации к такому важному аллергену детского возраста, как белок коровьего молока, с последующим развитием клинически значимой аллергии.
Цель исследования: оценить особенности IgE-ответа на белки коровьего молока и клинических проявлений аллергии на белки коровьего молока (АБКМ) у детей с ВБЭ
Методы
Дизайн исследования
Проведено открытое нерандомизированное наблюдательное проспективное исследование оценки особенностей АБКМ у детей с ВБЭ в период с 2016 по 2018 г.
Критерии включения: дети любого возраста обоих полов с установленным диагнозом буллезного эпидермолиза (Q81.0 – простая форма ВБЭ, Q81.2 – дистрофическая форма ВБЭ).
Критерии исключения: отказ родителей/законных представителей ребенка от участия в исследовании.
Исследование проведено на базе отделения кожных болезней Национального медицинского исследовательского центра здоровья детей (Москва). Работа выполнена в рамках научной темы «Оптимизация общих подходов к диагностике, лечению и реабилитации хронических дерматозов у детей». Исследование одобрено локальным Этическим комитетом.
Все дети с ВБЭ проходили комплексное обследование в соответствии с международными регламентирующими документами по ведению больных данной патологией [1].
В диетологический анамнез включена информация о видах вскармливания, сроках введения продуктов, блюд прикорма и реакции на эти продукты, об особенностях питания матери во время беременности и лактации, а также рациона питания ребенка. Для более эффективного сбора анамнестических данных использовали адаптированную сокращенную форму структурированного вопросника, рекомендованного EAACI для оценки анамнеза при подозрении на пищевую аллергию [7].
При наличии проявлений атопического дерматита верификацию диагноза осуществляли, опираясь на критерии Hanifin и Rajka [8].
При наличии клинических данных об аллергии на белки коровьего молока назначали диагностическую безмолочную элиминационную диету продолжительностью 30 дней. На этот период из рациона исключали все молочные продукты, говядину, телятину, а также другие «подозрительные» причинно-значимые продукты при наличии соответствующих клинических данных [9]. Через месяц проводили открытую провокационную пробу или диагностическое введение молочного продукта [9] для подтверждения или исключения АБКМ. Тактика диетотерапии детей с АБКМ определялась в соответствии с актуальными клиническими рекомендациями [10].
Взятие крови на анализы (генетический, иммунологический) осуществляли в плановом порядке, при заборе крови для основного плана обследования, без дополнительной венепункции.
С целью верификации диагноза ВБЭ использовали метод массивного параллельного секвенирования. В панель были включены 24 гена, мутации в которых вызывают симптомокомплекс буллезного эпидермолиза. Поиск нуклеотидных последовательностей генов проводился в биоинформационной базе данных NCBI (National Center forBiotechnological Information, USA). Для поиска консервативных участков использована программа BLAST [11]. Последовательности олигонуклеотидов подбирались с помощью программы Beacon Designer 8.10. Проверка специфичности пар праймеров проводилась с помощью программы Primer-BLAST [12]. Диагноз дистрофического буллезного эпидермолиза устанавливался при наличии различных мутаций в гене коллагена 7-го типа (COL7A1), простой формы буллезного эпидермолиза – при наличии мутаций в генах KRT5, KRT14, TGM5, DSP, PLEC, COL17A1.
Иммунологические и аллергологические методы обследования включали определение в сыворотке крови содержания общего IgE, уровня специ-
фических IgE (sIgE) к белкам коровьего молока и его фракциям (казеину, β-лактоглобулину, бычьему сывороточному альбумину) с помощью метода непрямой иммунофлуоресценции на автоматическом анализаторе ImmunoCAP250 (UniCAP System, Thermo Fisher Scientific, ранее Phadia АВ). Применялись референсные значения для специфических IgE-антител, согласно инструкции производителя тест-системы: 0,35–0,7 kUA/l I – (низкий) класс сенсибилизации; 0,7–3,5 kUA/l II – (средний) класс сенсибилизации; 3,5–17,5 kUA/l III – (умеренно высокий) класс сенсибилизации; 17,5–50 kUA/l IV – (высокий) класс сенсибилизации; 50–100 kUA/l V – (очень высокий) класс сенсибилизации, выше 100 kUA/l VI – (предельно высокий) класс сенсибилизации.
Размер выборки предварительно не рассчитывали. Обработку полученных данных проводили с помощью пакета статистических программ SPSS 20 (IBM, США). Полученные количественные данные проверялись на соответствие нормальному распределению с помощью критерия Шапиро–Уилка. Для выборок, не подчинявшихся нормальному распределению, определяли медиану, а также 25-й и 75-й перцентили. При оценке различий для признаков, распределение которых отлично от нормального, использовали критерий Манна–Уитни. Разницу значений считали значимыми при р<0,05.
Результаты
Участники исследования
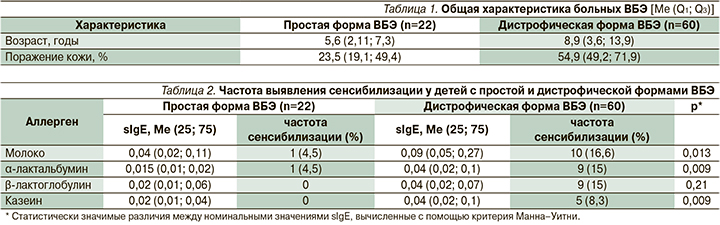
В исследование были включены 82 пациента с ВБЭ: 60 детей с дистрофической формой ВБЭ в возрасте от 11 месяцев до 16 лет 2 месяцев, из них мальчиков 45,0%, и 22 ребенка с простой формой ВБЭ в возрасте от 2 месяцев до 9 лет 2 месяцев, из них мальчиков 45,4% (табл. 1).
Особенности IgE-ответа в подгруппах детей с ВБЭ в зависимости от формы заболевания
Содержание общего IgE в группе детей с простой формой ВБЭ не соответствовало возрастной норме у 3 детей, при этом не превышало 1000 kUA/l. У одного из детей с повышенным уровнем IgE была диагностирована пищевая аллергия, у другого – бытовая сенсибилизация.
В группе пациентов с дистрофической формой ВБЭ уровень общего IgE превышал возрастные показатели в 30 (50%) наблюдениях, при этом у 8 (13,3%) детей уровень IgE был выше 1000 kUA/l, у 5 – выше 3000 kUA/l.
Для большинства детей с дистрофической формой ВБЭ с повышенным уровнем IgE были характерны более высокие значения площади поражения кожи, площади инфицированных участков кожи.
Этиологическая структура и характер сенсибилизации у детей с ВБЭ и АБКМ
Частота выявления повышенных уровней специфических IgE у детей с простой и дистрофической формой ВБЭ представлена в табл. 2.
Выявление повышенных уровней sIgE к пищевым белкам в отсутствие явной клинической картины АБКМ расценивалось как сенсибилизация. Ребенку назначалась диагностическая безмолочная диета с последующим диагностическим введением молочного продукты (открытая провокационная проба), на основании чего или подтверждалась, или исключалась клинически значимая АБКМ.
Оценка клинических проявлений пищевой аллергии у детей с различными формами ВБЭ
Анализ наследственности в группе детей с дистрофической формой ВБЭ и АБКМ выявил, что лишь шесть детей страдали отягощенным семейным анамнезом по аллергическим заболеваниям.
С учетом особенностей клинической картины буллезного эпидермолиза, заключающихся в поражении как кожного покрова, так и слизистых оболочек ротовой полости и кишечника, верификация диагноза пищевой аллергии для данной категории пациентов весьма затруднительная. Тем не менее при тщательном сборе анамнеза, а также при выявлении четкой причинно-следственной связи появления симптомов с приемом того или иного вероятного причинно-значимого продукта удается выделить спектр подозреваемых пищевых белков. Большинство родителей пациентов указывали на усиление зуда при приеме определенных продуктов или появление новых, не характерных для основного заболевания высыпаний. Важную дополнительную информацию давали результаты диагностической элиминационной диеты и открытой провокационной пробы. В результате пищевая аллергия была диагностирована у 2 (9,1%) детей с простой и у 15 (25%) – с дистрофической формами ВБЭ. В группе детей с дистрофической формой ВБЭ IgE-опосредованная АБКМ была диагностирована в 11 наблюдениях, что составило 17,7%. Проявления АБКМ выражались в виде кожных и гастроинтестинальных симптомов. Усиление зуда после употребления того ил иного молочного продукта, появление пятнисто-папулезной сыпи при дистрофической форме ВБЭ отмечены у 17,7%.
У троих детей с дистрофической формой заболевания имелись кожные проявления, соответствовавшие критериям диагностики атопического дерматита (5%). Проявления атопического дерматита купировались или значительно регрессировали после исключения из питания ребенка причинно-значимого продукта.
Гастроинтестинальные проявления АБКМ – срыгивания, разжиженный непереваренный стул, стул со слизью, на фоне приема молочных продуктов имели место при дистрофической форме ВБЭ 16,1% детей. Важно также отметить, что после назначения безмолочной диеты у 4 детей с АБКМ прошли запоры, которые изначально рассматривались как проявление основного заболевания.
У части детей с дистрофической формой заболевания помимо АБКМ отмечалась также аллергия на злаки (n=5), фрукты и овощи (n=5), на яйца (n=3).
Среди детей с простой формой ВБЭ клинические реакции на молочные продукты были выявлены у двух пациентов. У обоих молочный белок был единственным причинно-значимым аллергеном. Симптомы АБКМ носили эпизодический характер, купировались исключением причинно-значимого продукта.
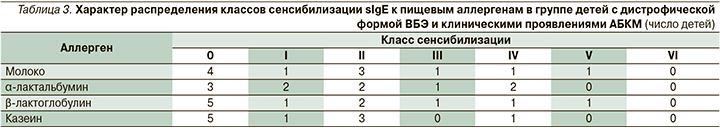
sIgE к молочному белку и его фракциям выявлялись на уровнях, соответствовавших классу сенсибилизации от низкого до умеренно-высокого (табл. 3). В ряде случаев делалось заключение о наличии не-IgE-опосредованной аллергии на молочные белки.
Обсуждение
Дистрофические формы буллезного эпидермолиза характеризуются значительным повреждением кожных покровов, а у подавляющего числа больных – также и слизистой оболочки ЖКТ. Это приводит одновременно к нарушению барьерных свойств кожи и ЖКТ и создает условия для избыточного поступления во внутреннюю среду организма антигенов, в т.ч. и пищевого происхождения. Поскольку молочный белок – один из основным белков из «большой восьмерки» аллергенов, с которым ребенок сталкивается с первых месяцев жизни, представляло интерес изучение частоты сенсибилизации к белкам коровьего молока и особенностей клинических проявлений аллергии на молочные белки у детей с ВБЭ. Аллергия на белки коровьего молока представляет важное клиническое значение, особенно в раннем детском возрасте, когда от правильного подбора смеси в значительной степени зависит успех всего лечения.
Настоящее исследование подтвердило высокую частоту как сенсибилизации к белкам коровьего молока, так и клинически значимой аллергии у детей с ВБЭ. АБКМ была выявлена у 25% детей с дистрофической формой ВБЭ, в 17,7% случаев она носила IgE-опосредованный характер (73,3% от всех детей с клинически значимой АБКМ). У детей с простой формой ВБЭ клинически значимая АБКМ выявлена в 9,1% случаев. Сенсибилизацию к белкам коровьего молока, казеину, бычьему сывороточному альбумину диагностировали статистически значимо чаще у детей с дистрофической формой ВБЭ по сравнению с простой (p<0,05). Такая высокая встречаемость сенсибилизации к белкам коровьего молока и АБКМ среди детей с данной формой заболевания, по всей видимости, связана с обширными нарушениями целостности кожных покровов, их воспалением, а также поражением слизистой оболочки желудочно-кишечного тракта; что в свою очередь обусловливает избыточное поступление антигенов, в т.ч. пищевых аллергенов, и как следствие – формирование пищевой сенсибилизации [13, 14].
Аллергологическое обследование выявило также высокие уровни общего IgE у 50% детей с дистрофической формой ВБЭ, что встречалось статистически значимо чаще, чем в группе детей с простой формой ВБЭ; p<0,05. Причина обнаружения очень высоких (выше 1000 kUA/l; у 8 детей – 13,3%) и крайне высоких уровней (более 3000 kUA/l у 5 детей) общего IgE требует дальнейшего изучения.
Анализ клинических данных показал, что пищевая аллергия вносит свой вклад в клиническую картину заболевания, должна обязательно диагностироваться и учитываться в комплексной терапии этой сложной категории больных. Наличие сенсибилизации к пищевым аллергенам в отсутствие клинической картины пищевой аллергии также достаточно часто встречается у больных с дистрофической формой ВБЭ, в отсутствие реакций не требует исключения молочных продуктов из рациона ребенка. Напротив, клинически подтвержденная диагностической диетой и открытой провокационной пробой АБКМ, даже в отсутствие сенсибилизации к молочным белкам, должна трактоваться в соответствии с клинической картиной как не-IgE-опосредованная форма пищевой аллергии [9, 10].
Следует отметить, что вопросы пищевой сенсибилизации и пищевой аллергии у этой категории больных не изучены. Полученные нами данные говорят: наличие пищевой аллергии следует активно выявлять и учитывать при составлении рациона и осуществлении нутритивной поддержки этих тяжелых больных.
К ограничениям исследования относится в первую очередь небольшая группа пациентов, и это объясняется принадлежностью ВБЭ к редким заболеваниям. Еще одно ограничение: в настоящей работе проанализированы клинический и иммунологический ответы только на один пищевой продукт: коровье молоко как основной аллерген детского возраста. Особенности реакций на другие продукты, а также на антигены окружающей среды требуют дальнейшего изучения.
Заключение
По-видимому, из-за редкости заболевания и небольшого количества пациентов с дистрофической формой ВБЭ данные по коморбидности пищевой аллергии и ВБЭ не суммировались и не представлены в научной литературе (Web of Science и PubMed). Согласно полученным нами данным, коморбидность пищевой аллергии и ВБЭ достаточно характерна для дистрофических форм заболевания. Наличие коморбидной АБКМ приводит к утяжелению течения основного заболевания и требует внимания со стороны специалистов, занимающихся данной патологией.


