Обоснование
Рак желудка (РЖ) в структуре онкологической заболеваемости и смертности занимает ведущие позиции, при этом ежегодно возрастает число пациентов с агрессивными морфологическими формами аденокарциномы, связанными с инфильтративным ростом, ранним метастазированием и низкой резектабельностью [1–5]. У большинства пациентов РЖ диагностируется на поздних стадиях. Канцерогеном первого порядка является Helicobacter pylori-инфекция. Риск возникновения РЖ у инфицированных больных в 4 раза превышает неинфицированных, а при выявлении дисплазии высокой степени слизистой оболочки желудка риск развития РЖ повышается до 96% [6–10]. Нарушение регуляции процессов перекисного окисления липидов (ПОЛ) – антиоксидантной защиты (АОЗ) – вызывает уменьшение резистентности организма, способствует развитию и прогрессированию заболеваний. Активация ПОЛ характерна для многих злокачественных процессов [11–15]. Активные формы кислорода разрушают структуру ДНК, белков, различные мембранные компоненты клетки. Развитие гидрофильных зон из гидропероксидов жирных кислот в гидрофобном слое мембран вызывает набухание и дальнейшее разрушение клеток, способствуя проявлению заболевания [16–20].
Цель исследования: изучение закономерностей процессов ПОЛ-АОЗ при РЖ.
Методы
В комплексное лабораторное обследование были включены 50 пациентов с хроническим атрофическим гастритом (ХАГ) (24 мужчины и 26 женщин), средний возраст которых составил 45,1±1,9 года, и 50 больных РЖ (33 мужчин и 17 женщин), средний возраст – 50,3±2,9 года. Контрольной группой служили 85 практически здоровых донора без гастроэнтерологических жалоб и изменений слизистой оболочки желудка, по данным фиброэзофагогастродуоденоскопии (43 мужчины и 42 женщины), средний возраст – 46,8±1,3 года. Исследование проводилось с июня по сентябрь 2019 г. Объектом исследования была венозная кровь, которая забиралась у пациентов при поступлении натощак до начала патогенетического лечения в вакутейнеры с гепарином. По результатам исследования на персональном компьютере в пакете электронных таблиц MS Excel. 2010 была сформирована база данных. Их статистическая обработка проведена с помощью пакетов прикладных программ Statistica for Windows 8.0 (StatSoft Inc., США, 2008) и Microsoft Excel, 2007 (Microsoft, США). Обработка полученных данных включала подсчет непараметрических данных: медиану (Me) и персинтили (С25–75). Статистическую значимость различий определяли с использованием рангового критерия Манна–Уитни. Критический уровень значимости при проверки статистических гипотез принимался равным р<0,05.
Критерии включения: больные ХАГ (различного пола, возраста) и РЖ (различного пола, возраста, стадий и форм). Каждый участник подписывал форму информированного согласия на обследование, подтверждающее его добровольное участие в исследовании. Критерий исключения: отказ от участия в исследовании.
Отбор больных ХАГ осуществлялся в терапевтическом отделении НИИ МПС ФИЦ КНЦ СО РАН. Больные РЖ отбирались в КГБУЗ «Красноярский краевой клинический онкологический диспансер им. А.И. Крыжановского».
Исследование проводилось в рамках проекта «Разработка и внедрение программного комплекса скрининга и ранней диагностики РЖ по показателям иммунной, прооксидантной и антиоксидантной систем для снижения показателей смертности и инвалидизации населения» при поддержке Красноярского краевого фонда науки
У всех больных при поступлении в стационар однократно забиралась венозная кровь в пробирки Vacutainer с разделительным гелем и двойным активатором свертывания (кремнезем) с раствором гепарина натрия (5 ЕД/мл).
У всех обследованных пациентов выявляли наличие Н. pylori серологическим методом с помощью определения титра специфических антител к антигену СagА Н. pylori. Титры антител к H. pylori от 30 EIU и более считали положительным результатом определения H. pylori, менее 30 EIU – отрицательным.
Серологическая диагностика ХАГ тела желудка осуществлялась с помощью определения пепсиногенов в сыворотке крови. В сыворотке крови определялись пепсиноген-1, -2 с помощью иммуноферментного анализа (ИФА) на ИФА-анализаторе «СтатФакс-3000», с использованием тест-системы «Гастропанель» («Биохит», Финляндия). Диагноз выраженного ХАГ слизистой оболочки тела желудка ставили на основании уровня пепсиногена-1 менее 25 мкг/л и значения отношения пепсиноген-1/-2 менее 3. Показатели концентрации пепсиногена-1 от 25 до 50 мкг/л со значением отношения пепсиноген-1/-2 более 3 относили к слабо- и средневыраженной атрофии слизистой оболочки тела желудка. Окончательный диагноз верифицировался по результатам биопсии.
Показатели ПОЛ-АОЗ определяли спектрофотометрическими методами. В липидных системах в результате ПОЛ образуется малоновый диальдегид (МДА), взаимодействие которого с 2-тиобарбитуровой кислотой приводит к образованию хромогена с максимумом поглощения в красной области видимого спектра при длине волны 532 нм.
Определение восстановленного глутатиона при взаимодействии с 5,5’-дитио-бис-2-нитробензойной кислотой приводит к образованию окрашенного в желтый цвет аниона 2-нитро-5-тиобензоата, который регистрировали спектрофотометрически при длине волны 412 нм.
Активность глутатион-S-трансферазы (GST) определяли по скорости образования глутатион-S-конъюгатов между глутатионом и 1-хлор-2,4-динитробензолом. Увеличение концентрации конъюгатов в ходе реакции регистрировали спектрофотометрически при длине волны 340 нм.
Глутатионпероксидаза (ГП) катализирует реакцию взаимодействия глутатиона с гидроперекисью трет-бутила при длине волны 412 нм.
Принцип метода определения супероксиддисмутазы (СОД) основан на ингибировании реакции аутоокисления адреналина в щелочной среде, в ее присутствии при длине волны 347 нм.
Определение активности каталазы (CAT) основано на образовании окрашенного в желтый цвет комплекса неразрушенной в ходе каталазной реакции перекиси водорода с молибдатом аммония.
Определение ферроксидазной активности церулоплазмина (ЦП). Принцип метода основан на окислении n-фенилендамина при участии ЦП. Умножая значение оптической плотности на коэффициент пересчета 875, получают величину концентрации ЦП в мг/л.
Были изучены показатели иммунной системы ПОЛ-АОЗ на больных ХАГ и РЖ.
Исследование проводилось с разрешения этического комитета ФИЦ КНЦ СО РАН (протокол № 4 от 02.08.2019). В работе с обследованными пациентами соблюдались этические принципы, предъявляемые к ст. 24 Конституции РФ и Хельсинкской декларацией Всемирной медицинской ассоциации. Каждый участник подписывал форму информированного согласия на обследование, подтверждающего его добровольное участие в исследовании.
По результатам исследования на персональном компьютере в пакете электронных таблиц MS Excel. 2010 была сформирована база данных. Статистическая обработка данных проводилась с помощью пакетов прикладных программ Statistica for Windows 8.0 (StatSoft Inc., США, 2008) и Microsoft Excel, 2007 (Microsoft, США). Обработка полученных данных включала подсчет непараметрических данных: медиану (Me) и персинтили (С25–75). Статистическую значимость различий определяли с использованием рангового критерия Манна–Уитни. Критический уровень значимости при проверке статистических гипотез принимался равным р<0,05.
Результаты
В работе приведены результаты комплексного лабораторного обследования 50 пациентов с ХАГ (24 мужчины и 26 женщин), средний возраст которых составил 45,1±1,9 года, и 50 больных РЖ (33 мужчины и 17 женщин), средний возраст – 50,3±2,9 года. Контрольной группой служили 85 практически здоровых донора без гастроэнтерологических жалоб и изменений слизистой оболочки желудка по данным фиброэзофагогастродуоденоскопии (43 мужчины и 42 женщины), средний возраст – 46,8±1,3 года.
К практически здоровым лицам относили пациентов с отсутствием жалоб со стороны отделов желудочно-кишечного тракта, отсутствием гастроэнтерологического анамнеза, уровнем пепсиногена-1 более 50 мкг/л в сыворотке крови и соотношением пепсиноген-1/-2 более 3.
Диагноз ХАГ устанавливался врачом-гастроэнтерологом при фиброэзофагогастродуоденоскопии и морфологическом исследовании слизистой оболочки большой и малой кривизны тела желудка с использованием модифицированной Сиднейской классификации. Во время эндоскопического исследования осуществлялась прицельная биопсия из антрального отдела большой и малой кривизны тела желудка. Для качественной гистологической оценки срезы окрашивали гематоксилином и эозином. Диагностика РЖ проводилась врачами-онкологами в Красноярском краевом онкологическом диспансере на основании комплексного инструментального и морфологического обследований. В исследование были включены больные РЖ I, II, III стадий.
Мы изучили особенности работы про- и антиоксидантной систем по определению в плазме крови уровня МДА, содержание которого свидетельствует о выраженности ПОЛ в мембранах клеток. Изучение ферментативного звена антиоксидантной системы проводили оценкой активности ферментов СОД, CAT, GST, ГП и ЦП в плазме крови.
При изучении антиоксидантной системы у больных ХАГ в зависимости от уровня пепсиногена при сравнении с показателями больных РЖ мы получили следующие данные: в плазме крови у больных РЖ происходило 10-кратное увеличение уровня МДА по сравнению с таковым у больных ХАГ с PI<25 мкг/л и больными ХАГ с PI 25–50 мкг/л (p1–3<0,001, табл. 1), что может свидетельствовать о выраженном окислительном стрессе, вероятно, связанном в т.ч. с массовой гибелью клеток.

МДА является конечным продуктом ПОЛ и служит диагностическим маркером процессов радикального окисления, запускаемых в клетках активными формами кислорода. МДА – высокореакционное соединение, способное образовывать соединения с белками, углеводами и нуклеиновыми кислотами, снижая их биологическую активность. Увеличенное содержание МДА в плазме свидетельствует об избыточной продукции активных форм кислорода и не исключает также выраженного повреждения эндотелия кровеносных сосудов больных.
Ведущий фермент АОЗ СОД прекращает цепь свободнорадикальных процессов на стадии инициации одноэлектронного восстановления кислорода с образованием супероксидного анион-радикала. В плазме крови функционирует внеклеточная изоформа СОД. Повышение ее активности может свидетельствовать об увеличении содержания активных форм кислорода в межклеточной жидкости или избыточной продукции этого фермента клетками глии и фибробластами. У больных РЖ выявлялось 2-кратное уменьшение уровня данного фермента по сравнению с ХАГ. Угнетение фермента СОД при РЖ, вероятно, обусловлено токсическим действием самой опухоли на регуляторное звено.
Одним из важнейших антиоксидантных белков плазмы крови является церулоплазмин (ЦП), медьсодержащий гликопротеин, проявляющий ферроксидазную и супероксидустраняющую активность. ЦП ингибирует супероксидное и ферритин-зависимое ПОЛ в липопротеиновых частицах плазмы крови. Содержание ЦП в плазме крови больных РЖ отличалось от показателей всех исследуемых групп. Уровень ЦП у больных РЖ был существенно выше, чем во всех остальных исследуемых группах, что свидетельствует о его компенсаторном повышении для выполнения функции АОЗ.
Таким образом, у больных РЖ в целом наблюдалось усиление ПОЛ в виде увеличения в плазме крови концентрации МДА, угнетение ферментативного звена АОЗ (снижение активности СОД) и компенсаторного повышения активности белка (ЦП) с антиоксидантными свойствами.
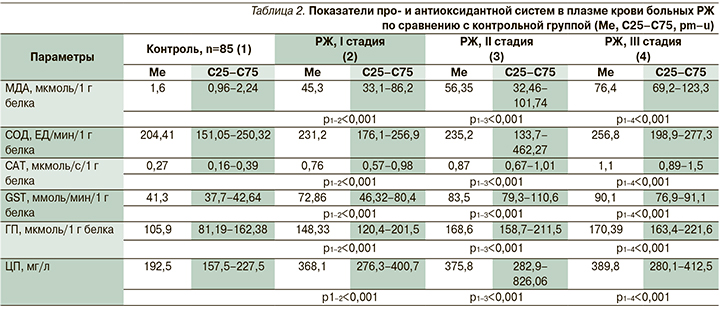
Мы изучили показатели про- и антиоксидантной систем у больных РЖ в зависимости от стадии по сравнению с контрольной группой. Содержание МДА в плазме крови у больных РЖ значительно увеличивалось относительно контроля на I стадии – в 40 раз, на II – в 50, на III – в 70 раз, что свидетельствовало об усилении ПОЛ, особенно на III стадии.
Активность ферментативного звена АОЗ повышалась у больных РЖ, показатели CAT, GST и ГП в плазме крови были увеличены в плазме крови, при этом их наибольшие значения выявлялись на III стадии. Повышенная активность ферментативного звена АОЗ не компенсирует усиленного ПОЛ.
У больных РЖ увеличивается ферроксидазная активность ЦП с наибольшими выявленными показателями на III стадии (табл. 2).
Обсуждение
У больных РЖ в плазме крови относительно контроля выявляется увеличение показателей МДА, CAT, GST, ГП, ЦП. Повышенная активность ферментативного звена антиоксидантной системы и антиоксидантного белка не могут компенсировать активацию ПОЛ, прооксидантные процессы превалируют над антиоксидантными при РЖ, вероятно, способствуя разрушению собственных клеток, вызывая прогрессирование заболевания. Наибольшие показатели выявлены на III стадии заболевания.
У больных РЖ в плазме крови относительно показателей больных ХАГ обнаруживается резкое увеличение (в 10 раз) уровня МДА, что свидетельствует о выраженном окислительном стрессе в организме. Снижение (в 2 раза) активности фермента СОД указывает на угнетение ведущего фермента в ферментативном звене АОЗ. Повышение (в 3 раза) содержания белка ЦП доказывает компенсаторную активацию других антиоксидантных систем в борьбе с окислительным стрессом.
Заключение
Высокие показатели уровней МДА и ЦП, низкая активность СОД – патогенетические механизмы в трансформации предракового состояния желудка – ХАГ в РЖ.


